修回日期: 2005-03-06
接受日期: 2005-03-23
在线出版日期: 2005-06-28
目的: 观察胃癌组织中树突状细胞及树突状细胞前体的分布, 并探讨survivin 作为胃癌生物治疗靶抗原的可能性.
方法: 用免疫组织化学染色对不同类型胃癌组织132例(中分化腺癌72例, 低分化腺癌60例)CD1a,CD68 ,S100和survivin 蛋白的表达进行了检测.
结果: 中分化腺癌CD1a表达率为33%(24/72), 低分化腺癌CD1a表达率为10%(6/60), 二者有显著性差异(c2 = 6.56, P<0.05).中分化腺癌S100表达率为50%(36/72), 低分化腺癌表达率30%(18/60), 二者无显著性区别(P>0.05).CD1a阳性胃癌组织S100表达均阳性, 二者有良好的一致性.中分化腺癌CD68表达为91.6%(66/72),低分化腺癌表达率为60%(36/60),二者无显著性差别(P>0.05), CD68和CD1a在中分化腺癌和低分化腺癌中的分布也有良好的一致性.Survivin在中分化腺癌的表达为91.7%(66/72), 低分化腺癌表达为90%(54/60), 二者无显著性差别(P>0.05).
结论: survivin和DC的结合在胃癌生物治疗中具有潜在而重要的应用价值, 以survivin为靶抗原的胃癌个体化DC疫苗值得进一步深入研究.
引文著录: 郭建巍, 秦力维, 吕同德, 杨霄鹏, 刘斌, 昌业伟. 胃癌组织CD1a和survivin表达及临床意义. 世界华人消化杂志 2005; 13(12): 1425-1428
Revised: March 6, 2005
Accepted: March 23, 2005
Published online: June 28, 2005
AIM: To investigate the distribution of dendritic cells (DCs) and DC precursors in gastric carcinoma (GC) and to discuss the possibility of survivin as the target antigen in GC immunotherapy.
METHODS: Immunohistochemical staining was used to detect the expression of CD1a, CD68, S100 and survivin protein in 132 cases of GC tissues, including 72 cases of moderately differentiated adenocarcinomas and 60 poorly differentiated ones.
RESULTS: The expression of CD1a in moderately differentiated GCs(33%, 24/72) was significantly higher (c2 = 6.56, P<0.05) than that in poorly differentiated ones (10%, 6/60). S100 expression was not markedly different between moderately (50%, 36/72) and poorly (30%, 18/60) differentiated GCs (P>0.05). The expression of CD1a was positively related to S100 protein. The distribution of CD68 molecules in moderately and poorly differentiated GCs was and 60% respectively and there was no significantly difference between them (P>0.05). The expression CD1a was also positively related to CD68 in GC.The expression of survivin protein was 91.7% (66/72) and 90%(54/60) in moderately and poorly differentiated GCs respectively, and there was no significant difference between them.
CONCLUSION: Combination of survivin and DC may play a valuable role in GC immunotherapy, and further studies on individualized DC vaccine against GC targeted on survivin antigen should be made in the future.
- Citation: Guo JW, Qin LW, Lu TD, Yang XP, Liu B, Chang YW. Clinical significance of CD1a and survivin expression in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2005; 13(12): 1425-1428
- URL: https://www.wjgnet.com/1009-3079/full/v13/i12/1425.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i12.1425
树突状细胞(dendritic, DC)是体内功能最强的专职抗原呈递细胞(APC), 也是天然免疫和获得性免疫的重要调节剂, 在免疫应答中发挥着不可替代的作用, 由DC激活的T细胞免疫在抗肿瘤过程中起着主导作用.关于DC个体化疫苗临床应用的I, II期试验已取得令人鼓舞的结果, 显示出DC疫苗在恶性肿瘤治疗中的巨大前景.已有的研究显示, 肿瘤可使DC功能失常、DC凋亡及免疫反应中的信号传导分子缺失[1].因此, 肿瘤组织中DC和其前体细胞数目的多少和质量直接影响到患者抗肿瘤免疫应答反应的高低, 进而影响到患者的生存质量.我们调研胃癌组织中DC和其前体细胞的分布, 并探讨survivin作为胃癌肿瘤生物治疗靶抗原的可能性, 从而为胃癌个体化DC疫苗的临床研究和应用奠定基础.
1996-1998年手术切除胃癌标本132例, 中分化腺癌72例, 低分化腺癌60例; 生物素化羊抗鼠IgG, HRP标记链亲和素(streptoavidin), Rabbit anti-S100 Protein, Rabbit Anti-survivin (Boster Biotechnology Co.LTD), 内源性生物素封闭试剂(Avidin Biotin Blocking System, 武汉博士德生物有限公司), mAb Anti-Human CD68、 mAb Anti-Human CD1a(福州迈新生物技术开发有限公司).
手术切除胃癌组织40 mL /L 甲醛固定, 常规法脱水、浸蜡、包埋, 切片厚度5-7 mm, 用苏木素染10 min, 过20 mL/L 盐酸酒精, 2 mL/L氨水返蓝5 min, 伊红复染30 s, 自来水洗后梯度乙醇脱水各2-5 min, 500 mL/L及纯二甲苯透明各2-5 min, 中性树脂封片, 普通光学显微镜观察.手术切除胃癌组织石蜡切片用Triton-X-100, 1 g/L柠檬酸三钠处理10 min, PBS洗两次各5 min, 用7.5 mL/L H2O2阻断内源性过氧化物酶15 min, PBS洗2次各3 min, 加1∶20稀释的正常羊血清100 mL, 置湿盒内37℃, 30 min, 滤纸吸去血清; 分别加20 mg/L 100 mL 4种mAb和PBS(作空白对照), 置湿盒内37℃, 1 h, 取出4℃过夜, PBS洗2次各5 min, 滴加1∶200稀释的生物素化羊抗鼠/兔IgG抗体50 mL, 置湿盒内37℃, 30 min, PBS泡洗2次各5 min, 滴加1∶200稀释的HRP标记链亲和素, 置湿盒内37℃, 30 min, PBS泡洗2次各5 min; 加DAB工作液50 mL, 镜下观察适时终止, 自来水充分冲洗, 最后苏木精复染、脱色、返蓝、逐级脱水、透明、封片, 普通光学显微镜观察.
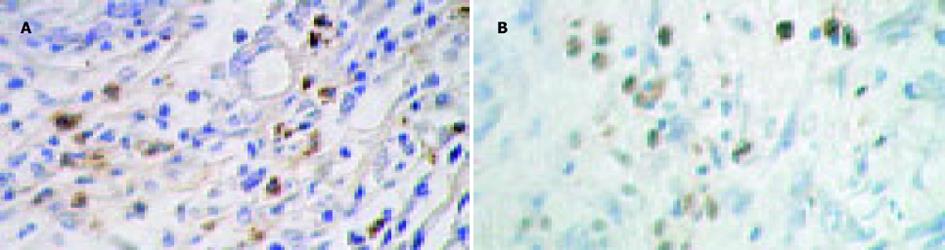
中分化腺癌CD1a表达率为33%(24/72), 低分化腺癌CD1a表达率为10%(6/60), 二者有显著性差异(c2 = 6.56, P<0.05, 图1).
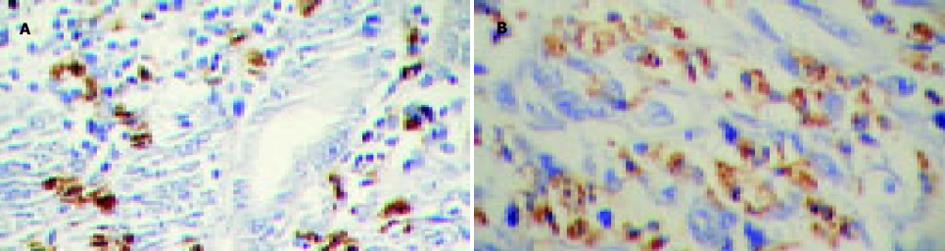
中分化腺癌的表达为91.7%, 低分化胃癌表达为90%, 二者无显著性差异(P>0.05, 图2).
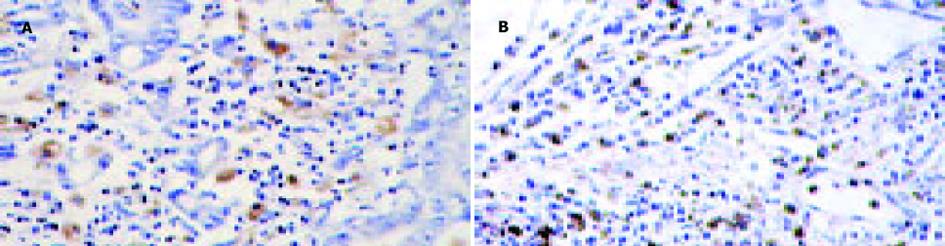
中分化腺癌CD68表达为91.6%, 低分化腺癌表达率为60%, 二者无显著性区别(c2 = 2.45, P>0.05, 图3), CD68在肿瘤组织中分布的高低与分化程度无关, CD68和CD1a在中分化腺癌和低分化腺癌中的分布有良好的一致性.
中分化腺癌中S100表达率为50%, 低分化腺癌表达率为30%, 二者无显著性区别(c2 = 2.31, P>0.05, 图4).CD1a阳性的胃癌组织S100表达均为阳性.
肿瘤患者DC功能处于失常状态[1], 这也是肿瘤免疫治疗受限的原因之一.在DC疫苗的研究中, 进展期肿瘤患者的T细胞能否被其自身负载肿瘤肽的DC所激发, 以引起抗肿瘤免疫应答呢?对表达CEA肿瘤转移患者的研究显示: HLA-A2+患者DC负载CEA肽Cap-1, HLA-A2-患者DC负载CEA mRNA, 绝大多数患者均可产生针对CEA的CTL, 其DC表型为CD11c+, CD40+, CD86+, HLA-DR+, CD83(低), CD14(低), CD80(低), 说明大多数患者对CEA并非无反应性, 旦具功能性DC.DC负载CEA RNA的CTL反应与DC负载CEA肽相似[2], 在肝癌患者, DC负载肝癌细胞可溶性抗原可诱导针对肝癌特异性的免疫应答[3].提示用患者自身的DC负载肿瘤相关抗原, 可用于自身肿瘤的治疗.S100蛋白主要表达于树突状细胞、郎罕细胞、胶质细胞、血旺细胞、软骨细胞和黑色素瘤细胞等, 但基于胃癌的组织生物学特性, S100蛋白应该只表达于肿瘤组织周围的树突状细胞和郎罕氏细胞.为了解胃癌组织中树突状细胞分布情况, 选择用DC的特异性标志CD1a.S100和CD1a联检的目的在于真实有效的反映肿瘤组织周围DC的数目和质量.结果表明: CD1a阳性的胃癌组织S100表达均为阳性, 二者有良好的一致性.CD68属酸性溶菌酶糖蛋白, 主要表达于单核细胞、巨噬细胞和粒细胞表面.在人体组织中, DC的分化主要源于单核细胞、巨噬细胞和造血干细胞, 我们用其作DC前体细胞的标志, 以了解胃癌组织中DC前体和DC数量的分布.结果显示, 未分化腺癌CD68表达为91.6%, 低分化腺癌表达为60%; 进而检测胃癌组织DC表达, 中分化腺癌为33%, 低分化腺癌为10%, 二者分布无明显差异.DC前体细胞和DC在中分化腺癌和低分化腺癌中的分布有良好的一致性, 说明DC及前体细胞分布与肿瘤的分化程度密切相关, 分化较好的胃癌组织中DC数量高于分化较差的胃癌组织, 但DC前体细胞的分布没有差别, 说明分化差的胃癌组织也有良好的DC前体细胞储备.检测胃癌病灶周围CD1a和CD68的分布为患者预后的判断提供了参考.既然胃癌组织中含有大量DC前体细胞, 通过适当的诱导完全有可能使其转化成具有强大抗原呈递功能的DC, 进而在机体抗胃癌免疫应答中发挥作用.生存素(survivin)主要通过抑制凋亡中主要的效应蛋白酶caspase 3和caspase 7(处在凋亡机制核心的一组蛋白裂解酶, 细胞在受刺激、损伤或接到死亡指令等信号时, 此酶被激活, 从而启动凋亡)来介导凋亡的抑制.survivin在正常成人组织中不表达, 在一些人类肿瘤如: 鳞状细胞癌、食管癌、结肠癌、胃癌、胰腺癌、乳腺癌、膀胱癌、肝癌、黑色素瘤等高表达[4-13].生存素在肿瘤中的过量表达提示其在肿瘤发生过程中的作用表现为对肿瘤细胞的凋亡抑制.肿瘤患者survivin过度表达预示着患者预后较差[14-15], 同时对抗肿瘤药物的抵抗力增加[16].生存素的过量表达将导致肿瘤细胞对化疗药物诱导凋亡的抵抗, 相反, 针对生存素的反义治疗将导致肿瘤细胞的凋亡和对化疗的敏感性增加[17].因此, 生存素具备在肿瘤诊治中作为广谱肿瘤抗原的条件.
Schmitz et al[18] 研究报道, 当生存素抗原被DC加工并被呈递时可在体外诱导特异性CTL, DC负载可溶性的生存素重组抗原后也可诱导出MHC-I限制性CTL, 除此之外, 还能诱导出针对HLA-A2限制性生存素来源肽表位的CTL细胞系.上述系列研究为以survivin为主要靶抗原的肿瘤特异性治疗提供了实验依据.
既然胃癌组织高表达survivin, 胃癌病灶周围存在大量DC前体细胞, DC的分布又与胃癌分化程度密切相关, 因此, DC与胃癌的发生发展具有密切的联系, 在胃癌的生物治疗中, 通过DC使之负载肿瘤相关抗原survivin, 持续高水平表达多种肿瘤抗原表位, 并通过MHC-I、MHC-II类分子得到充分的呈递, 然后将这些负载有survivin抗原的致敏DC回输机体, 以诱导机体产生有效的抗胃癌免疫应答, 是胃癌生物治疗的另一有效途径, 应该说负载survivin的DC个体化疫苗在胃癌患者具有潜在而重要的应用价值, 值得进一步深入研究.
编辑: 潘伯荣 审读: 张海宁
| 1. | Mailliard RB, Dallal RM, Son YI, Lotze MT. Dendritic cells promote T-cell survival or death depending upon their maturation state and presentation of antigen. Immunol Invest. 2000;29:177-185. [PubMed] [DOI] |
| 2. | Nair SK, Hull S, Coleman D, Gilboa E, Lyerly HK, Morse MA. Induction of carcinoembryonic antigen (CEA)-specific cytotoxic T-lymphocyte responses in vitro using autologous dendritic cells loaded with CEA peptide or CEA RNA in patients with metastatic malignancies expressing CEA. Int J Cancer. 1999;82:121-124. [PubMed] [DOI] |
| 4. | Zhao J, Tenev T, Martins LM, Downward J, Lemoine NR. The ubiquitin-proteasome pathway regulates survivin degradation in a cell cycle-dependent manner. J Cell Sci. 2000;113:43634371. [PubMed] |
| 5. | Miller M, Smith D, Windsor A, Kessling A. Survivin gene expression and prognosis in recurrent colorectal cancer. Gut. 2001;48:137138. [PubMed] [DOI] |
| 6. | Kawasaki H, Toyoda M, Shinohara H, Okuda J, Watanabe I, Yamamoto T, Tanaka K, Tenjo T, Tanigawa N. Expression of survivin correlates with apoptosis, proliferation, and angiogenesis during human colorectal tumorigenesis. Cancer. 2001;91:20262032. [PubMed] [DOI] |
| 7. | Kato J, Kuwabara Y, Mitani M, Shinoda N, Sato A, Toyama T, Mitsui A, Nishiwaki T, Moriyama S, Kudo J. Expression of survivin in esophageal cancer: correlation with the prog-nosis and response to chemotherapy. Int J Cancer. 2001;95:9295. [PubMed] [DOI] |
| 8. | Sarela AI, Verbeke CS, Ramsdale J, Davies CL, Markham AF, Guillou PJ. Expression of survivin, a novel inhibitor of apoptosis and cell cycle regulatory protein, in pancreatic adenocarcinoma. Br J Cancer. 2002;86:886892. [PubMed] [DOI] |
| 9. | Williams NS, Gaynor RB, Scoggin S, Verma U, Gokaslan T, Simmang C, Fleming J, Tavana D, Frenkel E, Becerra C. Identification and validation of genes involved in the pathogenesis of colorectal cancer using cDNA microarrays and RNA interference. Clin Cancer Res. 2003;9:931946. [PubMed] |
| 10. | Tanaka K, Iwamoto S, Gon G, Nohara T, Iwamoto M, Tanigawa N. Expression of survivin and its relationship to loss of apoptosis in breast carcinomas. Clin Cancer Res. 2000;6:127134. [PubMed] |
| 11. | Smith SD, Wheeler MA, Plescia J, Colberg JW, Weiss RM, Altieri DC. Urine detection of survivin and diagnosis of bladder cancer. JAMA. 2001;285:324328. [PubMed] [DOI] |
| 12. | Ito T, Shiraki K, Sugimoto K, Yamanaka T, Fujikawa K, Ito M, Takase K, Moriyama M, Kawano H, Hayashida M. Survivin promotes cell proliferation in human hepatocellular carcinoma. Hepatology. 2000;31:10801085. [PubMed] [DOI] |
| 13. | Grossman D, McNiff JM, Li F, Altieri DC. Expression and targeting of the apoptosis inhibitor, survivin, in human melanoma. J Investig Dermatol. 1999;113:10761081. [PubMed] [DOI] |
| 14. | Moriai R, Asanuma K, Kobayashi D, Yajima T, Yagihashi A, Yamada M, Watanabe N. Quantitative analysis of the anti-apoptotic gene survivin expression in malignant haematopoietic cells. Anticancer Res. 2001;21:595600. [PubMed] |
| 15. | Sarela AI, Scott N, Ramsdale J, Markham AF, Guillou PJ. Immunohistochemical detection of the anti-apoptosis protein, survivin, predicts survival after curative resection of stage II colorectal carcinomas. Ann Surg Oncol. 2001;8:305310. [PubMed] [DOI] |
| 16. | Zaffaroni N, Daidone MG. Survivin expression and resist-ance to anticancer treatments: perspectives for new therapeutic inter-ventions. Drug Resist Updat. 2002;5:6572. [PubMed] [DOI] |
| 17. | Olie RA, Simoes-Wust AP, Baumann B, Leech SH, Fabbro D, Stahel RA, Zangemeister-Wittke U. A novel antisense oligonucleotide targeting survivin expression induces apoptosis and sensitizes lung cancer cells to chemotherapy. Cancer Res. 2000;60:2805-2809. [PubMed] |
| 18. | Schmitz M, Diestelkoetter P, Weigle B, Schmachtenberg F, Stevanovic S, Ockert D, Rammensee HG, Rieber EP. Generation of survivin-specific CD8+ T effector cells by dendritic cells pulsed with protein or selected peptides. Cancer Res. 2000;60:4845-4849. [PubMed] |