修回日期: 2005-04-15
接受日期: 2005-04-27
在线出版日期: 2005-06-28
目的: 探讨硫酸葡聚糖钠(dextran sodium sulphate, DSS)诱导的小鼠肠炎模型病变结肠组织的谷胱甘肽(GSH)变化及其与病变组织分泌的Th1/Th2型细胞因子IFN-γ,IL-4及黏膜损伤的关系.
方法: 实验组小鼠(n = 10)给予含50 g/L DSS的蒸馏水自由饮用7 d之后处死, 分离出的病变结肠一部分评价其病理学改变并用GSH1抗体做免疫组化, 另一部分结肠培养后检测其IL-4、IFN-γ的表达.对照组小鼠(n = 10)给予蒸馏水自由饮用7 d之后处死.
结果: DSS诱导实验性肠炎小鼠口服50 g/L的DSS溶液7 d出现体重减轻、腹泻、血便等急性肠炎的表现.病理学切片HE染色发现小鼠病变结肠腺体结构紊乱, 黏膜和黏膜下单核细胞和多核细胞浸润.DSS组病变肠段组织GSH表达较对照组明显减少(2±0.6 vs 3.14±1.0, t = 3.95, P = 0.01<0.05), 病变结肠分泌的IL-4明显升高(38.7±4.7 vs 28.7±6.7, t = 3.16, P = 0.009<0.01), IFN-γ轻度降低(P>0.05).
结论: DSS诱导的实验性肠炎小鼠病变结肠组织GSH的减少与病变结肠组织分泌的细胞因子IL-4增加、IFN-γ下降以及黏膜损伤相关.
引文著录: 张静, 韩英, 纪欣, 王志红, 李虹义, 郑力. GSH在DSS诱导的小鼠实验性肠炎中的作用. 世界华人消化杂志 2005; 13(12): 1400-1403
Revised: April 15, 2005
Accepted: April 27, 2005
Published online: June 28, 2005
AIM: To investigate the expression of glutathione (GSH) in dextran sodium sulphate(DSS)-induced colitic mucosa and its relationship with cytokine secretion as well as mucosal injury.
METHODS: BALB/c mice in DSS group (n = 10) were fed with 50 g/L DSS to induce experimental colitis and those in normal controls (n = 10) were fed with distilled water. All the mice were killed after 7 days. The pathological changes of the colonic tissues were examined while immunohi-stochemstry was performed with GSH1 antibody to determine the GSH expression. ELISA was used to detect the expression of IL-4 and IFN-γ.
RESULTS: The manifestations of acute colitis such as weight decrease, diarrhea and bloody stool appeared in mice of DSS group. focal crypt lesionsPathologically, focal crypt distortion, granulocyte and macrophage invasion were observed. The level of GSH in DSS group was significantly lower than that in control group (20.6 vs 3.14±1.0, t = 3.95, P = 0.01), whereas the expression of IL-4 was marked higher (38.7±4.7 vs 28.7±6.7, t = 3.16, P = 0.009). The content of IFN-γ was decreased in DSS group (P>0.05).
CONCLUSION: Low expression of GSH is related to the increase of IL-4, decrease of IFN-γ and mucosal injury in DSS-induced colitis in mice.
- Citation: Zhang J, Han Y, Ji X, Wang ZH, Li HY, Zheng L. Roles of Glutathione in dextran sodium sulphate-induced colitis in mice. Shijie Huaren Xiaohua Zazhi 2005; 13(12): 1400-1403
- URL: https://www.wjgnet.com/1009-3079/full/v13/i12/1400.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i12.1400
炎症性肠病炎(inflammatory bowel disease, IBD)是一组病因不明的慢性肠道炎症性疾病, 包括了两种独立的疾病, 溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD).虽然IBD的发病机制尚不清楚, 目前发现其病因学机制与免疫异常、遗传影响、以及环境因素有关.近年来的研究发现, 反应性氧簇(reactive oxygen species, ROS)产生过量对IBD的发展起着重要的作用.胃肠道黏膜自身有一些抗氧化防御系统, 可以通过中和连续生成的ROS抵消其损害的影响.在这些防御网络中, 内生硫氢基团, 主要是还原型谷胱甘肽(GSH), 在一些动物模型中对胃肠道黏膜细胞保护抵抗氧化应激起着重要的作用[1-2].以往对抗氧化剂作用的大量研究中, 已经报道了在IBD患者和实验性肠炎中包括GSH在内的抗氧化剂水平的降低[3-4], 而对于DSS诱导的实验性肠炎病变组织GSH的变化及其与黏膜损伤及细胞因子分泌的关系尚不明确, 本实验将对上述问题进行研究和分析.
雄性BALB/c小鼠, 5-6周龄, 质量18-22 g; DSS(Sodium Dextran Sulfate 5000, Wako Pure Chemical Industries Ltd.大阪, 日本和光纯药工业株式会社); HBSS(Hank's balanced salt solution, Sigma公司); 无酚红、无抗生素的RPMI 1640(HyClone, 公司); complete medium RPMI 1640(Cambrex公司); LPS(脂多糖, Sigma公司); DTT(1, 4-Dithiothretol, 二硫基苏糖醇, Sigma公司); 胎牛血清FBS(中国杭州江滨生物技术有限公司); 小鼠IL-4、IFN-γ检测试剂盒(Sigma公司); GSH1: 山羊GSH抗体(Santa Cruz公司, sc-15087); 山羊SP试剂盒(北京中杉生物试剂公司).
取10只BALB/c小鼠, 将DSS加入蒸馏水中配成50 g/L的DSS溶液, 给小鼠自由饮用7 d, 8 d处死.正常对照组小鼠10只给予蒸馏水自由饮用7 d, 8 d处死.各组小鼠处死后, 先将整段结肠取下, 测量结肠长度, 肉眼观察结肠的形态, 充血、溃疡、糜烂程度和范围, 计算质量减少率.取充血、糜烂最明显部位的肠段(环状、片状各1块, 正常组取回盲部及近肛门部组织环状、片状各1块)于中性甲醛溶液小瓶送检病理.便血评分: 便血评分将取病理后的肠段纵行切开, 其血性内容物用0-3+标准评价: 0: 无出血, 1+: 结肠1/3出血, 2+: 结肠2/3出血, 3+: 整个结肠均有出血.肠道标本积分: 炎症细胞的渗出评分标准: 0分-黏膜固有层内有极少量炎症细胞, 1分-黏膜固有层内有较多的炎症细胞或黏膜固有层内的炎症细胞增多, 2分-炎症细胞扩散至黏膜下层, 3分-全层均有炎症细胞渗出; 组织损伤评分标准: 0分-没有黏膜损坏, 1分-不连续的淋巴上皮损坏, 2分-表层黏膜糜烂, 3分-广泛的黏膜破损并向肠壁深层结构扩展[5].
1.2.1 病变组织GSH的表达: 应用山羊GSH1抗对病变组织切片进行免疫组化分析, 并根据阳性强度及阳性率评分的半定量标准.阳性强度评分标准: 0分: (-), 1分: (+), 2分: (++), 3分(+++).阳性率评分标准: 0分: <10%, 1分: 10-25%, 2分: 26-50%, 3分: >50%.总分为0-6分.
1.2.2 病变组织产生细胞因子的测定: 将肠道病变组织标本置于含10 mmol/L DTT的HBSS中静置15 min, 而后用RPMI1640液清洗肠段2次以除去DTT, 在六孔培养板中加入含100 mL/L FBS 1 mL的RPMI1640共2 mL, 置于CO2孵育箱内培养24 h, 然后收集池内培养液, 分装在3个eppindofe管中, -30℃冻存.应用小鼠IL-4, IFN-γ检测试剂盒(ELISA法)测定IL-4, IFN-γ.
统计学处理 应用STATA 7.0软件进行统计学处理, 先用F检验, 验证方差齐性, 再进行t检验, P<0.05为差异有显著性.
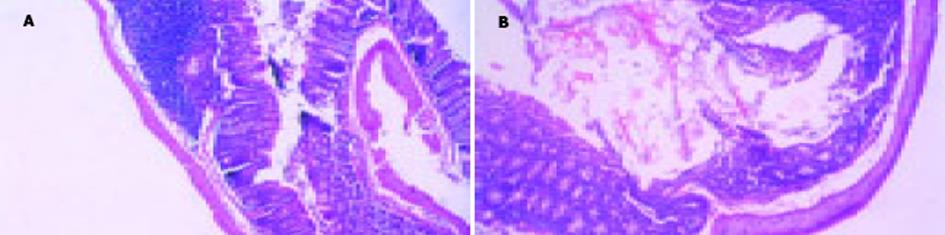
BALB/c小鼠口服50 g/L的DSS溶液7 d成功诱导出急性肠炎, 表现为体重减轻、腹泻、血便等.病理学切片HE染色发现小鼠左半结肠较右半结肠为重, 结肠腺体结构紊乱, 黏膜及黏膜下单核细胞和多核细胞浸润等.质量: DSS组小鼠体重下降而正常对照组体重增加(-0.7±0.8 g vs 2.4±0.9 g, t = -7.47, P = 0<0.001).血便: 正常对照组小鼠结肠处死后结肠切开未发现血便, 而DSS诱导组6只小鼠结肠发现血便(0.7±0.5 vs 0, t = 4.42, P = 0.003<0.001).结肠缩短: DSS诱导肠炎组小鼠与正常对照组小鼠比较, 结肠有明显的充血, 水肿, 溃疡形成及长度缩短(9.2±0.6 vs 10.4±0.8, t = -3.72, P = 0.0 017 <0.01).病理评分: 结肠病理切片HE染色发现, DSS诱导的实验性肠炎组小鼠的结肠局部腺体结构紊乱, 黏膜及黏膜下中性粒细胞及单核细胞和多核细胞等炎性细胞浸润, 黏膜局部糜烂, 部分隐窝破坏, 而对照组小鼠未发现上述变化(3.0±0.5 vs 0.4±0.7, t = -8.18, P = 0<0.001, 图1).
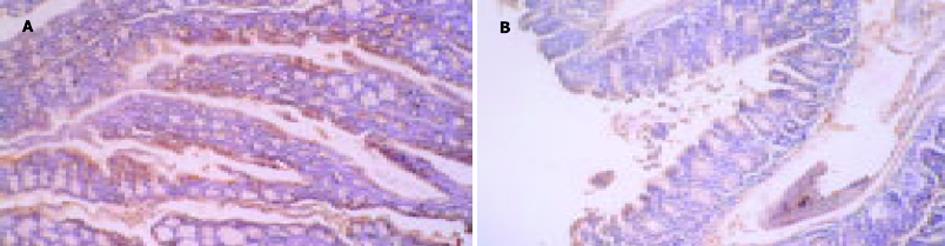
应用山羊GSH1抗对病变组织切片进行免疫组化分析, 发现GSH主要表达在黏膜表面及腺体细胞的胞质内.通过半定量标准评分, 发现DSS诱导实验性肠炎小鼠的病变肠段组织GSH表达明显低于对照组 (2±0.6 vs 3.14±1.0, t = 3.95, P = 0.01<0.05, 图2).
DSS组病变肠段分泌的Th2细胞因子IL-4 显著高于对照组(38.7±4.7 vs 28.7±6.7, t = 3.16, P = 0.009<0.05); DSS组病变肠段分泌的Th1细胞因子IFN-g较对照组减少但差别无显著性(20.6±7.4 vs 23.2±5.6, t = -0.70, P = 0.50>0.05).由于DSS组IL-4显著升高, 同时IFN-g下降, 致IL-4/IFN-g升高, 显著高于对照组(1.88, 1.24).
DSS诱导的BALB/c小鼠急性实验性肠炎模型表现为体重减轻, 腹泻, 血便等.病理学检查发现小鼠左半结肠病变较右半结肠为重, 结肠黏膜腺体结构紊乱, 单核细胞和多核细胞浸润, 黏膜局部糜烂, 部分隐窝破坏等[6-7].IBD患者的胃肠道炎症中渗透的大量炎症细胞包括巨噬细胞和中性粒细胞等通过产生反应性氧簇(reactive oxygen species, ROS)而将炎症肠道暴露于氧化应激中.而胃肠道黏膜自身有一些抗氧化防御系统, 可以通过中和连续生成的ROS抵消其损害的影响.在这些防御网络中, 内生硫氢基团, 主要是还原型谷胱甘肽(GSH)起着重要的作用.GSH是一种包含一个巯基的非蛋白三肽, GSH大量存在于各种不同细胞中在多种生化过程中起着重要的作用.GSH构成细胞防御氧化损伤机制中的第一道防线, 而且是普遍存在的细胞类型中的主要氧化还原缓冲剂.在其众多功能中, 其含半胱氨酸的三肽可以减轻蛋白质的二硫化, 减轻自由基和内毒素的毒性作用, 并维持细胞内氧化还原的平衡[8].Sido et al[4]的研究发现与健康对照组比较IBD患者半胱氨酸浓度明显减少, 其减低水平与疾病临床活动指数相关, 去蛋白血浆中总的巯基成分均明显减少, 术后3 mo恢复到正常水平.Zea-Iriarte et al[9]发现在TNS(三硝基苯硫酸, trinitrobenzene sulphonic acid)诱导的实验性肠炎中, GSH浓度及谷胱甘肽硫基转移酶, Cu, Zn超氧化物歧化酶均减低, 但是谷胱甘肽过氧化物酶却增加.我们的实验研究发现 DSS组病变肠段组织GSH表达明显低于对照组 (2±0.6 vs 3.14±1.0, t = 3.95, P = 0.01<0.05), 与文献报告相似, 说明GSH不足与IBD和实验性肠炎的炎症相关, 削弱黏膜的抗氧化能力可能会促进肠道的氧化损伤.
Th1和Th2细胞因子反应类型对于小鼠炎症和感染的慢性化和侵袭性可产生影响, 是慢性肠道炎症重要的决定因素.Th1/Th2型反应平衡是由分泌细胞因子的类型决定的.Th1型是以通过伴随抗原提呈细胞(APC)生成的IL-12而产生IFN-g为特征.Th2型则是以低IFN-g/高IL-4和低IFN-g/高IL-10为特征[10].本实验中DSS诱导的实验性肠炎小鼠病变肠段分泌的IL-4明显增加, IFN-g下降, 致IL-4/IFN-g显著升高, 说明DSS诱导的急性实验性肠炎是以Th2型免疫反应为主的炎性改变.Peterson et al[11]和Murata et al[12]曾报道鼠的抗原提呈细胞(APC)或腹腔定居的巨噬细胞中GSH的损耗可使IL-12的分泌减少并导致典型的Th1细胞因子形式向Th2反应模式转化.Peterson et al[11]的研究还显示应用GSH损耗或补充药物时巨噬细胞内GSH的水平可以影响Th1/Th2细胞因子的倾向.且将来源于GSH损耗小鼠的T细胞与未处理的BALB/C鼠的巨噬细胞一起培养可产生正常量的IFN-g, 因此IFN-g产量减少是由于巨噬细胞而不是T细胞中GSH损耗造成的.另外Jeannin et al[13]在研究易于产生IL-4的培养细胞系统中发现在培养液中增加GSH的水平可使IL-4的产量以量效依赖的方式减低.这些研究结果充分表明巨噬细胞内的GSH水平对于调节在免疫反应中向Th1或Th2细胞因子反应的发展趋势具有重要的作用.
总之, 本研究结果显示DSS诱导的急性实验性肠炎小鼠病变结肠的组织GSH的减少与病变结肠组织分泌的细胞因子IL-4增加、IFN-g减低及结肠黏膜损伤有相关性, 但是其机理不明.GSH的表达有可能影响不同类型炎性细胞因子的分泌进而影响黏膜组织的损伤.同时提示肠道黏膜免疫异常在IBD发病机制中的作用不容忽视, 特别是巨噬细胞中的GSH的变化是否与黏膜炎症损伤及Th1/Th2细胞因子分泌的相关性有待于探讨.
编辑: 潘伯荣 审读: 张海宁
| 1. | Goldin E, Ardite E, Elizalde JI, Odriozola A, Panes J, Pique JM, Fernandez-Checa JC. Gastric mucosal damage in experimental diabetes in rats: role of endogenous glutathione. Gastroenterology. 1997;112:855-863. [PubMed] [DOI] |
| 2. | Takeuchi K, Okada M, Ueshima K, Ohuchi T, Okabe S. Endogenous sulfhydryls in healing gastric mucosal injury induced by HCl in the rat. Digestion. 1993;54:91-97. [PubMed] [DOI] |
| 3. | Holmes EW, Yong SL, Eiznhamer D, Keshavarzian A. Glutathione content of colonic mucosa: evidence for oxidative damage in active ulcerative colitis. Dig Dis Sci. 1998;43:1088-1095. [PubMed] [DOI] |
| 4. | Sido B, Hack V, Hochlehnert A, Lipps H, Herfarth C, Droge W. Impairment of intestinal glutathione synthesis in patients with inflammatory bowel disease. Gut. 1998;42:485-492. [PubMed] [DOI] |
| 5. | Loher F, Schmall K, Freytag P, Landauer N, Hallwachs R, Bauer C, Siegmund B, Rieder F, Lehr HA, Dauer M. The specific type-4 phosphodiesterase inhibitor mesopram alleviates experimental colitis in mice. J Pharmacol Exp Ther. 2003;305:549-556. [PubMed] [DOI] |
| 6. | Konrad A, Mahler M, Flogerzi B, Kalousek MB, Lange J, Varga L, Seibold F. Amelioration of murine colitis by feeding a solution of lysed Escherichia coli. Scand J Gastroenterol. 2003;38:172-179. [PubMed] [DOI] |
| 7. | Villegas I, Alarcon de la Lastra C, Orjales A, La Casa C. A new flavonoid derivative, dosmalfate, attenuates the development of dextran sulphate sodium-induced colitis in mice. Int Immunopharmacol. 2003;3:1731-1741. [PubMed] [DOI] |
| 8. | Murata Y, Amao M, Yoneda J, Hamuro J. Intracellular thiol redox status of macrophages directs the Th1 skewing in thioredoxin transgenic mice during aging. Mol Immunol. 2002;38:747-757. [PubMed] [DOI] |
| 9. | Zea-Iriarte WL, Makiyama K, Goto S, Murase K, Urata Y, Sekine I, Hara K, Kondo T. Impairment of antioxidants in colonic epithelial cells isolated from trinitrobenzene sulphonic acid-induced colitis rats. Protective effect of rebamipide. Scand J Gastroenterol. 1996;31:985-992. [PubMed] [DOI] |
| 10. | Romagnani P, Annunziato F, Piccinni MP, Maggi E, Romagnani S. Th1/Th2 cells, their associated molecules and role in pathophysiology. Eur Cytokine Netw. 2000;11:510-511. [PubMed] |
| 11. | Peterson JD, Herzenberg LA, Vasquez K, Waltenbaugh C. Glutathione levels in antigen-presenting cells modulate Th1 versus Th2 response patterns. Proc Natl Acad Sci USA. 1998;95:3071-3076. [PubMed] [DOI] |
| 12. | Murata Y, Ohteki T, Koyasu S, Hamuro J. IFN-gamma and pro-inflammatory cytokine production by antigen-presenting cells is dictated by intracellular thiol redox status regulated by oxygen tension. Eur J Immunol. 2002;32:2866-2873. [PubMed] [DOI] |
| 13. | Jeannin P, Delneste Y, Aubry JP, Lecoanet-Henchoz S, Gauchat JF, Life P, Bonnefoy JY. Thiols decrease human IL-4 production and IL-4-induced immunoglobulin synthesis. Int Arch Allergy Immunol. 1997;113:329-330. [PubMed] [DOI] |