修回日期: 2005-03-20
接受日期: 2005-04-08
在线出版日期: 2005-06-28
目的: 观察过表达的DNA聚合酶b对食管癌EC9706细胞系的影响.
方法: 运用PCR方法, 从质粒pcDNA3.1-polb中扩增出野生型和突变型的DNA聚合酶b基因,作为目的片段, 定向克隆至pEGFP-C3真核绿色荧光蛋白表达载体, 获得野生型和突变型的重组真核表达载体pEGFP-C3-polb.分别将野生型和突变型的pEGFP-C3-polb转染EC9706细胞, 荧光显微镜观察其定位, 绘制生长曲线, 测定细胞周期.
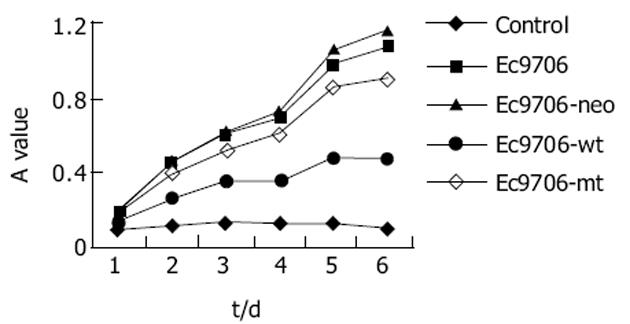
结果: DNA序列分析证实了重组载体中的DNA聚合酶b序列正确, 荧光显微镜结果显示野生型的DNA聚合酶b表达以细胞核为主, 突变型的DNA聚合酶b则表达在整个细胞中, 明显与野生型的DNA聚合酶b的核定位不同.而且, 野生型的细胞生长较对照组缓慢(P<0.05), 野生型的还能抑制EC9706细胞的生长和使S期细胞减少(22.11±0.12 vs 44.86±0.03, P<0.05), 而突变型的则不能促进EC9706细胞的生长, S期细胞增殖不明显(P>0.05).
结论: 过表达的野生型食管癌DNA聚合酶b可以降低EC9706细胞的增殖.
引文著录: 赵军, 路静, 宋谦, 崔自由, 赵国强, 黄幼田, 杨洪艳, 赵继敏, 董子明. DNA聚合酶b过表达对食管癌EC9706细胞的影响. 世界华人消化杂志 2005; 13(12): 1377-1381
Revised: March 20, 2005
Accepted: April 8, 2005
Published online: June 28, 2005
AIM: To observe the effect of over-expressed DNA polymerase b on the malignant degree of EC9706 cells of esophageal cancer.
METHODS: The wild and mutant type DNA polb gene were amplified by polymerase chain reaction (PCR) and cloned into pEGFP-C3 vector to obtain wild and mutant pEGFP-C3-polb. Then pEGFP-C3-polb was transfected into EC9706 cells using lipofectamine method. The location of DNA polb gene-encoded protein was observed under fluorescent microscope. The growth of the cells was detected by MTT assay and the cycle of the cells was examined by flow cytometry.
RESULTS: The sequences of the two recombinants were confirmed and they were transfected into the EC9706 cells successfully. The wild DNA polb protein was mostly located inside the nuclear, but the mutant DNA Polb protein was distributed in the whole cell. The proliferation of EC9706-wtPolβ cells was significantly slower than that of control cells (P<0.05). Furthermore, the S-period frequency (SPF) was significantly decreased in EC9706-wtPolβ cells (22.11±0.12 vs 44.86±0.03, P<0.05), but not in EC9706-mtpolβ ones (P>0.05).
CONCLUSION: Over-expression of wild type DNA polymerase b can decrease the malignant degree of esophageal cancer.
- Citation: Zhao J, Lu J, Song Q, Cui ZY, Zhao GQ, Huang YT, Yang HY, Zhao JM, Dong ZM. Effect of over-expressed DNA polymerase b on malignant degree of esophageal cancer EC9706 cells. Shijie Huaren Xiaohua Zazhi 2005; 13(12): 1377-1381
- URL: https://www.wjgnet.com/1009-3079/full/v13/i12/1377.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i12.1377
哺乳动物细胞DNA每天都经历着数次自发突变, 并经受着化学、毒素、放射性物质、病毒等外来损伤因素的影响.由于其体内存在着损伤修复系统, 才得以使其处于动态平衡, 维持正常的代谢.DNA聚合酶b(DNA polb)是DNA聚合酶家族中的一员, 在DNA的损伤修复中起着非常重要的作用.他主要参与BER, 包括短片段BER和长片段BER[1].他有别于其他DNA聚合酶的一个特点是在合成时缺乏校读能力, 在体外DNA复制实验中他缺乏准确性, 识别核苷酸时缺乏区别能力, 在几种聚合酶中其保真性最低.已证实食管癌中DNA polb的表达是增高的[2].而且这种高表达的是杂合性的[3-5], 即高表达的DNA polb的食管癌细胞同时存在着突变型和未突变型的DNA polb.我们将食管癌野生型的DNA polb基因导入食管癌细胞系EC9706中使正常的DNA polb过表达, 结果发现此细胞株的生长速度减慢, 细胞周期中S期的细胞数明显减少.而突变型的导入EC9706细胞后则不能促进EC9706细胞的增殖, S期细胞增殖不明显.这一现象提示过表达的DNA polb对食管癌细胞EC9706的增殖有一定的影响.
重组真核绿色荧光蛋白表达载体pEGFP-C3(Clontech公司)为中国人民解放军总医院母义明博士惠赠, 野生型和天然突变型(177-234 nt, 58 bp缺失突变型)的重组真核表达载体pcDNA3.1-polb为我室构建, pGEM-TEasy载体试剂盒, HindⅢ和BamHI限制性内切酶, T4连接酶, 高保真Taq DNA聚合酶均购于Promega公司, 小提质粒试剂盒, 快速凝胶回收试剂盒均购于QIAGEN公司, 食管癌细胞系EC9706由本校病理教研室张云汉教授惠赠, RPMI1640培养基、转染用脂质体Lipofectamine、G418均购于GIBCO公司.MTT购于Sigama公司, 细胞周期试剂盒购于美国BD公司.胎牛血清、培养瓶、板为Coring公司产品.
根据GenBankM2423078[6-8]提供的DNA聚合酶b的cDNA序列和所选用的质粒pEGFP-C3设计一对带有HindⅢ和BamHI酶切位点的polb全基因引物P1, P2.一对用于鉴定重组pEGFP-C3-polb质粒的通用鉴定引物P3, P4.在DNA polb序列ATG上游还加有一段Kozak序列.引物由上海生工生物工程公司合成.P1, 5'GCAAGCTTGCCACCATGAGCAAACGGAAGGCGCCGCAGG3', P2, 5'CTGGATCCTTCGCTCCGGTCCTTGGGTTC3'; P3, 5'TCCTGCTGGAGTTCGTGACC3', P4 5'TTCAGGGGGAGGTGTGGGAG3'.在过夜培养的LB固体培养基上取含野生型、突变型pcDNA3.1-polb的菌苔少许, 置于含Milli-Q纯水50 mL的EP管中, 并重悬混匀, 100℃水浴10 min, 12 000 g离心5 min, 取上清作为模板进行PCR扩增, 条件如下(30 mL体系)H2O: 18.5 mL, 10×buffer 3 mL, 4×dNTP 2 mL, P1 0.5 mL, P2 0.5 mL, Taq酶 0.5 mL, 模板 5 mL.94℃预变性5 min, 94℃变性50 s, 55℃复性50 s, 72℃延伸60 s, 25循环, 72℃再延伸5 min.按快速凝胶回收试剂盒说明书回收纯化PCR产物琼脂糖凝胶电泳鉴定.进行T-A克隆, 反应体系(10 mL体系): 10×buffer 5 mL, PCR产物 3 mL, T4连接酶1 mL, pGEM-T载体1 mL, 4℃连接过夜.用氯化钙法制备感受态, 连接产物转化大肠杆菌E.coli JM109, 涂抹至预先含有IPTG/X-gal/氨苄青霉素的平板上, 进行蓝白筛选, 阳性菌落进行T7、SP6通用引物PCR扩增鉴定, 并小提质粒用HindⅢ和BamHI酶切鉴定, 得到重组质粒pGEM-T-polb.用QIAGEN miniprep kit小提Pegfp-C3空质粒, 用HindⅢ和BamHI双酶切, 酶切产物用QIAGEN gel extract kit回收纯化, 并进行Sephadex G200凝胶过滤层析再次纯化, 得到双粘质粒并测出其浓度.同时用HindⅢ和BamHI双酶切重组质粒pGEM-T-polb, QIAGEN gel extract kit回收酶切片段, 胶回收产物和双粘质粒16℃连接过夜, 转化DH5a大肠杆菌于卡那霉素阳性的LB平板上, 初筛阳性克隆.用通用引物P3, P4进行PCR扩增筛选, 阳性克隆分别再用通用引物P3, P4和P1, P2二次PCR扩增鉴定, 再用提质粒HindⅢ和BamHI双酶切鉴定.经上述方法鉴定后的重组质粒送DNA序列分析, 由上海生工生物工程公司测序.从含野生型和突变型的DNA聚合酶b的重组真核绿色荧光表达载体pEGFP-C3-polb的DH5a菌和含pEGFP-C3的DH5a菌中提质粒备用(按照QIAGEN质粒提取说明书).测其浓度为150 g/L.EC9706细胞用含100 mL/L胎牛血清(FBS)、100 mg/L链霉素、100 mg/L青霉素的RPMI 1640培养液在37℃、50 mL/L CO2饱和湿度条件下培养传代.按4×104/孔细胞数接种于24孔板, 当细胞汇合度达50-70%, 将1 mL野生型和突变型的重组质粒pEGFP-C3-polb和1 mL空质粒pEGFP-C3分别与无血清无双抗的RPMI 1640培养基200 mL混合, 1 mL脂质体Lipofeciamine与无血清无双抗的RPMI 1640培养基200 mL混合, 混匀, 然后将上述两种液体混合, 室温静置30 min, 用无血清无双抗的RPMI 1640培养基冲洗每孔细胞2次, 加质粒脂质体混合物400 mL于每孔细胞, 37℃、50 mL/L CO2饱和湿度条件下培养5 h, 吸去每孔混合物, 加100 mL/L FBS, 含双抗的RPMI 1640培养基1 mL, 37℃、50 mL/L CO2饱和湿度条件下继续培养.48 h后加G418 1 200 mg/L筛选, 每3 d换一次液, 共筛选3 wk, 最后1 wk将加至1 500 mg/L, 收集阳性克隆, G418 200 mg/L维持培养.用荧光显微镜动态观察转染野生型和突变型pEGFP-C3-polb重组质粒和转染pEGFP-C3的EC9706细胞.分别接种转染pEGFP-C3-polb重组质粒的对数生长期EC9706细胞和转染pEGFP-C3的对数生长期EC9706细胞于96孔板, 2×103/孔, 每种设5个复孔, 并设无细胞的一组为control, 共6块板, 每天取一块板, 加MTT20 mL/孔, 37℃、50 mL/L CO2饱和湿度条件下培养4 h, 弃去MTT混合液, 加DMSO 150 mL/孔, 震荡10 min, 紫外分光光度计492nm测A值, 绘制生长曲线.取对数生长期的未转染的EC9706细胞、转染野生型和突变型的pEGFP-C3-polb重组质粒EC9706细胞和转染pEGFP-C3的EC9706细胞各一瓶, PBS洗两遍, 胰酶消化, 终止消化后, 800 r/min离心3 min, PBS洗两次, 加500 mg/L多聚甲醛1 mL固定5 min, 800 r/min离心3 min, 重悬于PBS中, 计数, 置于细胞周期专用管, 800 r/min离心5 min, 加A液250 mL, 10 min, 加B液, 10 min, 加C液, 避光10 min后用流式细胞仪对DNA进行定量分析.资料用Madfit LT for Mac 3.0软件分析处理.S 期细胞百分比(S-period f requency, SPF): 表示DNA合成状态, 借助于DNA的合成情况来估计将进入有丝分裂的细胞的百分比.SPF值 = S÷(G0/G1+S+G2/M)×100%.DNA指数(DNA index, DI): 表示DNA的相对含量, 并判断DNA 倍体数.以正常人淋巴细胞DNA 含量为准.DI值 = (样品细胞的G0/G1峰均道数)÷(正常细胞的G0/G1峰均道数)×100%.本实验统计方法均采用SPSS10.0统计软件.生长曲线运用双因素方差分析, FCM参数比较采用多样本的单因素方差分析, 以a = 0.05为水准.
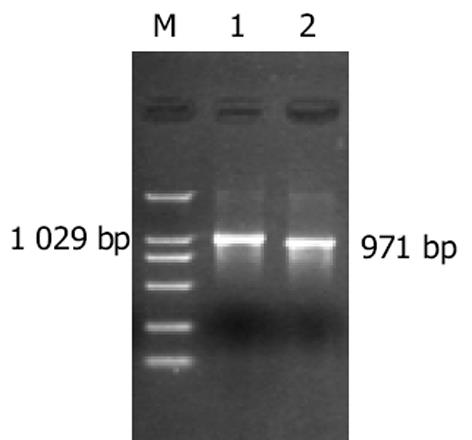
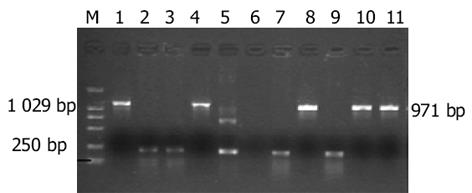
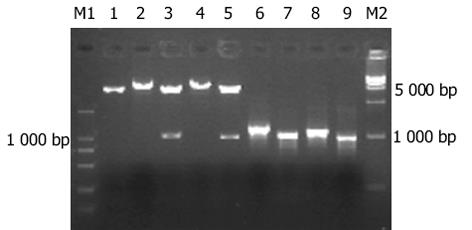
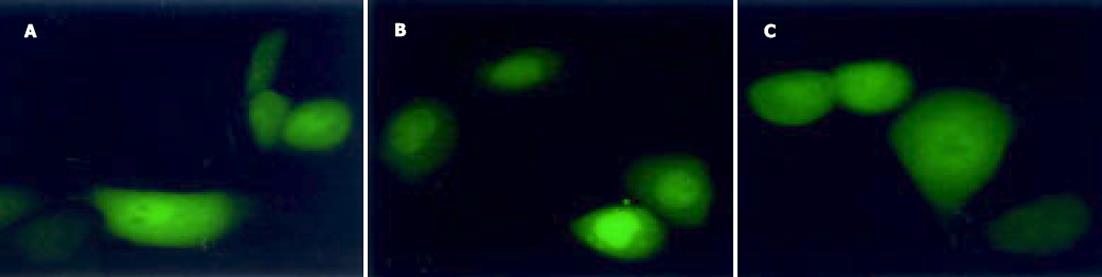
用P1, P2扩增野生型(wtDNA polb)和突变型pcDNA3.1-polb(mtDNA polb)产生的目的条带与预期的野生型1 029 bp, 缺失突变型971 bp一致(图1).从卡那LB平板上随机挑选10个菌落, 引物P3, P4 PCR扩增后显示特异性条带, 野生型位于1 029 bp附近, 缺失型位于971 bp附近, 未插入的条带位于210 bp附近(图2).上步筛选后的阳性重组子用P1, P2和P3, P4双引物二次鉴定, 可见: P1, P2扩出的条带较P3, P4扩出的分子略小.再小提质粒, HindⅢ和BamHI双酶切鉴定, 结果可见野生型: 1 017 bp, 4 732 bp两条带, 缺失型969 bp, 4 732 bp两条带(图3).LB液体培养基过夜培养重组的两种突变型质粒, 取1.5 mL测序, 结果野生型1 029 bp, 缺失突变型971 bp序列读码框序列正确.用野生型和突变型pEGFP-C3-polb和空质粒pEGFP-C3转染EC9706细胞, 获得野生型EC9706-wtpolβ, 突变型EC9706-mtpolβ和EC9706-neor细胞.在荧光显微镜下发现, 与未转染的EC9706细胞相比, pEGFP-C3-wtpolb, pEGFP-C3-mtpolb和pEGFP-C3编码的蛋白均有GFP表达, 即在488 nm波长下发出绿色荧光, 说明转染成功.所不同的是, EC9706-neor细胞激发出的绿色荧光在细胞核与胞质中无任何差别, 整个细胞呈均匀绿色(图4A), 而EC9706-wtpolβ细胞虽然整个细胞都可见绿色荧光, 但细胞核内的荧光强度明显较胞质中的强(图4B), 而的EC9706-mtpolβ细胞却与EC9706-wtpolβ完全不同, 他也是以整个胞质分布为主, 没有核定位的趋势(图4C).与未转染的EC9706细胞相比, 在前1 wk EC9706-neor细胞、EC9706-wtpolβ和EC9706-mtpolβ细胞体积均有增大, 细胞内颗粒状物质增多, 随着继续培养, 每种细胞均有少数大体积细胞, 但转染的两种细胞无明显差别, 而未转染的EC9706细胞无此变化.
与未转染的EC9706细胞相比, EC9706-neor细胞的生长速度变化不大(P>0.05), EC9706-wtpolβ细胞的生长速度较慢(P<0.05), EC9706-mtpolβ细胞则影响不明显(P>0.05, 图5).
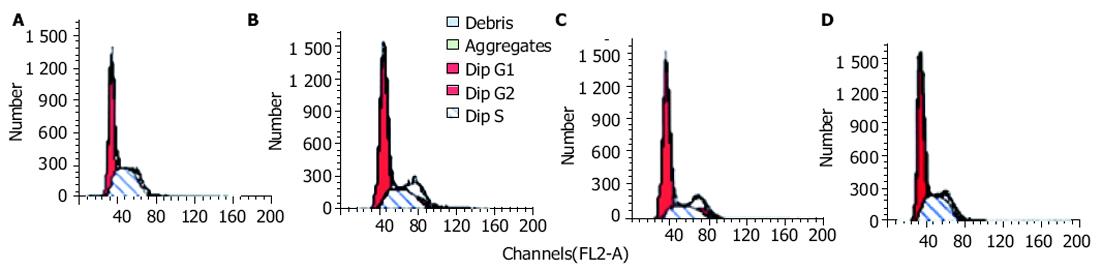
未转染的EC9706细胞、EC9706-neor细胞的细胞周期S峰相似, 而EC9706-wtpolβ细胞的S期细胞明显减少(P<0.05), EC9706-mtpolβ细胞的S期细胞与未转染细胞相比变化不大, 而与野生型的转染细胞相比则S期细胞明显增多(P<0.05, 图6).
各组DI值无明显差异(P>0.05), 均为近二倍体细胞; EC9706-wt细胞的SPF值明显却明显低于EC9706和EC9706-neor (P<0.05); 而EC9706-mt细胞的SPF值与EC9706和EC9706-neor的无明显差别(P>0.05, 表1).
| FCM | EC9706 | EC9706-neor | EC9706-wt | EC9706-mt |
| DI | 0.88±0.010 | 0.81±0.10 | 0.85±0.10 | 0.84±0.00 |
| SPF | 44.86±0.03 | 36.56±0.36 | 22.11±0.12 | 39.79±0.20 |
DNA聚合酶b是一种DNA修复基因, 我们证实在食管癌中, 高表达的DNA聚合酶b是野生型和突变型的杂合体, 突变型的DNApolb抑制野生型的正常功能[2,6].gfp是一种新型的生物标签[9-10], 与外源基因偶连时不影响外源蛋白的构象和功能, 他可以发绿色荧光.在pEGFP-C3表达载体的C端具有多克隆位点, 可以将DNA polb基因与之在阅读框架中融合, 融合蛋白在哺乳细胞中表达, 可直接通过荧光显微镜, 流式细胞仪进行检测.重组表达载体中含有一个SV40早期启动子, 他可促使载体中与DNA polb基因融合的绿色荧光蛋白基因gfp表达.同时载体中还含有CMV早期即刻启动子, 他可有效的促进插入的目的基因的表达[8].在引物设计时我们在目的基因序列的ATG上游加上了一段Kozak引导序列, 这样可使目的基因在真核细胞中的表达明显提高[11], 更利于观测.GFP含有一种修饰过的氨基酸(Leu-Tyr-Gly)所组成的载色中心, 当gfp基因表达, GFP的载色中心即自发形成, 用普通荧光显微镜以标准的波长紫外线就很容易观察到该基因的产物, 将gfp基因与另一种基因连接在一起构成融合基因, 另一种基因表达的蛋白质可由GFP产生的荧光来反映[10].EGFP的荧光强度比其天然产物高几十倍.EGFP本身不是核蛋白, 没有核定位信号, 他的浓聚不可能由其本身引起, 只能是由与之融合的定位细胞核内的DNA polb蛋白所引起[12].利用EGFP可诱发荧光而又没有核定位信号的特性, 我们将野生型和缺失突变型的DNA polb与EGFP的融合基因通过脂质体转染的方法导入了EC9706细胞系.我们标记了EGFP可以通过绿色荧光来观察外源基因的表达情况.结果发现除了EC9706细胞自身高表达的DNA polb之外, 外源的DNA聚合酶b蛋白还可以高表达并可以定位, wtDNA polb定位在细胞核内, pEGFP-C3蛋白和mtDNA polb蛋白却在整个细胞发出绿色荧光, 而且24 h表达最高并定位最明显.
众所周知, 蛋白质的结构决定功能, 正常的DNA polb是一种核蛋白, 他应该在核内表达发挥其生物功能.他编码39 ku的蛋白, 由335个氨基酸组成, 含有两个结构域[13-14]: 他的修复功能遵循BiBi机制首先与受损的DNA单链结合才能发挥其聚合功能.突变型的DNA聚合酶b由于其177-234位的核苷酸缺失, 导致59-78位的氨基酸缺失, 即其8 ku结构域丧失了完整性, 这种截短的蛋白表达异常, 导致其在EC9706细胞中表达于整个细胞表达, 与野生型的核内表达明显不同.我们推测其丧失了与损伤DNA结合的功能, 故不能完成其修复受损DNA功能, 也可能丧失了整个聚合酶的功能.我们继续进行转染细胞的生长曲线和细胞周期的测定, 发现EC9706-wtpolβ细胞的生长速度比未转染细胞和EC9706-mtpolβ细胞减慢(P<0.05), 但EC9706-mtpolβ细胞则与EC9706细胞和EC9706-neor细胞相比无显著差别(P>0.05).DNA倍体分析提示转染前后均为近二倍体各组间无明显差异(P>0.05).我们知道, 正常细胞的SPF是低增殖的, SPF值越高, 肿瘤的恶性度越高.恶性肿瘤有较高的增殖比率[14], EC9706-wtpolβ细胞SPF值明显降低(P<0.05), 但EC9706-mtpolβ细胞SPF值却变化不大(P>0.05).NANDAN[15]曾在结直肠、乳腺癌中发现208-236氨基酸缺失(87 bp), 其测定DNA polb活性结果显示: 野生型转染的Hela细胞的DNA polb活性是未转染细胞的10倍, 而87 bp缺失型转染后Hela细胞DNA polb活性则极低, 这与我们的结果极其相似.
因此, 用野生型的DNA聚合酶b去转染肿瘤细胞, 可以减缓细胞的增殖, 降低恶性度, 有望进一步深入研究运用于人类的肿瘤生物治疗.
编辑: 潘伯荣 审读: 张海宁
| 1. | Srivastava DK, Husain I, Arteaga CL, Wilson SH. DNA polymerase b expression differences in selected human tumors and cell lines. Carcinogenesis. 1999;20:1049-1054. [PubMed] [DOI] |
| 3. | Iwanaga A, Ouchida M, Miyazaki K, Hori K, Mukai T. Functional mutation of DNA polymerase beta found in human gastric cancer-inability of the base excision repair in vitro. Mutat Res. 1999;435:121-128. [PubMed] [DOI] |
| 4. | Matsuzaki J, Dobashi Y, Miyamoto H, Ikeda I, Fujinami K, Shuin T, Kubota Y. DNA polymerase beta gene mutations in human bladder cancer. Mol Carcinog. 1996;15:38-43. [PubMed] [DOI] |
| 5. | Dong Z, Zhao G, Zhao Q, Yang H, Xue L, Tan X, Zheng N. A study of DNA polymerase beta mutation in human esophageal cancer. Zhonghua Yixue Zazhi. 2002;82:899-902. [PubMed] |
| 6. | 萨母布鲁克, D. W. 拉塞尔. 分子克隆实验指南. 第三版. 北京: 科学出版社 2002; 889-942. |
| 7. | D.L.斯佩克特, R.D.戈德曼, L.A.莱因万德. 细胞实验指南. 第3版. 北京: 科学出版社 2001; 781-792. |
| 8. | Miller BA, Barber DL, Bell LL, Beattie BK, Zhang MY, Neel BG, Yoakim M, Rothblum LI, Cheung JY. Identification of the erythropoietin receptor domain required for calcium channel activation. J Biol Chem. 1999;274:20465-20472. [PubMed] [DOI] |
| 9. | Chalfie M, Tu Y, Euskirchen G, Ward WW, Prasher DC. Green fluorescent protein as a marker for gene expression. Science. 1994;263:802-805. [PubMed] [DOI] |
| 10. | 刘 默芳, 王 恩多. 绿色荧光蛋白. 生物化学与生物物理进展. 2000;27:238-243. |
| 11. | Kozak M. An analysis of 5-noncoding sequences from 699 vertebrate messenger RNAs. Nucleic Acids Research. 1987;15:8125-8148. [PubMed] [DOI] |
| 14. | Koss L G, Czerniak B, Herz F, Wersto RP. Flow cytometric measurements of DNA and other cell components in human tumors: a critical appraise. Hum Pathol. 1989;20:528-531. [DOI] |
| 15. | Bhattacharyya N, Banerjee S. A variant of DNA polymerase b acts as a dominant negative mutant. Proc Natl Acad Sci USA. 1997;9:10324-10329. [PubMed] [DOI] |