修回日期: 2005-04-27
接受日期: 2005-05-20
在线出版日期: 2005-06-15
目的: 检测细胞黏附分子CD44v6在肝癌细胞组织中的表达, 并初步探讨其与肝癌部分生物学行为的关系.
方法: 选择同济医院手术肝细胞癌患者标本32例,以门脉高压肝硬变患者8例及肝外伤患者5例标本作为对照.采用免疫组织化学染色法检测正常肝脏、肝硬化组织和肝癌组织中CD44v6的表达情况, 并分析其表达水平与肝癌部分生物学行为如肿瘤直径、有无包膜侵犯、肝癌病理分级(Edmonson分级)、是否伴有肝内外转移、合并肝硬化情况以及甲胎蛋白(AFP)的表达等指标间的关系.
结果: 正常肝脏组织及肝硬化组织中CD44v6几乎不表达或仅在少量淋巴细胞和间质细胞中呈弱阳性表达, 32例肝癌组织中有25例可见CD44v6的强阳性表达, 主要集中于细胞质和细胞膜上, 阳性率为78.3%.肝癌组织中CD44v6表达阳性率高于正常肝脏组织(78.2% vs 40.0%, P<0.05)及肝硬化组织(78.2% vs 62.3%, P<0.05).肝癌细胞组织中CD44v6的表达明显强于正常肝脏(113.3±13.3 vs 23.6±10.6个阳性细胞, P<0.05)及肝硬化组织(113.3±13.3 vs 42.4±12.3个阳性细胞, P<0.05).有包膜侵润、Edmonson IV以及转移者CD44v6表达比无包膜侵润、Edmonson II-III和无转移者显著增高(7 125.9±14.7 vs 95.2±15.2, P<0.05; 122.5±24.3 vs 99.4±15.3, P<0.05; 165.4±17.5 vs 95.3±12.4, P<0.01).CD44v6表达与肿瘤直径、AFP水平以及有无肝硬化无显著相关性(P>0.05).
结论: CD44v6的表达有可能作为肝癌恶性程度和转移的指标之一, 有必要进一步研究细胞黏附分子CD44v6在肝癌生物学行为中的作用及机制.
引文著录: 殷茜, 陈孝平. 细胞黏附分子CD44v6在肝癌组织中的表达及意义. 世界华人消化杂志 2005; 13(11): 1295-1298
Revised: April 27, 2005
Accepted: May 20, 2005
Published online: June 15, 2005
AIM: To investigate the expression of cell adhesion molecule CD44v6 in hepatocellular carcinoma (HCC) and it's effect on the biological behavior of HCC.
METHODS: The expression of CD44v6 was detected in liver tissue specimens of patients with hepatic cell carcinoma (n = 32), portal hypertension (n = 8)and hepatic trauma (n = 5) by immunohistochemical staining. The level of CD44v6 expression and its relationship with some biological behaviors (capsule invasion, intrahepatic or extrahepatic metastasis and accompanied cirrhosis) and indexes [Edmonson grading and alpha fetoprotein (AFP) level] were analyzed.
RESULTS: CD44v6 expression was found negative or weak positive in some lymphocytes and interstitial cells in trauma and cirrhosis groups, while strong positive CD44v6 expression was observed in 25 cases of HCC group and CD44v6 was mainly located in cell plasma and membrane. The positive rate in HCC group was significantly higher than that in trauma and cirrhosis group (78.2% vs 40.0%, 62.3%; P<0.05). The level of CD44v6 expression in HCC group was significantly higher than that in trauma and cirrhosis group (113.3 13.3 vs 23.6 10.6, 42.4 12.3 positive cells, P<0.05). CD44v6 expression was markedly higher in capsule invasion, Edmonson grading IV, and metastasis group than that in non-capsule invasion, Edmonson grading II-III and non-metastasis group (125.9 14.7 vs 95.2 15.2, P<0.05; 122.5 24.3 vs 99.4 15.3, P<0.05; 165.4 17.5 vs 95.3 12.4, P<0.01). CD44v6 expression was not significantly related to tumor size, AFP level and hepatic cirrhosis (P>0.05).
CONCLUSION: CD44v6 can be one possible indicator to evaluate the malignancy and metastasis of hepatocellular carcinoma. Further study should be performed on the role of CD44v6 in biological behaviors and mechanisms of HCC.
- Citation: Yin Q, Chen XP. Expression of cell adhesion molecule CD44v6 in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2005; 13(11): 1295-1298
- URL: https://www.wjgnet.com/1009-3079/full/v13/i11/1295.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i11.1295
细胞黏附分子CD44V6是一种分布广泛的细胞表面跨膜糖蛋白, 其正常功能是作为受体识别透明质酸(HA)和胶原蛋白I、IV, 主要参与免疫识别、淋巴细胞聚集以及细胞-细胞、细胞-基质之间的特异性黏附过程.可分为标准型(CD44s)和CD44拼接变异体(CD44v).目前认为CD44与肿瘤的进展程度、浸润、转移密切相关, 其中以CD44v6的意义最为显著.肝细胞癌为肝脏最常见的恶性肿瘤, 其浸润和转移的机制尚不十分清楚, 一般认为是一个多步骤、受多因子影响的复杂过程, 其中细胞表面黏附分子及其相关的信号传导在肿瘤生长分化和浸润转移的过程中起到重要作用.我们通过免疫组织化学染色法检测正常肝脏、肝硬化组织和肝癌组织中CD44v6的表达情况, 并初步探讨了其与肝癌部分生物学行为的关系, 为进一步研究肝细胞癌浸润及转移的机制和治疗肝癌转移和复发的方法提供新的线索.
所有病例均来自同济医院2004-01/08住院患者.肝癌患者32例, 其中男性29例, 女性3例, 平均年龄44±5.5岁.均经手术后病理切片证实为肝细胞癌, 病理分级(Edmonson分级): II-III级19例, IV级13例.肿瘤直径<5 cm者7例, >5 cm者25例, 平均直径11.2±5.6 cm, 均为单中心肝癌.肿瘤包膜完整者13例, 有包膜侵犯者19例, 伴有转移者(包括肝外转移、肝内转移及门静脉癌栓)14例.24例合并肝硬化, 术前检查甲胎蛋白(AFP)阴性者9例, 阳性者23例.另选取8例门脉高压肝硬变及5例肝外伤病例作为对照.其中男性8例, 女性5例, 平均年龄45±6.2岁.
1.2.1 标本采集及病理切片: 标本石蜡包埋, 常规行石蜡切片并进行HE染色, 切片厚度4 m.由病理医师阅片, 并行Edmonson病理分级.
1.2.2 免疫组化法检测CD44v6的表达: 免疫组化试剂盒由中山公司提供, 检测步骤如下:(1)切片脱蜡到水;(2)蒸馏水新鲜配置30 mL/L H2O2, 室温7 min以灭活内源性酶, 蒸馏水洗2 min×3次;(3)滴加复合消化液(试剂盒中提供)1滴, 室温15 min, 蒸馏水洗2 min×3次;(4)滴加正常血清封闭液, 室温20 min, 甩去多余液体, 不洗;(5)滴加一抗(兔抗CD44v6, 浓缩液1∶100稀释), 37℃ 120 min, 0.01 mol/L PBS洗2 min×3次;(6)滴加生物素化山羊抗兔IgG, 37℃ 20 min.0.01 mol/L PBS洗2 min×3次;(7)滴加试剂SABC, 37℃ 20 min, 0.01 mol/L PBS洗5 min×4次;(8)DAB显色:滴加DAB显色液(实验室提供)1滴/片, 镜下控制反应时间, 蒸馏水洗2 min×7次;(9)苏木素轻度复染, 脱水, 透明, 封片.
1.2.3 判断标准: 观察CD44V6表达以细胞质及细胞膜呈棕黄色者为阳性细胞, 首先在低倍视野下取阳性细胞较集中的5个区域, 再于200倍视野下计数阳性细胞并取其平均值.
统计学处理 所有数据以均数±标准差(mean±SD)表示, 采用SAS 统计分析软件进行t检验, P<0.05表示有统计学意义.
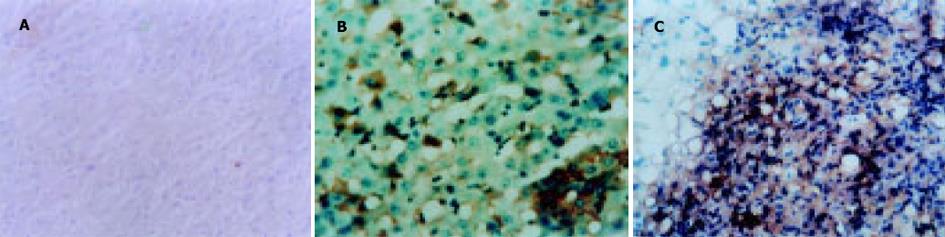
正常肝脏组织及肝硬化组织中CD44v6几乎不表达或仅在少量淋巴细胞及间质细胞中呈弱阳性表达(图1A-B), 32例肝癌组织中有25例可见CD44v6的棕褐色强阳性表达, 阳性率为78.2%, 在肝癌组织中可见较多阳性细胞, CD44v6表达主要集中于细胞质和细胞膜上, 在肝癌组织和正常肝脏交界处以及肝内微血管密集处尤为明显, 在肝癌细胞和癌旁组织中也有少量表达(图1C).其中病理分级IV级者13例中有11例呈阳性表达, 阳性率为84.6%, 高于HCC组平均值.伴有肝内外转移者14例中有12例呈阳性表达, 阳性率为85.7%, 亦高于HCC组平均值.
目前关于CD44v6与肿瘤转移, 预后关系的意见尚不一致.Wielenga et al[1]在对结肠癌患者进行临床观察时, 发现CD44v6过度表达的患者出现转移的机会更大, 并且预后明显差于CD44v6低水平表达者, 认为CD44v6可作为反映结肠癌转移、预后的标志.Gunthert et al在[2]动物模型中将CD44变异体cDNA转染到非转移性的大鼠胰腺癌细胞株后, 观察到转移的出现.Yokoyama et al[3]对肝外胆管癌手术标本进行检测, 发现CD44v6的阴性表达更多出现于进展期肿瘤中, 且较CD44v6阳性者淋巴结转移更多见, 认为CD44v6的表达缺乏代表着肿瘤的高转移能力和低生存率.这说明在不同类型的肿瘤中, CD44v6的表达及生物学意义存在很大的差异.
我们发现, HCC组织中CD44v6的表达水平较正常肝脏组织及肝硬化组织高, 具有显著性差异.CD44v6高表达更多出现在有侵袭转移能力的癌组织中.近一步分析HCC的病理指标, 发现在低分化、有转移的癌组织中, CD44v6的表达水平明显高于中度分化、无转移者, 并且CD44v6的表达水平在不同肿瘤直径、不同的AFP水平、有无肝硬化组间无明显差异.说明CD44v6高表达反映了肿瘤的高侵袭转移能力.Endo et al[4]的研究也证实了这一结果.同时Endo et al对肝癌组织中p53与CD44蛋白的研究中, 观察到CD44v6的高表达与p53的过度表达显著相关, 认为CD44v6可能与肿瘤的生长有关.Washington et al[5]认为CD44在肝癌中的表达与肝癌病理分级无关, 我们认为原因可能有两个:(1) CD44s及各种CD44v在肿瘤中的表达及生物学意义有很大的差异, 实验中如不区分CD44s和多种CD44v将造成统计结果的差异;(2)样本数量不够以及低分化肝癌病例数的不同使显著性检验结果不同.另外, Mathew et al[7]现CD44v6的表达与肝癌的血管浸润性有一定的关系, 这方面的研究尚有待深入.关于CD44V6影响肿瘤浸润, 转移的具体机制尚不清楚.有研究认为CD44V6变异体可能通过促进癌细胞与血管内皮细胞和细胞外机制的黏附, 促进肿瘤向基质侵犯, 从而影响肿瘤细胞的迁徙和运动能力, 并可能通过影响肿瘤细胞骨架构象和分布, 从而以该细胞的运动能力, 影响肿瘤转移[6].我们观察到CD44v6在肝癌组织中的表达水平高于正常肝组织和肝硬化组织, 并与包膜侵犯、肝癌病理分级及转移有关.我们认为CD44v6的表达水平可反映肝细胞癌侵袭, 转移能力, 有望成为判断预后的指标, 从而为临床评价病情及制订治疗方案提供依据.通过抑制CD44v6的表达来降低HCC浸润转移能力的策略, 为防治肝癌的转移和复发提供了新的思路.目前已有体外实验, 通过使用反义寡核苷酸, 特异性抗体等方法抑制CD44v6等在肿瘤中的表达, 并观察到肿瘤细胞侵袭能力的降低[5], 这种策略有望为肝癌治疗提供新的方向.
编辑: 张海宁
| 1. | Wielenga VJ, van der Voort R, Mulder JW, Kruyt PM, Weidema WF, Oosting J, Seldenrijk CA, van Krimpen C, Offerhaus GJ, Pals ST. CD44 splice variants as prognostic markers in colorectal cancer. Scand J Gastroenterol. 1998;33:82-87. [PubMed] [DOI] |
| 2. | Gunthert U, Hofmann M, Rudy W, Reber S, Zoller M, Haussmann I, Matzku S, Wenzel A, Ponta H, Herrlich P. A new variant of glycoprotein CD44 confers metastatic potential to rat carcinoma cells. Cell. 1991;65:13-24. [PubMed] [DOI] |
| 3. | Yokoyama Y, Hiyama E, Murakami Y, Matsuura Y, Yokoyama T. Lack of CD44 variant 6 expression in advanced extrahepatic bile duct/ampullary carcinoma. Cancer. 1999;86:1691-1699. [PubMed] [DOI] |
| 4. | Endo K, Terada T. Protein expression of CD44(standard and variant isoforms) in hepatocellular carcinoma: relationships with tumor grade clinicopathologic parameters, p53 expression, and patient survival. J Hepatol. 2000;32:78-84. [PubMed] [DOI] |
| 5. | Washington K, Telen MJ, Gottfried MR. Expression of cell adhesion molecule CD44 in primary tumors of the liver: an immunohistochemical study. Liver. 1997;17:17-23. [PubMed] [DOI] |