修回日期: 2005-03-15
接受日期: 2005-03-22
在线出版日期: 2005-05-15
目的: 探索大鼠骨髓间质干细胞(MSC), 在同种异体移植后受体大鼠肝脏的定居分布情况.
方法: 以绿色荧光蛋白标记从大鼠骨髓中分离培养的MSC, 分别从大鼠尾静脉和门静脉注入同种异体正常和肝脏损伤大鼠体内, 于移植后的第7 d, 分别完整取肝, 通过荧光检测和常规病理、免疫组织化学检查, 研究MSC在大鼠肝脏内定居分布情况.
结果: 经不同途径移植MSC, 在受体大鼠肝脏内均有定居.在肝脏受损的大鼠肝内, 其已成功地分化为成熟的肝细胞和卵圆细胞, 并能长期存活, 在肝脏未受损的大鼠, MSC仅少量分化为卵圆细胞, 所移植的MSC定居于肝脏和是否分化为成熟肝细胞、卵圆细胞与其移植途径无明显关系, 与肝脏是否受损伤相关.
结论: 植入MSC是肝脏卵圆细胞的细胞来源, 并且可以分化为成熟的肝细胞.干细胞定居于肝脏数量与肝脏是否受损伤关系密切, 与移植途径无关.
引文著录: 张刚庆, 方驰华, 颜政. 同种异体MSC移植在大鼠肝内定居的病理检测. 世界华人消化杂志 2005; 13(10): 1198-1201
Revised: March 15, 2005
Accepted: March 22, 2005
Published online: May 15, 2005
AIM: To study the distribution and amount of the mesenchymal stem cells (MSCs) homing to the liver during allografting in rats.
METHODS: MSCs were isolated from the marrow of the rats using green fluorescent protein and cultivated in vitro. MSCs transduced with GFP retroviral vector were subsequently infused into the tail or portal veins of different rats with homogeneity, some of whichhad been treated with carbon tetrachloride to induce centrolobular liver necrosis while some of which were healthy. At the 7th day after transplantation, the whole livers were collected. The homing status and distribution of MSCs were studied by fluorescence detection, routine pathological examination and immunohistochemstry.
RESULTS: The transplanted cells could be found in all the livers of rats. Furthermore, MSCs resided in the damaged liver of the rats and differentiated into oval cells and mature hepatocytes. Only a few MSCs differentiated into oval cells in the healthy livers. The homing status and differentiation of MSCs were closely related to whether the liver was damaged, but not to the approach of transplantation.
CONCLUSION: The allografted MSCs can successfully reside in the damaged liver of rats and differentiate to mature hepatocytes. The homing status has no relation with the approach of transplantation.
- Citation: Zhang GQ, Fang CH, Yan Z. Pathological examination of mesenchymal stem cells homing to liver during allografting in rats. Shijie Huaren Xiaohua Zazhi 2005; 13(10): 1198-1201
- URL: https://www.wjgnet.com/1009-3079/full/v13/i10/1198.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i10.1198
骨髓间充质干细胞具有极强的自我复制能力和多向分化潜能[1-3], 来源广泛, 易于获取, 并且, MSC具有低免疫原性[4-7], 应用方便.对于MSC以不同途径移植后, 在受体肝脏内的分布情况目前研究报道不多.作者在体外分离、纯化大鼠MSC, 并用绿色荧光蛋白(GFP)进行标记, 通过不同途径进行同种异体移植, 观察在不同情况下, MSC在肝脏内的定居情况, 为MSC移植治疗肝脏损伤性疾病的临床应用提供理论及实验依据.
纯系SD成年雄性大鼠(质量180-230 g)由第一军医大学实验动物中心提供.Percoll分离液(Pharmacia公司);DMEM(Dubecco's modifided Eagle's medium DMEM)培养基及胎牛血清为Invitrogen公司产品;四氯化碳(分析纯)广州化学试剂厂产品, 地塞米松、胰岛素和青、链霉素均为Sigma公司产品.抗大鼠CD29, CD44, CD34, CD45, CD90, SH-2, SH-3和FIFC二抗为Pharmingen 公司产品.GFP mAb(Clontech公司)、二抗为山羊抗小鼠抗体(GeneTech公司), c-kit多克隆抗体、即用型免疫组化试剂盒(SABC法)购于武汉博士德公司.
成年SD大鼠, 随机分为2组:A组:移植前3 d, 每天按2% CCl4 2.5 mL/kg体重灌胃饲养, 首次剂量为5 mL/kg[8].B组:移植前正常饲养.无菌条件下获取正常SD大鼠骨髓, 采用Percoll剃度离心法, 获取细胞, 含100 mL/L小牛血清的DMEM培养液, 50 mL/L CO2, 37℃条件下培养.每日更换培养液.在培养7 d, 用流式细胞仪检测细胞的表面标志:CD29、CD44、CD34、CD45、CD90 SH-2, SH-3鉴定细胞类型[9].将冻存的用逆转录GFP包装的PT67细胞复苏, 用G418筛选后, DMEM加100 mL/L胎牛血清培养, 待细胞达到95-100%融合且时间为40 h左右, 收集GFP上清, 检测其滴度为1.7×108nfu/L, 分装保存[10].将已鉴定的MSC传代接种48 h后, 去除原培养液, 以无血清DMEM培养液洗涤1次, 加入GFP病毒上清并加入8 mg/L polybrene, 感染24 h后换正常培养基[10-11].不使用 G418进行筛选, 继续按原培养条件进行培养, 适时更换培养液并传代.设未加入GFP病毒上清的MSC细胞作对照组.
1.2.1 同种异体大鼠MSC移植: 收集GFP标记和未标记的MSC, 用不含钙、镁的磷酸盐缓冲液漂洗细胞3次, 用同样的磷酸盐缓冲液调整细胞浓度为2×109/L备用.实验大鼠用ip水合氯醛麻醉.然后按实验分组, 从各组随即取6只大鼠, 其中3只由门静脉、3只由尾静脉移植绿色荧光蛋白标记的MSC;另各取6只, 其中3只由门静脉、3只由尾静脉移植未经绿色荧光蛋白标记的MSC;各组再分别取2只大鼠, 分别从门静脉和尾经脉注入细胞培养液作为阴性对照.移植细胞量为5 mL/kg.术后均常规饲养.
1.2.2 组织学和免疫组织化学检查: 于MSC移植后第7 d, 将全部大鼠, 腹腔内注射水合氯醛麻醉, 行门静脉插管, 离断下腔静脉, 用不含钙、镁的磷酸盐缓冲液冲净肝脏内血液, 完整取肝.将获取的大鼠肝脏一部分行冰冻切片, 切片直接于荧光显微镜下观察GFP的表达.另一部分组织用40 g/L多聚甲醛固定, 进行石蜡切片, 其中一部分行HE染色, 观察大鼠肝脏组织学形态.另一部分切片二甲苯常规脱蜡后, 采用ABC 法行肝脏组织GFP, c-kit免疫组化染色.按常规设立阳性和阴性对照.
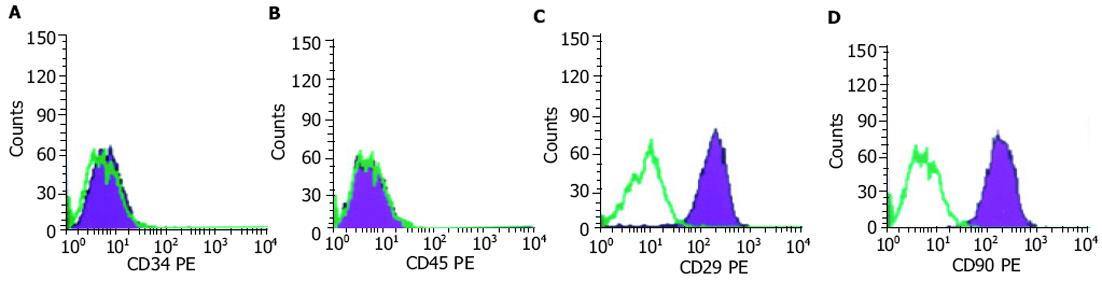
采用Percoll梯度分离液分离的成体大鼠的骨髓, 所获得的细胞通过及时反复传代、扩增, 显示形态呈基本一致的梭性或多边形, 成群生长, 排列整齐(图1);经流式细胞仪检测培养细胞的表面标志, CD34、CD45阴性, CD29、CD44、CD90 SH-2, SH-3阳性(图2A-D), 表明是骨髓中区别于造血干细胞的另一群处于未分化状态的非定向干细胞MSC.GFP转染MSC 24 h后, 即可见发绿色荧光的细胞;48-72 h发绿色荧光细胞明显增多, 强度增强, 转染效率达20-30%, 多为明亮的绿色荧光的细胞(图3).对照组未发现发绿色荧光的细胞.所有大鼠从不同途径移植标记或未标记的同种异体MSC后1 d精神、食欲差, 少活动;移植后2 d基本恢复正常饮食, 精神可, 各组大鼠之间无明显差异.所有大鼠全部存活到实验设计时间, 无意外死亡.
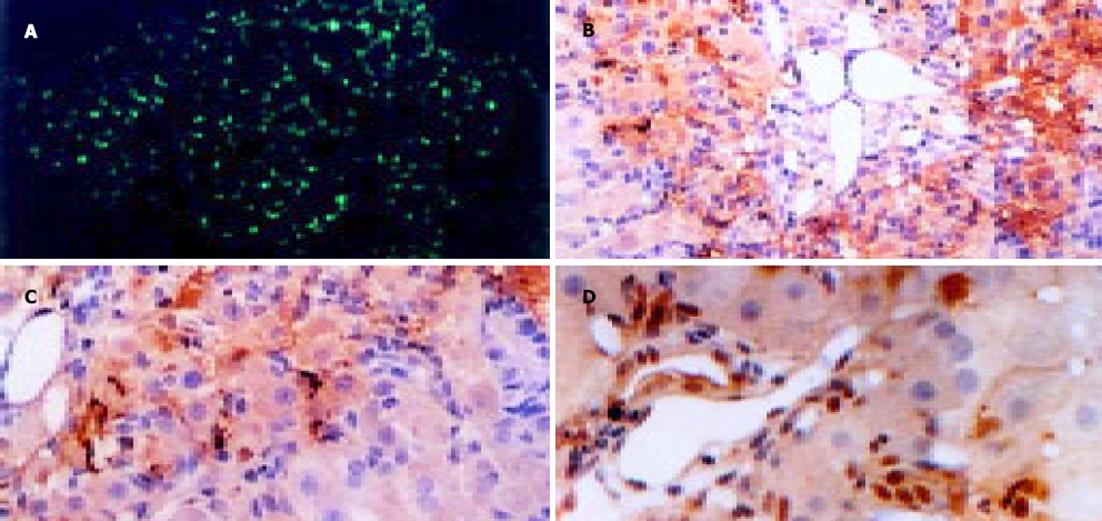
所有移植了GFP标记的MSC的大鼠肝内, 均可见到绿色荧光分布于肝脏内, 特别是小叶中央静脉和门静脉四周(图4A).A组大鼠的肝内表达绿色荧光的细胞较B组多;同组大鼠从门静脉移植与从尾静脉移植, 在肝内出现绿色荧光的细胞量相差不大.所有移植未用GFP标记的MSC的大鼠和阴性对照组大鼠肝内, 均未见到绿色荧光分布于肝脏内.
常规石蜡切片HE染色观察, 所有移植了MSC的大鼠, 肝小叶中央静脉和门静脉四周可见小的卵圆型细胞, A组大鼠肝脏汇管区的卵圆型细胞数量较多, 肝小叶中间也有零星的小卵圆型细胞, B组大鼠仅在肝小叶中央静脉和门静脉四周见小量的卵圆型细胞.A, B各组内大鼠肝脏内卵圆细胞的多少与细胞移植途径无明显关系.
GFP免疫组化染色, 所有移植了GFP标记的MSC的大鼠肝脏内, 可见GFP免疫组化染色阳性细胞, 主要在胞质内表达, 分布于肝脏小叶中央静脉和门静脉四周, 以及肝小叶中间(图4B);A组大鼠的肝内阳性细胞数较多, B组大鼠的肝内阳性细胞数较少, 仅分布于肝脏小叶中央静脉和门静脉周围;同组间大鼠从门静脉移植或从尾静脉移植, 在肝内出现的阳性细胞数相差不大.所有移植未经GFP标记的MSC的大鼠肝内, GFP免疫组化染色阴性.c-kit免疫组化染色, 所有移植了MSC的大鼠肝脏内, 均可见c-kit染色阳性细胞, 分布于肝脏小叶中央静脉和门静脉四周, 肝小叶中间也有零星分布(图4C), 阳性细胞数量多少各组不同, A组大鼠的肝内阳性细胞数较多;B组仅少量阳性细胞分布于肝脏小叶中央静脉和门静脉周围.阴性对照组大鼠肝内, GFP免疫组化染色阴性, 四氯化碳饲养的大鼠, 可见少许c-kit免疫组化染色阳性细胞分布于肝脏小叶中央静脉和门静脉四周(图4D).
骨髓间充质干细胞具有极强的自我复制能力和多向分化潜能[2,12], 具有独特的细胞增殖分裂模式, 使外源基因易于导入和表达;骨髓MSC来源广泛, 易于获取, 并且, MSC具有低免疫原性, 可以在受体不需要接受致死剂量射线照射、预先服用免疫抑制药物等的条件下, 进行同种异体移植[4-6,12], 应用方便. Bos et al[7]及Saito[14]认为同种异体MSC移植的低免疫原性, 与MSC的纯度密切有关, 纯化的MSC具有独特的免疫原性, 进行同种异体移植不需要预先应用免疫抑制剂, 无免疫排斥反应, 是良好的基因治疗靶细胞, 是细胞治疗的基础.因此MSC的获取和纯化, 对移植的成功和防止免疫排斥等的出现十分重要.我们通过梯度离心分离的方法, 并通过培养过程中的换液、传代, 获取形态一致, 纯度达90%以上的MSC, 使用GFP标记后移植到同种大鼠, 移植前未用免疫抑制药物等处理, 所有移植动物均未因免疫排斥等而在实验控制期内死亡, 显示梯度离心法从骨髓分离MSC可达到进行同种异体移植的要求, 是一种简单易行的分离方法.
细胞标记一直是困扰组织工程技术修复机制研究的一大难题, 其在干细胞来源的种子细胞的损伤修复研究中尤为重要.因此, 寻找一种长期稳定直观而又不影响细胞组织形成能力的标记方法, 是解决这些问题的有效途径.只有清楚地将植入的细胞与原有的自身细胞区分开来, 才能进一步研究植入细胞的真正作用[13-14].GFP是从水母体内分离获得的一种发光蛋白, 在荧光显微镜下, 吸收400 nm左右的蓝光, 激发出508 nm的绿色荧光, 且不需光发射辅因子.GFP对细胞无毒害, 在整个细胞都可观察到绿色荧光, 细胞标记的强度野也是以上所有细胞标记技术最强的.由于GFP在哺乳动物细胞稳定、荧光显微镜又容易检测, 因此GFP已是常用的标记分子.本研究采用GFP标记MSC, 通过荧光显微镜和免疫组化检测发现:无论是从门静脉还是从尾经脉移植, 移植的标记的MSC均可在肝脏中被检测到, 而移植未标记的MSC则未检测到, 说明GFP标记对细胞无害, GFP标记方法简单易行, 检测方便、准确, 是组织工程种子细胞标记提供了一种快速、简便、灵敏、可靠而直观的方法.
对于肝脏损伤的细胞治疗, 近年来的研究主要集中在诱导干细胞向成熟肝细胞的分化, 特别是诱导MSC向成熟肝细胞的分化[12], 但是MSC在体内的向肝细胞分化的能力和定居、定位情况尚不十分明确, 使植入MSC在肝脏损伤修复中到底发挥了多大作用难以正确评价.研究中我们将含有转基因标记的MSC通过不同途径移植入同种异体大鼠, 检测其在肝脏中定居情况和分布、分化情况, 发现在肝脏受损的大鼠肝内, 其已成功地分化为成熟的肝细胞和位于肝静脉、门静脉周围的卵圆细胞, 并能长期存活, 直接证明植入的MSC是肝脏卵圆细胞的细胞来源, 并且可以分化为成熟的肝细胞.但在正常的肝脏未受损的大鼠, MSC仅少量分化为卵圆细胞, 未见分化为成熟的肝细胞, 长期的分化结果尚不明确.通过本实验研究 还发现, 所移植的MSC定居于肝脏和是否分化为正常肝细胞和卵圆细胞与其移植途径无明显关系, 与肝脏是否受损伤相关, 优先定植于受损伤的靶器官, 与移植方式途径和移植后的时间无明显关系, 可能靶器官受损可导致机体产生某些使干细胞趋化、定植的因之, 具体机理有待进一步研究.
编辑: 潘伯荣 审读:张海宁
| 1. | Devine SM, Bartholomew AM, Mahmud N, Nelson M, Patil S, Hardy W, Sturgeon C, Hewett T, Chung T, Stock W. Mesenchymal stem cells are capable of homing to the bone marrow of non-human primates following systemic infusion. Exp Hematol. 2001;29:244-255. [PubMed] [DOI] |
| 3. | Minguell JJ, Erices A, Conget P. Mesenchymal stem cells. Exp Biol Med (Maywood). 2001;226:507-520. [PubMed] |
| 4. | Onuki R, Nagasaki A, Kawasaki H, Baba T, Uyeda TQ, Taira K. Confirmation by FRET in individual living cells of the absence of significant amyloid beta-mediated caspase 8 activation. Proc Natl Acad Sci USA. 2002;99:14716-14721. [PubMed] [DOI] |
| 5. | Kashiwakura Y, Katoh Y, Tamayose K, Konishi H, Takaya N, Yuhara S, Yamada M, Sugimoto K, Daida H. Isolation of bone marrow stromal cell-derived smooth muscle cells by a human SM22alpha promoter: in vitro differentiation of putative smooth muscle progenitor cells of bone marrow. Circulation. 2003;107:2078-2081. [PubMed] [DOI] |
| 6. | Devine SM, Cobbs C, Jennings M, Bartholomew A, Hoffman R. Mesenchymal stem cells distribute to a wide range of tissues following systemic infusion into nonhuman primates. Blood. 2003;101:2999-3001. [PubMed] [DOI] |
| 7. | Bos C, Delmas Y, Desmouliere A, Solanilla A, Hauger O, Grosset C, Dubus I, Ivanovic Z, Rosenbaum J, Charbord P. In vivo MR imaging of intravascularly injected magnetically labeled mesenchymal stem cells in rat kidney and liver. Radiology. 2004;233:781-789. [PubMed] [DOI] |
| 10. | Devine SM, Bartholomew AM, Mahmud N, Nelson M, Patil S, Hardy W, Sturgeon C, Hewett T, Chung T, Stock W. Mesenchymal stem cells are capable of homing to the bone marrow of non-human primates following systemic infusion. Exp Hematol. 2001;29:244-255. [DOI] |
| 11. | 郭 志兵, 黄 洪莲, 刁 志宏, 王 小宁. 逆转录病毒载体介导的GFP 基因在四种细胞株中的表达. 细胞与分子免疫学杂志. 2002;18:349-350. |
| 14. | Saito T, Kuang JQ, Bittira B, Al-Khaldi A, Chiu RC. Xenotransplant cardiac chimera: immune tolerance of adultstem cells. Ann Thorac Surg. 2002;74:19-24. [PubMed] [DOI] |