修回日期: 2004-11-25
接受日期: 2004-11-30
在线出版日期: 2005-01-01
目的: 探讨bcl-2及bax基因在我国食管鳞癌中的表达特点, 研究其在食管癌变中的可能作用.
方法: 应用原位杂交技术、流式细胞术及免疫组化方法对81例食管鳞癌中bcl-2及bax基因的表达进行检测, 并应用图像分析技术对原位杂交及免疫组化结果进行定量分析.
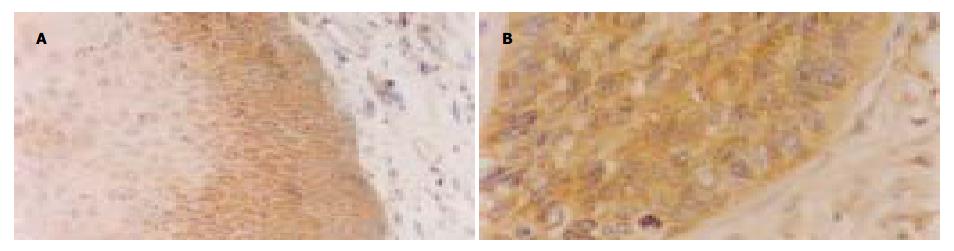
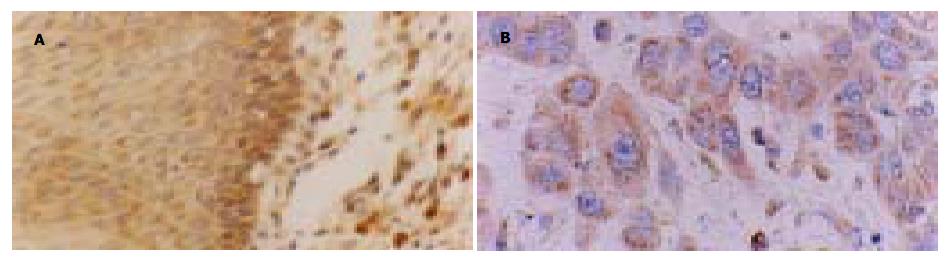
结果: bcl-2 mRNA在正常食管上皮无表达, 在癌旁上皮主要是上皮近基底部细胞中呈阳性表达.食管鳞癌细胞胞质可见明显的bcl-2 mRNA表达. 图像定量分析显示bcl-2 mRNA表达与分化程度有显著相关性(灰度值37.88±11.40 vs 23.03±8.71, 19.90±4.33, 6.60±3.36, P<0.05; 44.89±15.26 vs 23.03±8.71, 19.90±4.33, 6.60±3.36, P<0.05). Bcl-2蛋白在食管鳞癌中表达随癌组织的分化程度降低其表达显著增高并且在不同分化组间差异显著(F = 8.738, P<0.01). Bax蛋白在食管鳞癌细胞中都有表达, 但各组间均无显著性差异.
结论: 在食管鳞癌中凋亡相关基因bcl-2, bax表达异常增高, 尤其是抗凋亡基因bcl-2可能在食管鳞癌癌变及浸润过程中起着重要作用.
引文著录: 张林西, 齐凤英, 左连富, 刘江惠, 郭建文, 石卫东, 金春亭, 李海军. 凋亡相关基因bcl-2与bax在人食管鳞癌中的表达. 世界华人消化杂志 2005; 13(1): 112-115
Revised: November 25, 2004
Accepted: November 30, 2004
Published online: January 1, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(1): 112-115
- URL: https://www.wjgnet.com/1009-3079/full/v13/i1/112.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i1.112
食管癌是世界上最常见的十大恶性肿瘤之一, 在世界范围内居肿瘤死亡原因的第五位[1]. 在我国其死亡率居所有恶性肿瘤的第二位, 严重威胁着我国高发区人民的生命和健康.食管癌的发生可能是多种因素综合作用的结果[2]. 细胞凋亡与肿瘤的发生、发展关系密切. 在肿瘤的细胞凋亡调控系统中, bcl-2基因家族的作用备受重视. 我们应用原位杂交(in situ hybridization, ISH)技术、免疫组化及流式细胞术(flow cytometry, FCM)等方法, 对细胞凋亡相关基因bcl-2和bax在我国食管鳞癌中(squamous cell carcinoma, SCC)中的表达进行检测, 研究其在食管癌变中的可能作用.
1.1.1 病例: 河北医科大学第四医院2001-08/11食管癌患者手术切除标本共计81例. 男50例, 女31例. 年龄30-71岁, 平均年龄55.9岁. 其中高分化鳞癌39例, 中分化鳞癌18例, 低分化鳞癌24例. 同时取切端正常食管黏膜5例, 癌旁组织10例. 术后立即取材, 以40 g/L多聚甲醛/0.1 mol/L PBS(pH7.2)(内含0.1%焦碳酸二乙酯)固定约3 h, 常规脱水、浸蜡、包埋, 并进行连续切片, HE染色, 由二位富有经验的病理医师分别进行病理组织学分级诊断. 同时在相同部位取材, 以700 mL/L冷乙醇固定, 进行流式细胞仪检测. 癌旁上皮经组织学证实都有明显的不典型增生. 患者术前未经放疗或化疗.
1.1.2 试剂: bcl-2、bax抗体为小鼠IgG单克隆抗体, Santa Cruz公司产品. 羊抗鼠FITC-IgG, 为Jackson Immunoresearch公司产品. bcl-2原位杂交试剂盒及SABC免疫组化试剂盒购自博士德生物工程有限公司. bcl-2 mRNA原位杂杂交试剂盒探针序列为: 5'-TGCGA CAGCT TATAA TGGAT GTACT TCATC-3'; 5'-GTGAA GGGCG TCAGG TGCAG CTGGC TGGAC-3'; 5'-AGGTG CCGGT TCAGG TACTC AGTCA TCCAC-3'.
1.2.1 bcl-2 mRNA原位杂交: 切片常规脱蜡、水化, 双氧水处理封闭内源性过氧化物酶. 继以按原位杂交试剂盒说明书进行检测, 个别步骤反应时间加以调整. 以已知阳性片作为阳性对照, 以反应中不加mRNA探针作为阴性对照. 显微镜下观察, 阳性对照充分显色后, 立即终止反应.
1.2.2 免疫组织化学检测: 切片常规脱蜡、水化, 双氧水处理封闭内源性过氧化物酶. 继以按常规S-P法进行免疫组化染色. Bax一抗的稀释度为1:100. 以已知阳性片作为阳性对照, 以0.01 mol/L PBS代替一抗作为阴性对照, 显微镜下观察, 阳性对照充分显色后, 立即终止反应.
1.2.3 流式细胞仪基因蛋白定量检测: 具体方法按文献[3]进行.
1.2.4 原位杂交及免疫组织化学结果定量分析: 对原位杂交及免疫组织化学染色结果利用HPIAS-1000高清晰度彩色病理图文报告分析系统进行灰度测量分析, 将原位杂交及免疫组化染色结果转化为灰度值进行定量分析. 每张原位杂交及免疫组化切片以组织间质入射光的值作为定标. 每张切片测定5个视野(10×20), 分别测定间质灰度及癌巢(或上皮)灰度, 取平均值, 以净灰度值做为本例切片的测定值.
测定值 = 间质灰度值-癌巢(或上皮)灰度值.
统计学处理 采用SPSS10.0统计软件进行统计分析. 对于原位杂交、免疫组化及FCM检测结果, 各组间显著性检验采用单因素方差分析, 组间多重比较采用Scheffe法. P<0.05表示差异有显著性.
原位杂交检测可见, bcl-2 mRNA在正常食管上皮几乎无表达, 在癌旁异型增生上皮有少量表达, 主要是上皮近基底部细胞胞质呈棕黄色颗粒状(图1A). 在不同分化SCC中, 癌细胞胞质都有明显的bcl-2 mRNA表达, 尤其是在低分化SCC(图1B). 经灰度测定分析, 其表达与分化程度有关, 在正常、癌旁上皮及不同分化SCC中的表达差异具有显著性(F = 25.733, P<0.01). bcl-2 mRNA表达在正常及癌旁上皮都相对较低, 在SCC中的表达则随着分化程度的降低明显升高(表1), 在低分化SCC中的表达最高.
FCM检测显示, 在正常、癌旁上皮及SCC中Bcl-2蛋白表达逐渐增高, 并且随癌组织的分化程度降低其表达增高, 并且在不同分化组间差异显著(F = 8.738, P<0.01), 尤其是正常上皮、癌旁上皮组分别与中、低分化SCC组, 高分化与低分化SCC组间差异显著(表2, P<0.05).
Bax在正常上皮及癌旁异型增生上皮都有表达, 但癌旁上皮表达更为明显, 主要见于上皮近基底层细胞, 胞质呈棕黄色颗粒状(图2A). Bax在高分化SCC中的表达主要表现为癌细胞胞质呈棕黄色, 中心角化珠不着色; 而低分化SCC中可见癌细胞胞质弥漫呈棕黄色(图2B). 经灰度分析发现, 随浸润深度的增加其表达呈增高趋势, 但组间差异无显著性(F = 1.534, P = 0.201, 表3).
| 分 组 | n | mean±SD |
| (A)正常上皮 | 5 | 47.20±7.12 |
| (B)癌旁上皮 | 10 | 32.80±10.52 |
| (C)高分化SCC | 39 | 44.08±21.49 |
| (D)中分化SCC | 18 | 47.76±18.76 |
| (E)低分化SCC | 24 | 37.36±19.51 |
癌变是一个长期的多步骤、多因素参与的过程, 机体的某些遗传不足加上长期的某些环境因素刺激可能改变宿主的遗传易感性. 长期的慢性致癌源的刺激可使原癌基因激活和/或抑癌基因失活, 二者可通过参与细胞周期的调控、信号传导、细胞分化及凋亡等事件, 引起肿瘤的发生和发展. 既往认为肿瘤形成是无限增生所致的细胞积聚, 但近年发现, 许多肿瘤不仅存在细胞增生, 同时也存在细胞凋亡受阻[4-10].
Bcl-2、Bax都是调控细胞凋亡的相关蛋白, Bcl-2是凋亡抑制因子, 而Bax是凋亡促进因子. bcl-2原癌基因由3个外显子组成, 编码239个氨基酸组成的分子质量为26 kD的Bcl-2α蛋白和205个氨基酸组成的分子质量为22 kD的Bcl-2β蛋白[11]. 有关Bcl-2与食管癌发生关系的报道尚少. Bcl-2和Bax以同源或异源二聚体形式发挥作用. Bcl-2抑制凋亡必须通过与Bax形成异源二聚体来实现. 当Bax同源二聚体形成, 便诱导凋亡; 随Bcl-2蛋白表达量上升, 越来越多的Bax二聚体分开, 与Bcl-2形成比Bax-Bax更稳定的Bax-Bcl-2异源二聚体, 从而"中和"了Bax-Bax诱导凋亡的作用. 因此, 细胞内Bax与Bcl-2的比例调节了凋亡的发生.
在食管上皮癌变过程中, 正常上皮无Bcl-2表达, 而癌旁上皮中Bcl-2、Bax均有少量表达; 不同分化的SCC中Bax都有明显的表达且与SCC分化程度无关, 而Bcl-2在SCC中的表达随分化程度的降低明显增高. 提示随Bcl-2表达增多而形成了较多的Bcl-2-Bax异源二聚体, 从而显示其抗凋亡活性, 抑制了癌细胞凋亡, 即分化程度越低, 癌细胞抗凋亡能力愈强. Sarbia et al[12]也发现, Bcl-2表达与食管癌病理学分级呈正相关. Liu et al[13]运用转基因小鼠对乳腺细胞的研究发现, COX-2诱导的肿瘤组织中促凋亡蛋白Bax表达水平降低而抗凋亡蛋白Bcl-2表达升高. 乳腺上皮细胞凋亡降低可能导致肿瘤的形成. 已有研究显示[14], Bcl-2蛋白过度表达抑制细胞凋亡是一个早期事件, 对于食管癌bcl-2可能是一个药物治疗的新靶点[15].
总之, bcl-2及bax基因表达与细胞凋亡密切相关, 可能在食管上皮癌变及SCC的生物学行为中起重要作用; 尤其是抗凋亡蛋白Bcl-2表达在食管SCC中异常增高, 可能在食管癌变及浸润过程中扮演着重要角色.
编辑: 张海宁
| 1. | Montesano R, Hainaut P. Molecular precursor lesions in oesophageal cancer. Cancer Surv. 1998;32:53-68. [PubMed] |
| 4. | Kerr JF, Winterford CM, Harmon BV. Apoptosis. Its significance in cancer and cancer therapy. Cancer. 1994;73:2013-2026. [PubMed] |
| 8. | Liu HF, Liu WW, Fang DC, Men RP. Expression of bcl-2 protein in gastric carcinoma and its significance. World J Gastroenterol. 1998;4:228-230. [PubMed] |
| 10. | Beardsmore DM, Verbeke CS, Davies CL, Guillou PJ, Clark GW. Apoptotic and proliferative indexes in esophageal cancer: predictors of response to neoadjuvant therapy [corrected]. J Gastrointest Surg. 2003;7:77-86; discussion 86-87. [PubMed] |
| 11. | Tsujimoto Y, Croce CM. Analysis of the structure, transcripts, and protein products of bcl-2, the gene involved in human follicular lymphoma. Proc Natl Acad Sci USA. 1986;83:5214-5218. [PubMed] |
| 12. | Sarbia M, Bittinger F, Porschen R, Verreet P, Dutkowski P, Willers R, Gabbert HE. bcl-2 expression and prognosis in squamous-cell carcinomas of the esophagus. Int J Cancer. 1996;69:324-328. [PubMed] |
| 13. | Liu CH, Chang SH, Narko K, Trifan OC, Wu MT, Smith E, Haudenschild C, Lane TF, Hla T. Overexpression of cyclooxygenase-2 is sufficient to induce tumorigenesis in transgenic mice. J Biol Chem. 2001;276:18563-18569. [PubMed] |