修回日期: 2004-10-15
接受日期: 2004-10-20
在线出版日期: 2005-01-01
目的: 研究低剂量三氧化二砷作用于肝HepG2细胞之后, 无机砷对于肝细胞基因表达谱的影响.
方法: 应用基因表达谱芯片技术, 对5 umol/L三氧化二砷诱导的HepG2细胞和以DMSO处理的相同细胞的mRNA进行差异显示分析, 研究三氧化二砷诱导人HepG2细胞后的差异表达基因.
结果: HepG2细胞经5 umol/L三氧化二砷诱导后, 所检测的4096条目的基因中有137条产生差异表达, 其中53条基因表达上调, 84条基因表达下调; 其中有10条尚未在genebank登录的新基因.
结论: 成功筛选了低剂量三氧化二砷诱导肝细胞后的基因表达谱, 为进一步阐明无机砷对肝细胞作用的调节机制及低剂量无机砷用于治疗肝癌等肿瘤的药理作用机制提供了科学依据.
引文著录: 吴顺华, 郑玉建, 成军, 刘妍, 张跃新, 刘开泰, 钟彦伟, 吴煜. 低剂量三氧化二砷对HepG2细胞基因表达谱调节的影响. 世界华人消化杂志 2005; 13(1): 100-104
Revised: October 15, 2004
Accepted: October 20, 2004
Published online: January 1, 2005
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2005; 13(1): 100-104
- URL: https://www.wjgnet.com/1009-3079/full/v13/i1/100.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i1.100
无机砷化物是一种明确的致癌物, 但同时又被用在肿瘤的治疗中并且取得了显著的成效. 无机砷作用于细胞后, 导致细胞基因表达谱发生变化, 产生了许多砷调节的基因, 这些基因参与了砷的致癌或抑癌机制的双向作用. 随着现代医学分子生物学技术的快速发展、人类基因组计划的完成以及我国牵头的肝脏蛋白质组学的启动, 研究砷对肝细胞调节的相关基因对解释砷的双向作用机制有很重要的意义.
基因芯片技术(cDNA microarray)是由大量目的基因片段有序、密集地固定于玻片或尼龙膜上而制成芯片, 将两组组织或细胞的mRNA逆转录成cDNA, 掺入荧光标记, 同时与芯片杂交, 通过扫描分析每一位置的荧光信息可以快速有效地检测到二者间差异表达的基因[1]. 我们应用cDNA基因芯片技术, 筛选低剂量三氧化二砷作用于HepG2细胞后基因的表达差异, 并应用生物信息学(bioinformatics)分析初步获知其基因全长序列, 探讨这些基因在无机砷对肝细胞调节机制中的作用.
HepG2细胞由本室保存, 细胞培养相关试剂及总RNA提取试剂Trizol均购自Gibco公司, 三氧化二砷(As2O3)北京化工三厂, 用PBS稀释成1 mmol/L的As2O3储存液备用. 用含10%FBS的DMEM培养基常规培养HepG2细胞, 待细胞生长至对数期时, 分别改用含As2O3和DMSO的细胞培养液继续培养, 染砷终浓度为5μmol/L, 48 h后收获细胞, 每5×106个细胞加入1 mL Trizol试剂, 立即保存于液氮中.
1.2.1 总RNA提取及mRNA纯化: 使用Trizol一步法提取As2O3及DMSO处理的HepG2细胞总RNA(分别标记为实验组和对照组), 样品经分光光度计检测吸光度A值, 并行热稳定实验, 于-20 ℃和70 ℃保温1 h后, 经琼脂糖凝胶电泳检测28 s、18 s条带变化. 以Qiagen公司Oligotex mRNA Midi Kit纯化得mRNA. 操作按说明书进行, 并行电泳检测.
1.2.2 探针标记: 常规方法逆转录标记cDNA探针并纯化, Cy3-dUTP标记对照组细胞mRNA(5 μg), Cy5-dUTP标记实验组细胞mRNA(5 μg), 乙醇沉淀后溶解在20 μL 5×SSC+2 g/L SDS杂交液中.
1.2.3 芯片制备: 芯片类型为BiostarH-40 s×1包含的4096个cDNA由上海博星基因芯片有限责任公司提供, 包括原癌基因和抑癌基因、离子通道和运输蛋白、细胞周期蛋白类、外压反应蛋白、细胞骨架和运动、细胞凋亡相关的蛋白、DNA合成和修复、重组蛋白DNA结合、转录和转录因子、细胞受体免疫相关、细胞信号和传递蛋白、代谢、蛋白翻译合成、发育相关等. 以通用引物进行PCR扩增, PCR产物长度为1000-3000 bp.靶基因以0.5 g/L溶解于3×SSC溶液中, 用Cartesian公司的Cartesian 7500点样仪及TeleChem公司的硅烷化玻片进行点样. 玻片经水合(2 h)、室温干燥(30 min), UV交联, 再分别用2 g/L SDS、水及2 g/L的硼氢化钠溶液处理10 min, 晾干备用.
1.2.4 杂交及洗涤: 将基因芯片和杂交探针在95 ℃水浴变性5 min, 将混合探针加在基因芯片上, 置于60 ℃杂交15-17 h. 依次以2×SSC+ 2 g/L SDS、1 g/L×SSC +2 g/L SDS、1 g/L×SSC洗涤10 min, 室温晾干.
1.2.5 检测与分析: 用General Scanning公司的ScanArray4000扫描芯片, 用预先选定的内参照基因(24条管家基因, 每个基因点2个点, 共48个点)对Cy3和Cy5的原始提取信号进行均衡和修正. 用GenePix Pro 3.0软件分析Cy3、Cy5两种荧光信号的强度, 计算Cy5/Cy3比值. 阳性结果判断: Cy5/Cy3>1.8, 红色荧光, 显示表达上调; Cy5/Cy3<0.6, 为绿色荧光, 显示表达下调.
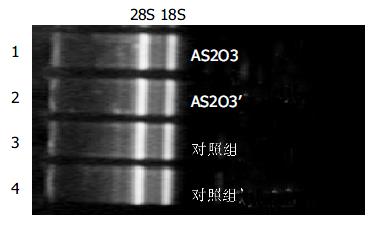
实验组和对照组总RNA的吸光度比值A260/A 280分别为2.005和2.020, 热稳定实验70 ℃保温1 h与-20 ℃ 1 h电泳条带比较, 显示28 s条带无明显降解, 电泳结果证实已抽提高纯度的总RNA(图1). mRNA主要集中于0.9-4.0 kb的连续条带.
在芯片上共有4096个cDNA. 为了监控芯片杂交技术体系的整个过程, 在芯片上设置了阴性对照(8条水稻基因, 共8个点), 这些点的杂交信号均很低, 证实了数据的可靠性. 为了校正Cy5、Cy3标记体系间的系统误差, 实验数据要进行均一化处理. 均一化处理时先依据以下2个原则筛选出参与均一化处理的有效基因点: (1)该基因点的Cy3、Cy5信号值皆大于200, 或者其中之一大于800; (2)该基因点的Cy5信号值/Cy3信号值的比值在0.1-10之间. 由于实验组探针标记Cy5荧光素(呈红色), 对照组探针标记Cy3荧光素(呈绿色), 红绿颜色的差异就显示该基因在实验组和对照组中基因表达水平上的差异, 黄色代表表达水平无差异. 按阳性标准, 从4096个基因中筛选出差异表达基因共137条, 占3.35%, 其中53条基因表达上调, 84条基因表达下调.
表达上调的基因主要有胰岛素样生长因子2受体(IGF2R)等(表1); 表达下调的基因主要有人TP53激活蛋白1(TP53AP1)等(表2).
| 编号 | GeneBank登录号 | 编码蛋白 | Cy5/Cy3 |
| 1 | NM_000876 | 人胰岛素样生长因子2受体(IGF2R) | 7.870 |
| 2 | NM_002758 | 人有丝分裂原激活蛋白2激酶6(MAP2K6) | 2.864 |
| 3 | NM_003129 | 人GTP激活蛋白1(RAP1GA1) | 2.731 |
| 4 | NM_002885 | 人红血球膜蛋白41(EPB41) | 2.622 |
| 8 | NM_019058 | 人DNA损伤诱导转录子4(DDIT4) | 2.519 |
| 9 | NM_005345 | 人HSP70a 1A(HSPA1A) | 2.465 |
| 10 | NM_002313 | 人肌动蛋白结合LIM蛋白1(ABLIM1) | 2.449 |
| 11 | NM_005554 | 人角蛋白6A(KRT6A) | 2.436 |
| 12 | NM_003330 | 人硫氧还蛋白还原酶1(TXNRD1) | 2.364 |
| 13 | NM_004924 | 人辅肌动蛋白4(ACTN4) | 2.356 |
| 14 | NM_001909 | 人组织蛋白酶D(CTSD) | 2.355 |
| 14 | NM_001821 | 人无脉络膜样守护蛋白2(CHML) | 2.351 |
| 16 | NM_001619 | 人肾上腺素能β受体激酶1(ADRBK1) | 2.281 |
| 17 | NM_001961 | 人真核翻译延伸因子2(EEF2) | 2.265 |
| 18 | NM_183380 | 人大疱性类天疱疮抗原1(BPAG1) | 2.221 |
| 19 | NM_002839 | 人酪氨酸磷酸酶受体D(PTPRD) | 2.206 |
| 20 | NM_006295 | 人valyl-tRNA合成酶2(VARS2) | 2.194 |
| 21 | NM_012479 | 人14-3-3γ基因(YWHAG) | 2.172 |
| 22 | NM_005243 | 人Ewing瘤断裂点1(EWSR1) | 2.153 |
| 23 | NM_004423 | 人散乱的果蝇同源子3(DVL3) | 2.126 |
| 24 | NM_000302 | 人前胶原赖氨酸氧戊二酸盐二氧合酶5(PLOD) | 2.106 |
| 25 | NM_030662 | 人有丝分裂原激活蛋白2激酶2(MAP2K2) | 2.058 |
| 26 | NM_178326 | 人自食抗原1(APG4B) | 2.013 |
| 27 | NM_001562 | 人白介素18(IL-18) | 1.998 |
| 编号 | GeneBank登录号 | 编码蛋白 | Cy5/Cy3 |
| 1 | NM_012258 | 人hairy/enhancer-of-split相关YRPW蛋白基序1(HEY1) | 0.387 |
| 2 | NM_006294 | 人泛醌-细胞色素C还原酶结合蛋白(UQCRB) | 0.398 |
| 3 | NM_145686 | 人有丝分裂原激活蛋白4激酶4(MAP4K4) | 0.410 |
| 4 | NM_017719 | 人SNF-1相关激酶(SNRK) | 0.428 |
| 5 | NM_000354 | 人丝氨酸(半胱氨酸)蛋白酶抑制子(SERPI) | 0.429 |
| 6 | NM_000508 | 人纤维蛋白原α(FGA) | 0.435 |
| 7 | NM_012329 | 人单核细胞巨噬细胞分化相关蛋白(MMD) | 0.440 |
| 8 | NM_002118 | 人主要组织相容性抗原复合物II DMb(HLA-DMB) | 0.442 |
| 9 | NM_022807 | 人小核糖体核蛋白N(SNRPN) | 0.450 |
| 10 | NM_000384 | 人载脂蛋白B(APOB) | 0.453 |
| 11 | NM_000371 | 人甲状腺运载蛋白(TTR) | 0.455 |
| 12 | NM_001206 | 人基本转录元件结合蛋白1(BTEB1) | 0.458 |
| 13 | NM_003584 | 人双向特异性磷酸酶11(DUSP11) | 0.459 |
| 14 | NM_003366 | 人泛醌-细胞色素C还原酶核心蛋白II(UQCRC2) | 0.471 |
| 15 | NM_005410 | 人血浆硒蛋白1(SEPP1) | 0.477 |
| 16 | NM_138288 | 人14号染色体ORF147(C14orf147) | 0.480 |
| 17 | NM_000779 | 人细胞色素P450家族4B亚单位多肽1(CYP4B1) | 0.484 |
| 18 | NM_003129 | 人鲨烯环氧酶(SQLE) | 0.486 |
| 19 | NM_000042 | 人载脂蛋白H(APOH) | 0.488 |
| 20 | NM_002040 | 人GA结合蛋白转录因子α(GABPA) | 0.489 |
| 21 | NM_016085 | 人凋亡相关蛋白APR-3(APR-3) | 0.497 |
| 22 | NM_014462 | 人核内小RNALSM1同源蛋白(LSM1) | 0.498 |
| 23 | NM_001951 | 人真核翻译延伸因子2转录因子5(E2F5) | 0.502 |
| 24 | NM_002489 | 人NADH羟化酶1α亚复合物4(NDUFA4) | 0.504 |
| 25 | NM_000917 | 人前胶原脯氨酸氧戊二酸盐二氧合酶4Iα多肽1(P4HA1) | 0.516 |
| 26 | NM_007233 | 人TP53激活蛋白1 (TP53AP1) | 0.567 |
无机砷中常见的砷化物是三氧化二砷(arsenic trioxide, As2O3), 他是我国传统中药的一种, 俗称砒霜, 近年作为细胞凋亡诱导剂广泛地应用于抗肿瘤. 肝细胞肝癌(hepatocellular carcinoma HCC)是消化系统常见的肿瘤[2-4], 恶性程度高、预后差[5-8]. As2O3在与肝癌细胞的研究表明, 他是较好的抗肿瘤药物之一[9]As2O3同时作为一种致癌物, 长期低剂量的慢性接触可以引起皮肤异常改变导致肺癌、膀胱癌、肝癌等其他内脏肿瘤的发生. 在我国地方性砷中毒受威胁人口达300万[10]. 因此研究As2O3与肝细胞相互作用的机制在有效防治地方性砷中毒和抗肝癌治疗方面有很重要的意义.
基因芯片(Microarray) 技术于1991年首次在Science杂志上被提出[1]. 因芯片技术具有高度的敏感性和特异性, 可自动、快速地同时检测成千上万个基因的表达, 基因表达的分析研究有利于揭示不同层次上多基因协同作用的生命过程[11].
无机砷对细胞基因表达影响的研究已有报道, 发现无机砷可以通过调节相关的基因表达影响机体代谢障碍、生长发育毒性作用以及宿主细胞对砷的抵抗等作用[12]. 我们通过cDNA芯片技术检测低剂量无机砷诱导的肝HepG2细胞基因表达谱的变化, 结果发现了共有137条差异表达基因, 涉及原癌基因和抑癌基因、离子通道和运输蛋白、细胞周期蛋白类、外压反应蛋白、细胞骨架和运动、细胞凋亡相关的蛋白、DNA合成和修复、重组蛋白DNA结合、转录和转录因子、细胞受体免疫相关、细胞信号和传递蛋白、代谢、蛋白翻译合成、发育相关等各个领域.
(1)胰岛素样生长因子2受体(IGF2R); 胰岛素样生长因子2(insulin-like growth factor2, IGF2), 也被称为生长调节素A(somatomedin A), 是胰岛素- 胰岛素样生长因子-释放生长因子, IGF-2与肝癌的关系密切. IGF2的印迹丢失(loss of imprinting, LO I)LOL可能是HCC的癌前表现之一[13-14]. 我们的实验发现三氧化二砷可以显著上调IGF2的表达, 表明三氧化二砷是HCC发生的促动剂. (2)硫氧还蛋白还原酶1(TXNRD1):TXNRD是一类含有硒代半胱氨酸的氧化还原酶, 以二聚体的形式存在. 哺乳类共有3种类型的TXNRD, 他们分别是位于所有细胞胞质内的TXNRD1, 位于线粒体的TXNRD3和只存在于睾丸的TGB[15]. TXNRD1和其底物硫氧还蛋白1(Trx1)组成了一个氧化还原系统, TXNRD1促进了Trx1的还原, 调节氧化应激, 还影响了细胞信号转导途径. TXNRD1具有重要的抗氧化和氧化还原调节作用[16]. 我们的实验发现三氧化二砷可以上调TXNRD1的表达, 证实TXNRD1在无机砷急性中毒期有一定的解毒作用. (3)白介素-18(IL-18)IL-18在体外有较强的抗肿瘤潜能. 我们的实验发现三氧化二砷可以上调ILl-18的表达, 结果提示无机砷抗瘤可能通过启动了IL-18调节的抑瘤功能, 因此, 可在三氧化二砷治疗肝癌的同时补充IL-18协同发挥这种抗瘤作用; (4)热休克蛋白70年(HSPA1A): HSP70的高表达与肿瘤的恶性程度及患者的无瘤生存期相关[17]. HSP70作为肿瘤血清生物标志物在肝癌过度表达. 三氧化二砷诱导了HSP70在肝癌细胞过度表达提示无机砷可以提高肿瘤细胞HSP的表达导致癌变过程加剧. (5)信号转导分子: MAP2K2和MAP2K6是MAPK信号网络的级联分子在MAPK信号通路的具有调节细胞分裂和凋亡的作用. 三氧化二砷上调细胞外信号调节激酶MAKP通路在细胞生长分化和衰老中起作用. (6)转录调节元件: DNA损伤诱导转录子4(DDIT4)是p53和p63诱导的DNA损伤的一个新的转录靶点, 也叫REDD1, 他与p53和p63联合参与活性氧的调节[18]. 14-3-3γ基因(Y WHAG):14-3-3蛋白是真核细胞普遍存在的蛋白激酶家族, 其功能是磷酸化丝氨酸结合蛋白模块. 14-3-3蛋白参与了磷酸化依赖作用的蛋白结合蛋白作用, 其调控作用包括细胞周期启动, DNA损伤断点的保持, 激活MAP激酶, 遏制凋亡, 协调整联蛋白发出信号, 维持细胞骨架的动力学等[19-20]. 14-3-3有可能成为将来治疗疾病的靶点之一.
(1)细胞色素P450家族4B亚家族多肽1(CYP4B1), 细胞色素P450(cytochrome P450, CYP)的生物学效应具有双重性, 包括解毒过程和毒性化作用. 大多数CYP家族定位在肝脏. 不同个体对外来物质的代谢存在明显的差异, CYP的表型和基因型的不同是构成这种差异的基础. Vakharia et al[21]发现As2O3可以通过下调CYP1A1诱导的生物激活反应, 达到抑制癌的发生. 有学者Furukawa et al[22]用实时定量PCR检测了HCC患者外周血和肝脏CYP1A1, 1A2, 1B1, 2A6, 2B6, 2C8, 2C9, 2C18, 2C19, 2D6, 2E1, 2F1, 2J2, 3A4, 3A5, 3A7, 4A11, 4B1和CYP27基因的表达, 结果发现外周血检出CYP1A1, 1A2, 1B1, 2A6, 2B6和2E1的表达, 肝组织中除了CYP2F1外都检出. 但经扣除基线CYP波动外, 定量分析发现只有CYP4B1在外周血和肝组织中表达水平显著相关, 因此监测外周血CYP4B1可以成为环境致癌物暴露人群血清学的良好指标. 我们的实验发现低剂量三氧化二砷对HepG2细胞CYP4B1显著下调作用证实无机砷通过下调CYP4B1发挥对HCC有治疗作用. (2)细胞信号转导相关基因: 有丝分裂原活化的蛋白激酶激酶激酶激酶4(MAP4K4)MAP4K4是人和小鼠造血祖细胞激酶/生发中心激酶(GCK)样激酶和Nck作用激酶的别称, MAP4K4属STE20蛋白激酶家族, 调节C-Jun氮端激酶(JNK). 我们的实验发现无机砷可以下调MAP4K4的表达, 因此可以抑制JNK的活化, 从而抑制C-fos和C-Jun表达达到防治肿瘤的作用; 此外还发现三氧化二砷可以下调丝氨酸-半胱氨酸抑制子(SERPI)的表达, 表明无机砷可通过诱导丝氨酸-半胱氨酸蛋白酶体活化, 引起细胞增生导致肿瘤. (3)血浆硒蛋白(SEPP1): 硒蛋白是构成谷胱甘肽过氧化物酶的活性成分; 肝癌死亡率与血中硒含量低有关, 硒与癌症有着密切的关系[23-24]. 我们发现三氧化二砷下调硒蛋白的表达, 表明无机砷参与脂质过氧化损伤导致癌症. (4)组织相容抗原复合物II类分子: 我们发现无机砷下调MHC-II类分子, 抑制细胞免疫应答. (5)载脂蛋白B(APOB)、载脂蛋白H(APOH): 三氧化二砷诱导肝细胞损伤从而抑制载脂蛋白的合成, 导致甘油三酯堆积引起脂肪肝的发生, 持续会导致肝硬化甚至肝癌[25]. 我们的实验结果证实无机砷载脂蛋白B和H的下调作用印证了无机砷致肝癌分子作用. (6)凋亡相关蛋白3(APR-3) APR-3是Zhu et al. [26]人在用抑制性消减杂交技术克隆全反式维甲酸诱导的HL60细胞时发现的10个未知基因中的一个, 命名apr-1, apr-2, apr-3等, 反向斑点杂交证实这些基因与细胞凋亡有关. 我们的实验也发现三氧化二砷下调apr-3的表达. 无机砷可以抑制细胞凋亡, 他有双向调节作用. (7)基本转录元件结合蛋白1(BTEB1): 基本的转录元件结合蛋1是转录因子Sp/Kruppel-样家族的成员[27-28], 三氧化二砷下调基本转录元件结合蛋白提示无机砷抑制HepG2细胞相关基因的转录.
总之, 我们通过cDNA基因表达谱芯片对低剂量三氧化二砷诱导的HepG2细胞差异调节基因的表达研究表明, 三氧化二砷能够上调或下调HepG2细胞中许多不同类基因表达, 这些基因参与了细胞信号转导、细胞增生与分化、细胞凋亡、免疫调节、细胞骨架和运动等生物学过程. 在这个复杂的调节网络无机砷发挥着其双向调节作用, 对于其作用阈值的掌握是熟练应用其抗肿瘤作用的关键所在. 我们的研究提示无机砷诱导肝癌细胞上下调节的几个重要基因将在今后的研究中继续关注, 此外, 发现的新基因为我们的后续研究也提供了广阔的空间. 因此, 我们的实验结果对于阐明低剂量无机砷对肝细胞双向调节作用机制以及地方性慢性砷中毒的致癌机制具有重要意义.
编辑: 张海宁
| 1. | Fodor SP, Read JL, Pirrung MC, Stryer L, Lu AT, Solas D. Light-directed, spatially addressable parallel chemical synthesis. Science. 1991;251:767-773. [PubMed] |
| 2. | Tang YW, Yao XX. Regulating effect of HCC cells on the activation of stellate cells. Shijie Huaren Xiaohua Zazhi. 2001;9:202-204. [DOI] |
| 3. | Cui J, Yang DH, Qin HR. Mutation and clinical significance of c-fos oncogene in hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi. 2001;9:392-395. [DOI] |
| 4. | Worman HJ, Feng L, Mamiya N. Molecular biology and the diagnosis and treatment of liver diseases. World J Gastroenterol. 1998;4:185-191. [PubMed] |
| 5. | He XX, Wang JL. The current status and prospect in the gene therapy of liver cancer. Huaren Xiaohua Zazhi. 1998;6:158-159. [DOI] |
| 6. | Yang LJ, Wang WL. Preparation of monoclonal antibody against apoptosis-associated antigens of hepatoma cells by subtractive immunization. World J Gastroenterol. 2002;8:808-814. [PubMed] |
| 7. | Wang FS, Liu MX, Zhang B, Shi M, Lei ZY, Sun WB, Du QY, Chen JM. Antitumor activities of human autologous cytokine-induced killer (CIK) cells against hepatocellular carcinoma cells in vitro and in vivo. World J Gastroenterol. 2002;8:464-468. [PubMed] |
| 8. | Zhang G, Long M, Wu ZZ, Yu WQ. Mechanical properties of hepatocellular carcinoma cells. World J Gastroenterol. 2002;8:243-246. [PubMed] |
| 9. | Pu YS, Hour TC, Chen J, Huang CY, Guan JY, Lu SH. Arsenic trioxide as a novel anticancer agent against human transitional carcinoma--characterizing its apoptotic pathway. Anticancer Drugs. 2002;13:293-300. [PubMed] |
| 11. | Shalon D, Smith SJ, Brown PO. A DNA microarray system for analyzing complex DNA samples using two-color fluorescent probe hybridization. Genome Res. 1996;6:639-645. [PubMed] |
| 13. | Li H, Zhang N. Study on the expression and genomic imprinting status of insulin-like growth factor 2 gene in hepatocellular carcinoma. Zhonghua Ganzangbing Zazhi. 2004;12:347-349. [PubMed] |
| 14. | Poirier K, Chalas C, Tissier F, Couvert P, Mallet V, Carrié A, Marchio A, Sarli D, Gicquel C, Chaussade S. Loss of parental-specific methylation at the IGF2 locus in human hepatocellular carcinoma. J Pathol. 2003;201:473-479. [PubMed] |
| 15. | Sakurai A, Yuasa K, Shoji Y, Himeno S, Tsujimoto M, Kunimoto M, Imura N, Hara S. Overexpression of thioredoxin reductase 1 regulates NF-kappa B activation. J Cell Physiol. 2004;198:22-30. [PubMed] |
| 16. | 纪 冬, 成 军, 郭 江, 董 菁, 王 建军, 刘 妍. 丙型肝炎病毒非结构蛋白NS3上调硫氧还蛋白还原酶1基因的表达. 世界华人消化杂志. 2004;12:1555-1558. [DOI] |
| 17. | Nylandsted J, Jäättelä M. [Heat shock protein 70: an important survival factor for cancer cells]. Ugeskr Laeger. 2004;166:3184-3186. [PubMed] |
| 18. | Ellisen LW, Ramsayer KD, Johannessen CM, Yang A, Beppu H, Minda K, Oliner JD, McKeon F, Haber DA. REDD1, a developmentally regulated transcriptional target of p63 and p53, links p63 to regulation of reactive oxygen species. Mol Cell. 2002;10:995-1005. [PubMed] |
| 19. | Voigt J, Stevanovic S, Schirle M, Fausel M, Maier J, Adam KH, Marquardt O. A 14-3-3 protein of Chlamydomonas reinhardtii associated with the endoplasmic reticulum: nucleotide sequence of the cDNA and the corresponding gene and derived amino acid sequence. Biochim Biophys Acta. 2004;1679:180-194. [PubMed] |
| 20. | Wilker E, Yaffe MB. 14-3-3 Proteins--a focus on cancer and human disease. J Mol Cell Cardiol. 2004;37:633-642. [PubMed] |
| 21. | Vakharia DD, Liu N, Pause R, Fasco M, Bessette E, Zhang QY, Kaminsky LS. Polycyclic aromatic hydrocarbon/metal mixtures: effect on PAH induction of CYP1A1 in human HEPG2 cells. Drug Metab Dispos. 2001;29:999-1006. [PubMed] |
| 22. | Furukawa M, Nishimura M, Ogino D, Chiba R, Ikai I, Ueda N, Naito S, Kuribayashi S, Moustafa MA, Uchida T. Cytochrome p450 gene expression levels in peripheral blood mononuclear cells in comparison with the liver. Cancer Sci. 2004;95:520-529. [PubMed] |
| 23. | Nouarie M, Pourshams A, Kamangar F, Sotoudeh M, Derakhshan MH, Akbari MR, Fakheri H, Zahedi MJ, Caldwell K, Abnet CC. Ecologic study of serum selenium and upper gastrointestinal cancers in Iran. World J Gastroenterol. 2004;10:2544-2546. [PubMed] |
| 24. | Xu N, Hurtig M, Zhang XY, Ye Q, Nilsson-Ehle P. Transforming growth factor-beta down-regulates apolipoprotein M in HepG2 cells. Biochim Biophys Acta. 2004;1683:33-37. [PubMed] |
| 25. | Al-Taie OH, Uceyler N, Eubner U, Jakob F, Mörk H, Scheurlen M, Brigelius-Flohe R, Schöttker K, Abel J, Thalheimer A. Expression profiling and genetic alterations of the selenoproteins GI-GPx and SePP in colorectal carcinogenesis. Nutr Cancer. 2004;48:6-14. [PubMed] |
| 26. | Zhu F, Yan W, Zhao ZL, Chai YB, Lu F, Wang Q, Peng WD, Yang AG, Wang CJ. Improved PCR-based subtractive hybridization strategy for cloning differentially expressed genes. Biotechniques. 2000;29:310-313. [PubMed] |
| 27. | Simmen RC, Eason RR, McQuown JR, Linz AL, Kang TJ, Chatman L, Till SR, Fujii-Kuriyama Y, Simmen FA, Oh SP. Subfertility, uterine hypoplasia, and partial progesterone resistance in mice lacking the Kruppel-like factor 9/basic transcription element-binding protein-1 (Bteb1) gene. J Biol Chem. 2004;279:29286-29294. [PubMed] |
| 28. | Kaczynski JA, Conley AA, Fernandez Zapico M, Delgado SM, Zhang JS, Urrutia R. Functional analysis of basic transcription element (BTE)-binding protein (BTEB) 3 and BTEB4, a novel Sp1-like protein, reveals a subfamily of transcriptional repressors for the BTE site of the cytochrome P4501A1 gene promoter. Biochem J. 2002;366:873-882. [PubMed] |