修回日期: 2004-11-18
接受日期: 2004-11-25
在线出版日期: 2005-01-01
目的: 比较兔食管下括约肌(lower esophageal sphincter, LES)与食管体部形态变化, 探讨食管体部平滑肌和LES细胞收缩功能及对乙酰胆碱的反应.
方法: 利用光镜、透射电镜下观察LES与食管体部形态; 测定LES与食管体部压力; 使用激光共聚焦测定食管体部平滑肌和LES细胞内钙离子浓度, 以及对乙酰胆碱(ACh)作用的反应.
结果: 兔食管LES平滑肌细胞周围肌浆网及肌丝明显增加. LES平均压力为1.4±0.1 kPa;食管体部平均压力为. 0.6±0.1 kPa (P<0.01). 兔食管LES平滑肌[Ca2+]i平均为156.1±4.8 nmol/L; 兔食管体部平滑肌细胞[Ca2+]i平均为122.6±4.3 nmol/L (P<0.05). 加入ACh后再次测定[Ca2+]i, LES平滑肌[Ca2+]i平均为241.3±5.7 nmol/L与加入ACh前有显著差异(P<0.01); 加入ACh后食管体部平滑肌[Ca2+]i平均为131.6±3.2 nmol/L, 与加入ACh前无显著差异(P>0.05).
结论: 正常食管LES与体部平滑肌可能具有不同的生理学基础及收缩机制, 食管体部对Ach诱导产生的收缩需要有细胞外钙的支持, 而Ach对LES的收缩作用是通过细胞内钙离子的释放而产生的.
引文著录: 韩勇, 赵正源, 王云杰, 徐晖. 兔食管下括约肌与体部形态及乙酰胆碱对其功能影响的比较. 世界华人消化杂志 2005; 13(1): 10-14
Revised: November 18, 2004
Accepted: November 25, 2004
Published online: January 1, 2005
AIM: To compare the morphology of lower esophageal sphincter (LES) and esophageal body, and to explore the response of contraction of the smooth muscle of LES to acetylcholine (ACh).
METHODS: The morphology of LES and esophageal body was examined under light microscope and electron microscope. The pressures of LES and the esophageal body were measured. The concentration of Ca2+ was determined with laser scanning confocal microscopy before and after ACh was administrated.
RESULTS: The sarcoplasmic reticulum and myofilament were significantly increased in smooth muscle cells of LES. The pressures were 1.40.1 kPa and 0.60.1kPa for LES and esophageal body, respectively, and there was significant difference between them (P < 0.01). The mean concentrations of Ca2+ were 156.1±4.8 and 122.6±4.3 nmol/L (P < 0.05) in LES and esophageal body respectively before the application of ACh, and they became 241.3±5.7 nmol/L and 131.6±3.2 nmol/L after ACh was applied. The changed concentration of Ca2+ in LES was significantly higher (P < 0.01).
CONCLUSION: Esophageal body and LES utilize Ca2+ from different sources to contract in response to Ach. In esophageal body, Ach-induced contraction requires influx of extracellular Ca2+, while in LES it might utilize intracellularly released Ca2+.
- Citation: Han Y, Zhao ZY, Wang YJ, Xu H. A comparative study of acetylcholine on the function and morphology of lower esophageal sphincter and esophageal body in rabbits. Shijie Huaren Xiaohua Zazhi 2005; 13(1): 10-14
- URL: https://www.wjgnet.com/1009-3079/full/v13/i1/10.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v13.i1.10
食管功能障碍性疾病如弥漫性食管痉挛、贲门失驰缓症、胃食管返流病(GERD)等的发病率日益增高[1-4], 在欧美国家高达到10%, 在我国虽然没有明确的统计数据, 但是临床存在大量胸骨后灼痛、返酸、吞咽困难的患者被证实与此类疾病有关[5-7]. 长期慢性病变可以导致慢性食管炎、吸入性肺炎、食管狭窄, 甚至癌变, 严重威胁人类生命健康[8-10].食管功能障碍性疾病是多因素疾病, 其病因一直未得到证实, 其中食管收缩、舒张功能障碍成为其发病的主要因素. 因此, 研究食管的功能, 尤其是收缩、舒张机制成为其关键. 正常食管体部、食管下括约肌LES平滑肌细胞的收缩机制如何, 目前尚无定论. 我们利用家兔对此进行了探讨.
Hanks液(g/L): NaCl 8.00, KCl 0.40, MgSO4-7H2O 0.20, Na2HPO4-12H2O 0.12, KH2PO4 0.06. D-glucose 1.00, CaCl2 0.14, NaHCO3 0.35. D-Hanks液: 按Hanks液配方, 不加CaCl2和MgSO4. Hanks液和D-Hanks液均采用国产分析纯试剂和超纯水配制. Fluo-3/AM: 美国BioRad产品. 取新西兰白兔10只. 质量1.5-2.5 kg. 术前禁食12 h, 用麻醉剂速眠新(846)0.2 mL/kg, im.麻醉兔, 耳静脉注入空气约20 mL, 致家兔死亡. 使兔仰卧固定于手术台上, 正中切口剖腹解剖后立即取出食管及贲门, 在胃贲门与食管相连处有一呈壶腹状膨大且黏膜增厚, 肌纤维呈环形排列的节段, 该节段即LES. 剥去浆膜, 环形切取带有黏膜的LES及从胃食管连接处向上5 cm的食管体部平滑肌组织各约0.8 cm, 30 g/L戊二醛固定组织. 固定后制备经逐次脱水、石蜡包埋组织制备光镜标本. 用锋利刀片将食管组织切成3-4 mm小块, 用10 g/L锇酸后固定2 h, 乙醇逐级脱水, Epon812做倒扣包埋. 聚合后在90 ℃左右的温度下取下包埋块, 定位及超薄切片, 可获得基本上符合要求的电镜标本. 铀-铅双重染色后在H-800电镜下观察.
兔食管平滑肌细胞的制备按Cao et al[11]报道的方法稍加修改, 制备游离的家兔食管下括约肌及食管体部平滑肌细胞. 将兔解剖显露食管, 游离食管, 锐性分离, 去除食管黏膜及外层浆膜保留平滑肌层. 分别将兔食管下括约肌LES及食管体部组织剪碎成2×2 mm小块、碾磨后孵育于37 ℃, 10 mL含2.5 g/L胰蛋白酶的Hanks液中, 放入CO2孵箱中消化30 min, 后冲洗离心5 min, 弃上清, 加入Hanks液再次冲洗离心5 min, 弃上清, 加入Hanks液2 mL, 吹打均匀, 用孔径为500 μm的过滤网将游离的平滑肌细胞滤过, 并收集于充满100%O2的烧瓶中待用. 细胞存活率检测 采用台盼蓝排斥实验, 先将细胞制备成1×109/L的单个细胞悬液, 再取9滴细胞悬液移入小试管中, 加1滴4 g/L台盼蓝溶液混匀, 在3 min内用血球计数板分别计数活细胞和死细胞, 得出细胞率. 检查细胞活性, 当细胞死亡时将被染成红色, 活的细胞不呈色, 实验要求成活细胞在90%以上.
1.2.1 食管体部、LES的压力测定: 用麻醉剂速眠新(846)0.2 mL/kg, im.麻醉兔, 使兔仰卧固定于手术台上. 通过兔口腔插入胃管. 使用三腔管腔内牵拉导管的方法测定兔食管全长的压力, 找出压力最高处, 此处为LES位置所在, 测定LES上方5 cm处的食管腔内压力.
Fluo-3是一敏感性指示剂, 能特异性的与Ca2+结合, 并在一定波长的激发光激发后产生荧光, 且与Ca2+结合后其荧光光谱发生变化, 其荧光强度与Ca2+浓度成正比, 因而可用于Ca2+的动态变化观察, 但Fluo-3为极性大的酸性化合物, 难以进入细胞, 而当其结合上亲脂的乙酰羟甲基酯成为脂溶性的Fluo-3/AM, 在与细胞温育时, 很容易透过细胞膜, 胞质内的非特异性酯酶将其脂解脱去脂基生成游离的Fluo-3. Fluo-3/AM的负载用D-Hanks [pH(7.0±1)] 洗涤已制备好的游离平滑肌细胞2次, 加入Fluo-3/AM(10 μmol/L/)在37 ℃避光条件下温育50 min, 用D-Hanks[pH(7.4±1)]洗涤3次, 洗去细胞外残余染料, 保留少许细胞外D-Hanks缓冲液, 平衡10 min. 细胞内Ca2+浓度的测定Fluo-3/AM分别负载的兔食管下括约肌LES及食管体部平滑肌细胞, Fluo-3/AM的负载好的标本在共聚焦显微镜下动态扫描细胞内荧光强度变化, 激发波长506 nm, 发射波长526 nm. [Ca2+]i由下边的公式得出[Ca2+]i = kd·[F-Fmin/(Fmax-F)], kd是Fluo-3与Ca2+反应的解离常数, kd = 400 nm, F为测定所得到的荧光光密度值, Fmax和Fmin分别是Ca2+饱和后和零钙时的荧光光密度值[12]. 在食管体部、LES的平滑肌细胞[Ca2+]i测定后, 向同一份标本中加入ACh(100 mmol/L)作用约1 min后再次测定[Ca2+]i.
统计学处理 数据均采用mean±SD表示, 统计采用t检验方法, 数据分析软件为NOSA软件.
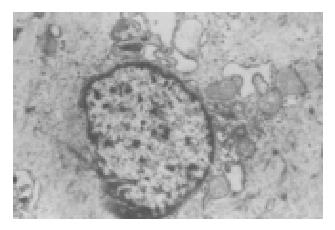
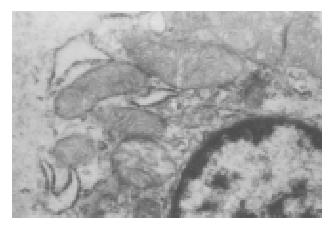
应用苏木素-伊红(HE)染色法可见, LES由外侧纵肌、中间的粗大环肌与内侧黏膜构成. LES的环肌、纵肌完全由平滑肌细胞构成.食管体部主要为纵肌为主, 由横纹肌、平滑肌混合组成, LES食管平滑肌较食管体部平滑肌更加致密(图1, 2). 电子显微镜下可见, 食管体部及LES平滑肌细胞内线粒体结构完整, 嵴结构正常, 胞质内内质网呈管状、囊泡状, 丰富, 胞核内染色质聚集. LES平滑肌细胞周围肌浆网及肌丝明显增加(图3, 4).
兔食管LES平均压力为: 1.4±0.1 kPa(10.5±1.2 mmHg);食管体部平均压力为. 0.6±0.1 kPa (4.6±0.9 mmHg). 兔食管LES压力明显高于食管体部压力(P<0.01)
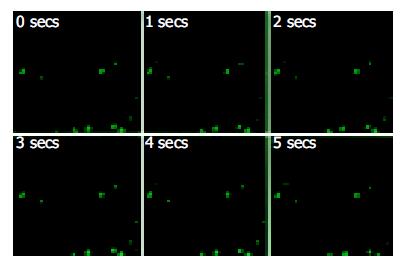
实验中温育平滑肌细胞标本的缓冲液使用不含Ca2+的D-Hanks液. LES平滑肌[Ca2+]i平均为156.1±4.8 nmol/L; 正常兔食管体部平滑肌细胞[Ca2+]i平均为122.6±4.3 nmol/L. 兔食管LES滑肌[Ca2+]i明显高于兔食管体部平滑肌细胞[Ca2+]i (P<0.05, 图5)
在食管体部、LES的平滑肌细胞[Ca2+]i测定后, 向同一份标本中加入ACh(100 mmol/L)作用约1 min后再次测定[Ca2+]i. 加入ACh后LES平滑肌[Ca2+]i平均为241.3±5.7 nmol/L与加入ACh前平滑肌[Ca2+]i有显著差异(P<0.01).; 加入ACh后食管体部平滑肌[Ca2+]i平均为131.6±3.2 nmol/L. 与加入ACh前平滑肌[Ca2+]i无显著差异(P>0.05).
食管功能性障碍性疾病如弥漫性食管痉挛、贲门失驰缓症、胃食管反流病(GERD)等的发病率日益增高, 严重威胁人类生命健康. 对其发生机制的研究, 对未来临床食管功能性疾病及食管癌的研究有重大的意义. 而正常食管体部, LES的平滑肌细胞的收缩机制成为研究的基础. LES是指在食管末端存在一具有括约肌生理特性的高压区, 长约3-4 cm, 解剖学上该处是否有真正的括约肌结构, 仍存在意见分歧[13], 但1995年Stein et al[14]通过细致的解剖发现LES平滑肌增厚, 具有更稀疏的神经分布, 以及不同的电生理特征, 从而确定了LES的解剖学基础. LES环形肌束具有静息张力, 短暂的食管下端括约肌松弛(spontaneous Transient lower esophageal relaxations, TLESRs)[15-16]是其抗返流的基础. 目前对食管下段体部平滑肌细胞功能研究较少, LES与食管体部在结构及功能上差异, 对食管功能障碍性疾病的研究将起到重要的作用. 国内外对此的研究主要集中在食管pH测定, 食管腔内压力测定以及食管黏膜结构改变等方面, 研究较为简单, 未能触及食管平滑肌功能的机制[17-20], 我们利用兔食管平滑肌细胞在细胞水平上对此进行了研究. 哺乳动物食管的肌组织构成, 有着较大的种属差异. 应用电刺激在家兔LES环肌条上可以诱发出舒张及收缩反应, 这些与其他作者在猫、猴及人的LES上观察的结果相一致[21-22], 说明家兔也适于研究食管机能活动.
lES的环肌、纵肌完全由平滑肌细胞构成.食管体部主要为粗大的纵肌, 由横纹肌、平滑肌混合组成, 其平滑肌形态上与LES没有明显的差异. 但是LES食管平滑肌较食管体部平滑肌更加致密, 通过透射电镜, 我们发现LES平滑肌细胞内线粒体较大、肌浆网及肌丝较之食管体部细胞明显增加. 肌浆网与钙离子的贮存、调节有着密切的关系, 提示与食管体部相比, LES可能具有更强的贮存和利用Ca2+ 的能力. 肌丝(作为细胞骨架的一部分)在细胞的收缩舒张运动中起着重要作用[23]. LES平滑肌细胞内这些细胞器的改变可能是其维持静息张力的解剖功能基础.
食管体部静息压随呼吸运动所造成的胸腔压力的改变而变化, LES压力与之相比明显升高, LES的平滑肌细胞与食管体部的没有明显的区别, 表明二者可能具有不同的生理学基础及细胞内不同的兴奋-收缩耦联机制. Ca2+是细胞内最普遍而重要的信号转导成分, 细胞内游离Ca2+的变化引起平滑肌的收缩和舒张. 在平滑肌收缩活动中, Ca2+与钙调节蛋白(calmodulin)结合, 激活肌球蛋白轻链激酶(myosin light chain kinase, MLCK), 导致肌球蛋白轻链(myosin light chain, MLC20)第19位丝氨酸磷酸化, 进而肌球蛋白ATP酶活化, 使平滑肌收缩. Ca2+浓度下降使其脱磷酸化, ATP酶失活, 使平滑肌舒张[24-25]. 因此, 食管平滑肌细胞内Ca2+对食管功能的研究起着重要的作用. 我们发现, LES 静息时细胞内钙离子的浓度要比食管体部明显升高, 这可能决定了LES保持较高的静息张力. 而高浓度的Ca2+的来源值得研究. 细胞内游离钙主要储存于内质网(ER)/肌浆网(SR)中, 其含量主要依赖于细胞外钙离子的内流和/或细胞内质网Ca2+池中的Ca2+释放的平衡来维持[26-27]. LES平滑肌[Ca2+]i在使用ACh作用后有显著的增加(P<0.01). 作为支配食管收缩、舒张的神经递质ACh可以明显的增强食管LES平滑肌的收缩, 我们的结果证实了其收缩功能的增强是与细胞内游离钙的含量增加相关的, 由于实验中温育平滑肌细胞标本的缓冲液使用不含Ca2+的D-Hanks液, 去除了细胞外钙的参与, 提示ACh的收缩作用是通过细胞内钙离子的释放增加而产生的. 这与LES平滑肌细胞内线粒体较大、肌浆网及肌丝明显增加是相符合的. 而食管体部平滑肌细胞[Ca2+]i在使用ACh作用后没有显著的增加(P>0.05), 表明在没有细胞外钙的情况下, Ach不能导致食管体部平滑肌细胞[Ca2+]i的增加, 食管体部平滑肌细胞对ACh等激动剂的应答需要细胞外钙离子的存在. Kim et al[28]通过对食管体部平滑肌束收缩记录的方法, 发现对Ach诱导产生的收缩在有外源钙时正常收缩; 而去除细胞外钙后对Ach诱导的收缩很快停止, 也证实了细胞外钙在食管体部收缩功能中的作用;
总之, 提示正常食管LES与体部平滑肌可能具有不同的生理学基础及不同的细胞内兴奋-收缩耦联机制, 食管体部对Ach诱导产生的收缩需要有细胞外钙的支持, 而LES对Ach的收缩作用是通过细胞内钙离子的释放增加而产生的. 进一步的推论有待更深入的研究来证明.
编辑: 潘伯荣 审读: 张海宁
| 1. | Zhang J, Chen XL, Wang KM, Guo XD, Zuo AL, Gong J. Barrett's esophagus and its correlation with gastroesophageal reflux in Chinese. World J Gastroenterol. 2004;10:1065-1068. [PubMed] |
| 2. | Liu JF, Zhang J, Tian ZQ, Wang QZ, Li BQ, Wang FS, Cao FM, Zhang YF, Li Y, Fan Z. Long-term outcome of esophageal myotomy for achalasia. World J Gastroenterol. 2004;10:287-291. [PubMed] |
| 3. | Mudawi HM, Fedail SS. Familial achalasia in Sudan. Trop Gastroenterol. 2004;25:27. [PubMed] |
| 4. | Kahrilas PJ. Review article: is stringent control of gastric pH useful and practical in GERD? Aliment Pharmacol Ther. 2004;20 Suppl 5:89-94; discussion 95-96. [PubMed] |
| 5. | Sarkar S, Thompson DG, Woolf CJ, Hobson AR, Millane T, Aziz Q. Patients with chest pain and occult gastroesophageal reflux demonstrate visceral pain hypersensitivity which may be partially responsive to acid suppression. Am J Gastroenterol. 2004;99:1998-2006. [PubMed] |
| 6. | Green BT, O'Connor JB. Most GERD symptoms are not due to acid reflux in patients with very low 24-hour acid contact times. Dig Dis Sci. 2004;49:1084-1087. [PubMed] |
| 7. | Triadafilopoulos G. GERD: the potential for endoscopic intervention. Dig Dis. 2004;22:181-188. [PubMed] |
| 8. | Chang JT, Katzka DA. Gastroesophageal reflux disease, Barrett esophagus, and esophageal adenocarcinoma. Arch Intern Med. 2004;164:1482-1488. [PubMed] |
| 9. | He HZ, Song ZM, Wang K, Teng LH, Liu F, Mao YS, Lu N, Zhang SZ, Wu M, Zhao XH. Alterations in expression, proteolysis and intracellular localizations of clusterin in esophageal squamous cell carcinoma. World J Gastroenterol. 2004;10:1387-1391. [PubMed] |
| 10. | Mineo TC, Pompeo E. Long-term outcome of Heller myotomy in achalasic sigmoid esophagus. J Thorac Cardiovasc Surg. 2004;128:402-407. [PubMed] |
| 11. | Cao W, Harnett KM, Behar J, Biancani P. PGF(2alpha)-induced contraction of cat esophageal and lower esophageal sphincter circular smooth muscle. Am J Physiol Gastrointest Liver Physiol. 2002;283:G282-G291. [PubMed] |
| 12. | Ding HG, Wang BE, Jia JD, Xia HX, Wong CY, Zhao CH, Xu YL. Effects of octreotide on expression of L-type voltage-operated calcium channels and on intracellular Ca2+ in activated hepatic stellate cells. Chin Med J (Engl). 2004;117:913-916. [PubMed] |
| 13. | Shafik A, El-Sibai O, Shafik AA, Mostafa R, Shafik I. Effect of straining on the lower esophageal sphincter: identification of the "straining-esophageal reflex" and its role in gastroesophageal competence mechanism. J Invest Surg. 2004;17:191-196. [PubMed] |
| 14. | Stein HJ, Liebermann-Meffert D, DeMeester TR, Siewert JR. Three-dimensional pressure image and muscular structure of the human lower esophageal sphincter. Surgery. 1995;117:692-698. [PubMed] |
| 15. | Davidson G. The role of lower esophageal sphincter function and dysmotility in gastroesophageal reflux in premature infants and in the first year of life. J Pediatr Gastroenterol Nutr. 2003;37 Suppl 1:S17-S22. [PubMed] |
| 16. | Zhang Q, Horowitz M, Rigda R, Rayner C, Worynski A, Holloway RH. Effect of hyperglycemia on triggering of transient lower esophageal sphincter relaxations. Am J Physiol Gastrointest Liver Physiol. 2004;286:G797-G803. [PubMed] [DOI] |
| 17. | Guo RB, Peng LH, Cheng LF, Wang WF. Alteration of esophageal motility in elderly patients with gastroesophageal reflux disease. Shijie Huaren Xiaohua Zazhi. 2004;12:125-128. [DOI] |
| 18. | Sant'Anna AM, Rolland S, Fournet JC, Yazbeck S, Drouin E. Eosinophilic esophagitis in children: symptoms, histology and pH probe results. J Pediatr Gastroenterol Nutr. 2004;39:373-377. [PubMed] |
| 19. | Liu JJ, Carr-Locke DL, Lee LS, Brooks DC, Saltzman JR. Endoluminal gastroplication for treatment of patients with classic gastroesophageal reflux symptoms and borderline 24-h pH studies. Scand J Gastroenterol. 2004;39:615-620. [PubMed] |
| 20. | Han Y, Wang YJ, Liu K. Effect of acid perfusion on length and function of esophagus in rabbits. Shijie Huaren Xiaohua Zazhi. 2001;9:372-375. [DOI] |
| 21. | Poorkhalkali N, Rich HG, Jacobson I, Amaral J, Migliori S, Chrostek C, Biancani P, Cabero JL, Helander HF. Chronic oesophagitis in the cat. Scand J Gastroenterol. 2001;36:904-909. [PubMed] |
| 22. | Cao W, Sohn UD, Bitar KN, Behar J, Biancani P, Harnett KM. MAPK mediates PKC-dependent contraction of cat esophageal and lower esophageal sphincter circular smooth muscle. Am J Physiol Gastrointest Liver Physiol. 2003;285:G86-G95. [PubMed] |
| 23. | Bacchiocchi C, Graceffa P, Lehrer SS. Myosin-induced movement of alphaalpha, alphabeta, and betabeta smooth muscle tropomyosin on actin observed by multisite FRET. Biophys J. 2004;86:2295-2307. [PubMed] |
| 24. | Harnett KM, Biancani P. Calcium-dependent and calcium-independent contractions in smooth muscles. Am J Med. 2003;115 Suppl 3A:24S-30S. [PubMed] |
| 25. | Cao W, Chen Q, Sohn UD, Kim N, Kirber MT, Harnett KM, Behar J, Biancani P. Ca2+-induced contraction of cat esophageal circular smooth muscle cells. Am J Physiol Cell Physiol. 2001;280:C980-C992. [PubMed] |
| 26. | Becker B, Morel N, Vanbellinghen AM, Lebrun P. Blockade of calcium entry in smooth muscle cells by the antidepressant imipramine. Biochem Pharmacol. 2004;68:833-842. [PubMed] |
| 27. | Ma YH, Wei HW, Su KH, Ives HE, Morris RC. Chloride-dependent calcium transients induced by angiotensin II in vascular smooth muscle cells. Am J Physiol Cell Physiol. 2004;286:C112-C118. [PubMed] |
| 28. | Kim N, Cao W, Song IS, Kim CY, Harnett KM, Cheng L, Walsh MP, Biancani P. Distinct kinases are involved in contraction of cat esophageal and lower esophageal sphincter smooth muscles. Am J Physiol Cell Physiol. 2004;287:C384-C394. [PubMed] |