修回日期: 2004-07-09
接受日期: 2004-07-27
在线出版日期: 2004-09-15
目的: 从SARS患者尸检肝、脾、心、肺组织中分离病毒并鉴定及评定中和抗体与SARS病程的关系.
方法: 取各组织100 g/L匀浆后的上清, 接种非洲绿猴肾单层细胞, 观察细胞病变; 采用RT-PCR及序列分析等技术鉴定病毒并研究其生物学特性; 将收集的SARS患者早期和恢复期血清做中和实验.
结果: 分别从SARS患者尸检肝、脾、心、肺等组织中分离到致细胞病变的病毒, 用各组织的病变细胞提取的RNA为模板分别扩增出部分S区和N区的DNA片段, 经DNA序列分析表明所有S区和N区的核苷酸序列均与GenBank上的SARS冠状病毒该区域的序列完全一致, 中和实验显示所做10份SARS患者双份血清均有中和抗体效价的4倍升高, 轻症患者中和抗体产生时间明显早于重症患者.
结论: 从SARS患者尸检肝、脾、心、肺组织中分离到的均为SARS冠状病毒, 证实SARS冠状病毒可直接侵害患者的肝、脾、心、肺脏器. 所有SARS患者均可产生中和抗体, 中和抗体产生时间与疾病进程有一定关系.
引文著录: 朱雷, 胡燕, 沈宏辉, 戚扬, 赵景民, 辛绍杰, 赵敏, 程云, 赵根田, 貌盼勇. SARS患者肝脾心肺组织中病毒的分离和鉴定. 世界华人消化杂志 2004; 12(9): 2256-2258
Revised: July 9, 2004
Accepted: July 27, 2004
Published online: September 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(9): 2256-2258
- URL: https://www.wjgnet.com/1009-3079/full/v12/i9/2256.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i9.2256
严重急性呼吸综合征(severe acute respiratory syndrome, SARS)是一种新的急性呼吸道传染病. 自2002年11月首发于中国广东省之后, 迅速传播到亚洲其他国家及北美、欧洲的几十个国家和地区, 至2003年月全球累计发病8422例, 涉及32个国家和地区, 死亡812例, 死亡率9.6%, 对人类的生命和健康造成了严重的威胁. 2003-04-16世界卫生组织宣布引起SARS的病原为一种新的冠状病毒, 与以往的冠状病毒有较大的区别[1-7]. 病理学研究发现[2], SARS冠状病毒侵害人的多个主要脏器, 并从患者鼻、咽拭子、含漱液、肺、肾等组织中分离到SARS冠状病毒. 为了进一步证实SARS冠状病毒对多器官的侵害, 我们利用Vero细胞对SARS患者肝、脾、心、肺等尸检组织中的病毒进行了分离和鉴定, 同时了解中和抗体与SARS病程的关系, 我们用10份SARS患者双份血清做了中和实验. 现将结果报告如下.
标本来源本院1例SARS死亡患者解剖病例的肝、脾、心、肺等尸检组织, Vero细胞(本室保存), DMEM细胞培养液(Gibco), Viral RNA Mini Kit(Qiaamp), AMV反转录酶(promega).
分别采集肝、脾、心、肺等尸检组织, 加石英砂研磨后用Hanks液制成100 g/L的悬液, 经3 000 r/min离心15 min, 取上清液, 加1 000 ku/L青霉素和链霉素, 除菌后备用. Vero细胞生长液为含100 ml/L新生牛血清的DMEM液, 含100 ku/L青霉素及链霉素, 用75 g/LNaHCO3调整pH至7.0-7.2; 维持液含20 ml/L新生牛血清, 其余同生长液. 标本悬液分别接种已长成单层的5 ml培养瓶, 37 ℃吸附1 h后换维持液, 置50 ml/LCO 2 培养箱35 ℃培养, 每日观察细胞病变, 连续观察7 d, 传代时经-60 ℃和室温冻融2次. RT-PCR按文献[5]发表的SARS冠状病毒基因核苷酸序列设计合成引物, S区正向引物序列为: 5'-gttatggctcgcgctgcgttcct-3', 反向引物序列为: 5'-ttccaagtgcgacgaatggtgact-3', N区正向引物序列为: 5'-cgcggatccatgtctgataatggaccccaa-3', 反向引物序列为: 5'-ccggaattctcatgagtgtttatgcctgag-3'. S区目的PCR产物长200 bp, N区目的PCR产物长1 247 bp. 使用QIAamp 公司的Viral RNA Mini Kit从病变细胞中提取病毒RNA. 逆转录时加20 pmol/L随机引物, 5 ml病毒RNA, 0.5 m AMV反转录酶(promega), 1 X反应缓冲液, 1 ml 10 mmol/LdNTP, 5 u RNA酶抑制剂, 1 ml 0.1 mol/L的DTT, 用水补足20 ml, 反应条件为: 37 ℃ 60 min, 94 ℃灭话5 min. PCR反应条件为: 95 ℃ 2 min热启动, 然后95 ℃30 s, 50 ℃30 s, 72 ℃40 s, 反复40个循环, 最后72 ℃延伸10 min. PCR产物纯化后测序(博奥公司). 将上述分离的病毒用DMEM培养液按10倍递增稀释(10-1-10-8)后, 分别加入含Vero细胞微量培养板中, 每个稀释度加2孔, 同时设细胞对照, 置37 ℃培养, 每日镜检细胞病变, 以确定病毒滴度.将SARS患者双份血清分别进行1:20-1:160稀释度稀释, 然后与100TCID50的SARS冠状病毒作中和, 置37 ℃作用1 h后, 分别滴加到含Vero细胞的96孔微量细胞培养板中, 每孔50 mL, 每个稀释度加4孔. 病毒对照孔滴加25 mL, 并补加25 mL生长液, 同时细胞对照孔补加50 mL生长液.置37 ℃培养, 每日镜检细胞病变, 以3 d细胞病变结果为准, 以能保护50%细胞孔完全不产生细胞病变的最高血清稀释度计算中和效价.
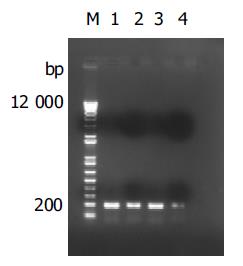
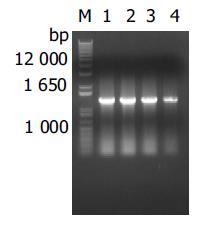
SARS患者尸检心肺标本接种细胞, 在第1代即可分离到病毒, 而肝脾标本接种细胞后第2代方可分离到病毒. 分别以4种组织进行病毒分离的细胞培养上清提取的RNA为模板, 扩增出S区200 bp和N区1 247 bp长度的核苷酸片段(图1, 2). 经序列分析表明, 从所有4份标本所分离病毒中扩增出的S区和N区核苷酸序列都与SARS冠状病毒BJ01株(GenBank的登录号:AY278488)上的该区域的序列完全一致.
从SARS患者尸检肝脾心肺组织中分离的病毒的病毒滴度均为10-5.5 . 用10份SARS患者早期和恢复期血清做中和实验, 5例临床分型[4]较轻患者中, 有4例中和抗体产生时间均在发病后20 d之前, 仅1例在发病后21 d产生中和抗体; 而5例临床分型较重患者, 均在发病20 d之后产生中和抗体, 且有3例在30 d之后产生.
经中和试验和病毒基因序列分析, 证实我们从1例死亡患者的多个组织器官中分离到病毒为SARS冠状病毒, 同时我们采用上述引物直接从该SARS患者肝脾心肺尸检组织进行RT-PCR扩增, 扩增出的核苷酸序列与分离到的SARS冠状病毒完全相同(结果未在本篇中显示), 表明我们分离的病原体确实来自尸检组织, 进一步证实了SARS冠状病毒可以感染和损害患者多个脏器器官, 从而导致患者死亡. 从病毒分离结果看, 病毒对心肺组织侵害要强于肝脾组织, 这一方面可能提示肝脾组织对SARS冠状病毒感染的敏感性弱于心肺组织, 另一方面脾脏是人体最大的外周免疫器官, 其中所富含的免疫细胞和抗体可杀灭部分病毒, 以上两种因素都有可能使该SARS患者肝脾组织中SARS冠状病毒含量低于心肺组织. 以前发现的人类冠状病毒主要是侵犯呼吸道和肠道, 引起上呼吸道感染和腹泻, 且症状多不严重, 极少有累及多个脏器的报道. 此次流行的SARS冠状病毒的嗜性与以往的冠状病毒有较大的差异,对多种脏器均有严重侵害.
中和实验结果显示, 10例SARS患者双份血清均有中和抗体效价的4倍升高, 但SARS患者发病开始8d内无中和抗体产生, 这与采用ELISA等免疫学方法检测SARS患者血清中特异性抗体的结果一致[8], 证明中和实验也不能用于SARS冠状病毒感染的早期诊断, 仅可作为确诊诊断或流行病调查. 中和实验结果还表明, 临床症状较轻的患者大多产生中和抗体时间早于临床症状较重的患者, 且中和效价较高, 提示特异性中和抗体通过抑制病毒的复制, 减缓了疾病的发展和进程. 由于实验中所用标本较少, 二者间确切关系有待进一步深入研究.
| 1. | Poutanen SM, Low DE, Henry B, Finkelstein S, Rose D, Green K, Tellier R, Draker R, Adachi D, Ayers M. Identification of severe acute respiratory syndrome in Canada. N Engl J Med. 2003;348:1995-2005. [PubMed] |
| 2. | 赵 景民, 周 光德, 孙 艳玲, 王 松山, 杨 建法, 毛 远丽, 潘 登, 貌 盼勇, 程 云, 王 业东. 1例地方传染性非典型肺炎病例病理及病原学发现. 解放军医学杂志. 2003;28:379-382. |
| 5. | Marra MA, Jones SJ, Astell CR, Holt RA, Brooks-Wilson A, Butterfield YS, Khattra J, Asano JK, Barber SA, Chan SY. The Genome sequence of the SARS-associated coronavirus. Science. 2003;300:1399-1404. [PubMed] |
| 6. | Ksiazek TG, Erdman D, Goldsmith CS, Zaki SR, Peret T, Emery S, Tong S, Urbani C, Comer JA, Lim W. A novel coronavirus associated with severe acute respiratory syndrome. N Engl J Med. 2003;348:1953-1966. [PubMed] |
| 7. | Drosten C, Günther S, Preiser W, van der Werf S, Brodt HR, Becker S, Rabenau H, Panning M, Kolesnikova L, Fouchier RA. Identification of a novel coronavirus in patients with severe acute respiratory syndrome. N Engl J Med. 2003;348:1967-1976. [PubMed] |