修回日期: 2004-06-05
接受日期: 2004-06-10
在线出版日期: 2004-09-15
目的: 探讨前S2抗原基因对乙型肝炎DNA疫苗免疫应答的影响.
方法: 采用常规PCR法从adr 亚型全基因DNA序列中分别扩增HBV S和前S2+S基因片段, 重组到VR1012载体中, 转染COS-7细胞并免疫BALB/C小鼠. 采用蛋白印迹、ELISA, ELISPOT等方法检测其在COS-7细胞内的表达及小鼠的体液及细胞免疫.
结果: 转染的COS-7细胞表达相应的目的蛋白, 且前S2+S转染的细胞表达明显高于S转染的细胞的表达; 免疫接种小鼠后2 wk产生HBsAb及HBsAg特异性CTL, 前S2+S抗原免疫产生的HBsAb及HBsAg特异性CTL均强于S抗原免疫.
结论: 前S2抗原基因可增强乙型肝炎 DNA疫苗刺激的免疫应答.
引文著录: 赫兢, 辛绍杰, 毛远丽, 貌盼勇, 沈宏辉, 杨健洋, 徐军, 孔维. 前S2抗原基因对乙型肝炎DNA疫苗免疫应答的影响. 世界华人消化杂志 2004; 12(9): 2196-2198
Revised: June 5, 2004
Accepted: June 10, 2004
Published online: September 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(9): 2196-2198
- URL: https://www.wjgnet.com/1009-3079/full/v12/i9/2196.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i9.2196
慢性乙型肝炎严重危害人类健康, 目前尚无特效治疗手段.乙肝慢性化的主要原因是HBV感染机体后缺乏有效的特异性细胞免疫应答[1]. DNA疫苗可同时诱发持久的特异性细胞免疫及体液免疫, 是治疗慢性乙型肝炎(chronic hepatitis B, CHB)的希望之星, 也是近年来传染病研究领域的热点[2-3]. DNA疫苗要作为临床治疗CHB的工具尚需解决许多难题, 主要是证实其安全性及有效性. 我们采用FDA已批准用于临床试验的VR1012载体构建乙型肝炎(hepatitis B, HB) DNA疫苗, 并通过加入前S2抗原基因片段, 观察其在小鼠中对DNA疫苗免疫应答的影响.
1.1.1 载体、质粒和引物: 真核细胞表达载体VR1012, 全长4 913 bp, 含卡那霉素抗性基因, 由于晓方教授惠赠. 人HBV全序列DNA质粒(adr亚型)G683-1由成军教授惠赠. PCR引物由赛百胜公司合成: 含PstⅠ酶切位点的上游引物S2-5(包含前S2): 5'-AAA CTG CAG CAT CCT CAG GCC ATG-3'; S5(不包含前S2): 5'-AAA CTG CAG CCG AAC ATG GAG AAC-3'; 含BamHⅠ酶切位点的共用下游引物S3: 5'-CGC GGA TCC TCA AAT GTA TAC CCA AAG-3'.
1.1.2 菌株、细胞及试剂: 受体菌DH5a(钙化菌)购自博大泰克公司. COS-7细胞由302医院传染病研究所病毒室冷冻保存. 工具酶:PstⅠ, BamHⅠ, Taq酶, T4 DNA连接酶及pGEM-T Easy试剂盒、质粒提取试剂盒、DNA纯化试剂盒均购自Promage公司; 质粒大量提取试剂盒购自QIAGEN公司; 其余生化试剂均购自华美生物制剂公司; 转染试剂sofast购自厦门太阳马生物技术公司; 抗HBsAg mAb、碱性磷酸酶标记的羊抗鼠IgG(蛋白印迹检验用), 检测HBsAg及HBsAb的ELISA试剂盒均为北京科卫试剂厂产品. 包被抗体及检测抗体(ELISPOT用)购自Peprotech Inc公司.
1.1.3 抗原肽: 根据文献报道, 设计合成HBV S抗原3条主要抗原决定簇表位多肽, 分别长9-12个氨基酸, 由吉林大学生命科学院合成并纯化.
1.1.4 实验动物: BALB/C小鼠购自军事医学科学院, ♀, 6-8周龄, 18-25 g, SPF级.
1.2.1 重组质粒的构建及DNA疫苗的制备: 以G683-1质粒为模板, 分别以S2-5, S5, S3为引物, 采用常规PCR法扩增获得目的基因, 即HBV中蛋白及小蛋白编码基因, 将其插入pGEM-T Easy载体后转化感受态DH5a, 扩增后, 提取质粒, 经PstⅠ, BamHⅠ双酶切, 同时双酶切载体VR1012, 将双酶切后获得的片段与载体重组, 构建2个重组质粒, 分别为: VR1012-S, 简称为VR-S; VR1012- 前S2+S, 简称为VR-S2.由博美公司测序后使用大提试剂盒提取质粒, 制备DNA疫苗.
1.2.2 实验分组: 传代COS-7细胞20瓶分4组, 每组5瓶, 分别用VR-S2, VR-S, VR1012空载体转染(阴性对照), 另1组作空白对照.20只BALB/C小鼠随机分为4组, 每组5只, 分别为VR-S及VR-S2免疫组、VR1012空载体免疫组、正常对照组.
1.2.3 真核细胞表达: COS-7细胞复苏, 2次传代后以1010细胞/L的浓度加入细胞培养瓶, 严格按转染试剂说明书操作: 无菌条件下10 mg质粒溶于600 mL无血清及抗生素的DMEM中, 10 mL sofast转染试剂溶于600 mL无血清及抗生素的DMEM中; 将质粒复合物滴加到转染试剂复合物中, 边滴加边混匀; 室温放置20 min后, 将DNA-转染试剂复合物滴加到细胞培养瓶中; 37℃ CO2孵箱中放置48 h后收集细胞, 加PBS 200 mL, 冻融3次后取上清; 使用双抗体夹心法ELISA试剂盒进行HBsAg检测, 并作蛋白印迹检验.
1.2.4 免疫接种: 质粒100 mg溶于100 mL生理盐水, 胫骨前肌im(每条腿50 mL), 于0, 1, 3wk分别注射3次, 每次注射前1 d割尾取血150 mL, 分离血清.首次免疫后28 d采血后处死小鼠, 取脾制单细胞悬液.
1.2.5 小鼠体液免疫检测: 使用双抗原夹心法ELISA试剂盒检测小鼠血清HBsAb, 测A值比较.
1.2.6 小鼠细胞免疫检测: 采用ELISPOT方法: 包被抗体溶于PBS, 10 g/L, 100 mL/孔, 室温过夜; PBST 150 mL洗4次, 50 g/L脱脂奶粉封闭后, PBST 150 mL洗4次; 脾细胞1010/L, 100 mL/孔, 加抗原肽0.2 mg/孔, PMA 0.5 ng/孔作阳性对照, DMEM作阴性对照, 37℃ CO2孵箱放置20 h; PBST 150 mL洗4次, 检测抗体溶于PBS, 5 g/L, 100 mL/孔, 4℃摇床80 r/min过夜; PBST 150 mL洗4次, 碱性磷酸酶标记的羊抗鼠IgG 1:200稀释, 100 mL/孔, 摇床60 r/min室温1 h; PBST 150 mL洗4次、PBS 150 mL洗2次, NBT/BCIP显色15 min; 无菌蒸馏水冲洗终止显色, 室温避光过夜凉干, 显微镜下阳性细胞记数.
统计学处理 试验数据使用state7.0软件进行统计学处理.
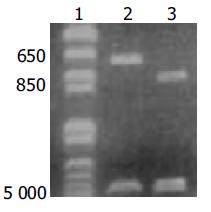
获得2个重组质粒: 引物S2-5位于1 373-1387 bp, S5位于1 544-1 558 bp, S3位于2 213-2 230 bp, 故前S2+S抗原基因片断长度858 bp, S抗原基因片段长度687 bp. 经限制性核酸内切酶PstⅠ, BamHⅠ双切后, 琼脂糖凝胶电泳分析, 酶切片段大小与预期一致(图1). 博亚公司测序后序列与模板序列完全一致.
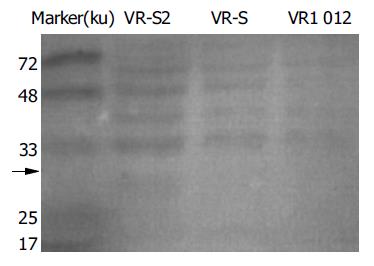
糖基化HBsAg大小为27 ku, 蛋白印迹法检验VR-S2及VR-S转染真核细胞后可见阳性条带, 阴性对照未见阳性条带(图2).
ELISA法检测空白对照、阴性对照、VR-S及VR-S2转染组, A450均值分别为0.045, 0.106, 1.583, 2.981. 对VR-S及VR-S2两组数值进行t检验, P <0.01, VR-S2转染真核细胞表达强度明显高于VR-S.
免疫接种后第2 wk血清可检测到HBsAb, 28 d后ELISA法检测空白对照、阴性对照、VR-S及VR-S2免疫组, A450均值分别为0.013, 0.089, 0.908, 1.879. 对VR-S及VR-S2两组数值进行t检验, P< 0.01, VR-S2免疫小鼠产生抗体明显强于VR-S.
ELISPOT检测小鼠脾单细胞悬液, 显微镜观察空白对照、阴性对照、VR-S及VR-S2免疫组每孔阳性细胞数均值分别为2, 2, 38, 87. 对VR-S及VR-S2两组数值进行t检验, P <0.01, VR-S2免疫小鼠产生HBsAg特异性细胞毒T淋巴细胞(CTL)数明显高于VR-S.
DNA疫苗可以诱导长期的细胞和体液免疫, 打破免疫耐受, 是治疗病毒、胞内菌、某些寄生虫感染及肿瘤[4]的有力工具, 在爱滋病、流感、疟疾等传染病的治疗方面已进行了大量的临床试验并取得了很大进展[5]. 在慢性病毒性肝炎的治疗方面也进行了大量研究[6-9], 但治疗慢性乙肝的DNA疫苗的临床试验罕见报道, 主要是疫苗的安全性及有效性难以证实. 我们采用了已被FDA批准用于临床的, 在国外爱滋病临床试验中已证实了安全性的载体VR1012, 插入HBV S、前S2+S基因片段后, 蛋白印迹法检测转染的真核细胞可见与HBsAg大小相等的蛋白条带, ELISA法检测可见HBsAg阳性表达, 接种小鼠可产生HBsAb及HBsAg特异性CTL, 说明重组质粒在真核细胞内可以表达. 并可作为HB DNA疫苗进行深入研究.
外源DNA引入宿主细胞后, 抗原持续表达, 其中微量抗生素对人体有潜在毒性, 故FDA禁止氨基糖甙类抗生素抗性的载体用于人体试验, 推荐使用卡那霉素或新霉素抗性的表达载体. 但因卡那霉素抗性的载体不含氨基糖甙类抗生素抗性基因中的CpG免疫刺激元件而免疫原性相对较弱. 本研究所用载体为卡那霉素抗性, 虽然可用于临床研究, 但免疫原性相对较弱.有报道不同的载体构建的重组质粒转染真核细胞后表达强度不同[10], 联合使用细胞因子[11-12]也可增强HB DNA疫苗的免疫原性, 为增强本研究所用重组质粒的免疫原性, 我们在连接片段中加入HBV前S2基因. 已证实前S蛋白有很高的免疫原性, 可强化对同存的S蛋白的免疫应答, 而HBV是通过Pre-S2蛋白与单体人血清白蛋白结合, 稳定在血循环中, 逃避抗病毒免疫应答的. Schirmbeck et al[13]曾报道前S2抗原在诱导体液免疫的过程中起主导作用, 依赖CD4+T细胞产生IgG抗体, 同时诱导Ld或Kb限制的CTL反应. 本结果显示, 与VR-S相比, VR-S2转染真核细胞可使HBsAg表达更强, 免疫小鼠可产生更强的HBsAb及HBsAg特异性CTL, 具有更强的免疫原性. 真核细胞表达的增强可能是引起小鼠免疫反应增强的直接原因, 故连接前S2+S基因的HB DNA疫苗的免疫应答增强, 用于临床研究更具优势.蛋白印迹法检测可见VR-S2及VR-S转染真核细胞后表达的蛋白大小相同, 均为27 ku. 理论上VR-S2转染后应表达HBV中蛋白, 大小为33 ku, 但在本试验中未见, 推测有以下原因: VR-S2转染真核细胞后, 表达的HBV中蛋白被细胞蛋白酶水解为前S2抗原及小蛋白, 由于使用抗HBsAg单克隆抗体, 蛋白印迹法不能检出, 但前S2抗原本身增强了细胞的表达; 也可能HBV中蛋白的表达强化了同存的S蛋白的免疫应答, 但中蛋白表达量较少, 蛋白印迹法难以检出; 因为有各自的起始密码子, 乙肝病毒在肝细胞内可以同时表达大、中、小蛋白, 各占20%, 5-10%, 70%, 但HB DNA疫苗为重组质粒, 表达系统与乙肝病毒不同, 前S2-S抗原基因可能是在转录环节上调节小蛋白的表达, 而不表达中蛋白.以上原因仅为推测, 尚待试验证明.
| 1. | Volchkova EV, Pak SG, Malov VA, Umbetova KT. [Changes in the levels of acute phase proteins in viral hepatitis]. Ter Arkh. 2000;72:18-21. [PubMed] |
| 2. | Michel ML, Loirat D. DNA vaccines for prophylactic or therapeutic immunization against hepatitis B. Intervirology. 2001;44:78-87. [PubMed] [DOI] |
| 3. | Schirmbeck R, Reimann J. Revealing the potential of DNA-based vaccination: lessons learned from the hepatitis B virus surface antigen. Biol Chem. 2001;382:543-552. [PubMed] [DOI] |
| 4. | Tian G, Yi JL, Xiong P. Antitumor immunopreventive effect in mice induced by DNA vaccine encoding a fusion protein of alpha-fetoprotein and CTLA4. World J Gastroenterol. 2004;10:200-204. [PubMed] |
| 5. | Tang LL, Liu KZ. Recent advances in DNA vaccine of hepatitis virus. Hepatobiliary Pancreat Dis Int. 2002;1:228-231. [PubMed] |
| 6. | Jin J, Yang JY, Liu J, Kong YY, Wang Y, Li GD. DNA immunization with fusion genes encoding different regions of hepatitis C virus E2 fused to the gene for hepatitis B surface antigen elicits immune responses to both HCV and HBV. World J Gastroenterol. 2002;8:505-510. [PubMed] [DOI] |
| 7. | Beckebaum S, Cicinnati VR, Gerken G. DNA-based immunotherapy: potential for treatment of chronic viral hepatitis? Rev Med Virol. 2002;12:297-319. [PubMed] [DOI] |
| 8. | Huang ZH, Zhuang H, Lu S, Guo RH, Xu GM, Cai J, Zhu WF. Humoral and cellular immunogenecity of DNA vaccine based on hepatitis B core gene in rhesus monkeys. World J Gastroenterol. 2001;7:102-106. [PubMed] [DOI] |
| 9. | Zhao LS, Qin S, Zhou TY, Tang H, Liu L, Lei BJ. DNA-based vaccination induces humoral and cellular immune responses against hepatitis B virus surface antigen in mice without activation of C-myc. World J Gastroenterol. 2000;6:239-243. [PubMed] |
| 10. | Qin S, Tang H, Zhao LS, He F, Lin Y, Liu L, He XM. Cloning of HBsAg-encoded genes in different vectors and their expression in eukaryotic cells. World J Gastroenterol. 2003;9:1111-1113. [PubMed] [DOI] |
| 11. | Du DW, Jia ZS, Li GY, Zhou YY. HBV DNA vaccine with adjuvant cytokines induced specific immune responses against HBV infection. World J Gastroenterol. 2003;9:108-111. [PubMed] |
| 12. | Kwissa M, Kröger A, Hauser H, Reimann J, Schirmbeck R. Cytokine-facilitated priming of CD8+ T cell responses by DNA vaccination. J Mol Med (Berl). 2003;81:91-101. [PubMed] [DOI] |
| 13. | Schirmbeck R, Zheng X, Roggendorf M, Geissler M, Chisari FV, Reimann J, Lu M. Targeting murine immune responses to selected T cell- or antibody-defined determinants of the hepatitis B surface antigen by plasmid DNA vaccines encoding chimeric antigen. J Immunol. 2001;166:1405-1413. [PubMed] [DOI] |