Copyright
©The Author(s) 2004. Published by Baishideng Publishing Group Inc. All rights reserved.
不同来源的人肠上皮细胞内毒素相关受体的表达
张道杰, 蒋建新, 陈永华, 朱佩芳
张道杰, 济南军区总医院实验诊断科 山东省济南市 250031
蒋建新, 陈永华, 朱佩芳, 中国人民解放军第三军医大学大坪医院野战外科研究所第四研究室 重庆市 400042
张道杰, 男, 1969-09-11生, 河南省淮阳县人, 汉族. 1991年第三军医大学本科毕业, 2003年第三军医大学硕士研究生毕业, 主管技师. 主要从事创伤感染发病机制与防治方面的研究.
ORCID number: $[AuthorORCIDs]
基金项目: 国家重点基础研究发展规划资助项目, No. G1999054203; 创伤、烧伤与复合伤研究国家重点实验室开放课题基金资助项目, No. 200311.
电话: 0531-2166314
收稿日期: 2004-05-28
修回日期: 2004-06-09
接受日期: 2004-06-17
在线出版日期: 2004-09-15
目的: 研究人肠上皮细胞内毒素相关受体的表达规律, 探讨其耐受内毒素的分子机制, 为炎症性肠病(IBD)发病机制的阐明拓宽新的视野和思路.
方法: 用核糖核酸酶保护法(RPA)检测原代培养人正常肠上皮细胞(HNIEC)和人小肠上皮细胞株(HIC)内毒素相关受体CD14, Toll样受体4(TLR4)和MD-2 mRNA的表达; 用免疫组化法检测人正常小肠黏膜上皮细胞和结肠黏膜上皮细胞CD14, TLR4和MD-2 蛋白的表达. 以表达TLR4, CD14和MD-2的人单核细胞系THP1细胞作为阳性对照.
结果: HNIEC CD14、TLR4、MD-2mRNA均呈低表达, HIC CD14, TLR4, MD-2 mRNA均无表达. 小肠黏膜上皮细胞和结肠黏膜上皮细胞3种内毒素受体CD14, TLR4, MD-2蛋白均无表达.
结论: 肠上皮细胞表面CD14、TLR4和MD-2呈低表达或不表达可能是其耐受内毒素作用的重要分子机制之一.
关键词: N/A
引文著录: 张道杰, 蒋建新, 陈永华, 朱佩芳. 不同来源的人肠上皮细胞内毒素相关受体的表达. 世界华人消化杂志 2004; 12(9): 2099-2102
Expression of lipopolysaccharide-associated receptors in different human intestinal epithelial cells
Dao-Jie Zhang, Jian-Xin Jiang, Yong-Hua Chen, Pei-Fang Zhu
Dao-Jie Zhang, Department of Medical Laboratory, General Hospital of Jinan Military Region, Jinan 250031, Shandong Province, China
Jian-Xin Jiang, Yong-Hua Chen, Pei-Fang Zhu, Research Institute of Surgery, Daping Hospital, Third Military Medical University, Chongqing 400042, China
Supported by: the National Key Basic Research and Development Plan of China, No. G1999054203; the Opening Foundation of National Laboratory of Trauma, Burns and Combined Injury, No. 200311.
Correspondence to: Jian-Xin Jiang, Research Institute of Surgery, Daping Hospital, Third Military Medical University, Chongqing 400042, China.
Received: May 28, 2004
Revised: June 9, 2004
Accepted: June 17, 2004
Published online: September 15, 2004
AIM: To investigate the expression of lipopolysaccharide (LPS)-associated receptors-CD14, Toll-like receptor 4 (TLR4) and MD-2 in human intestinal epithelial cells (IECs) and to discuss the molecular mechanism by which IECs tolerated to LPS.
METHODS: The expression of CD14, TLR4 and MD-2 mRNA of human normal intestinal epithelial cells (HNIEC) and human intestinal epithelial cell line (HIC) was detected by RNase protection assay (RPA). The expression of CD14, TLR4 and MD-2 proteins on normal human small intestinal and colonic epithelial cells was detected by immunohis-tochemistry, and THP1 cells were used as positive control.
RESULTS: HNIEC expressed very low CD14, TLR4 and MD-2 mRNA and HICs did not express them. Neither normal human small intestinal nor colonic epithelial cells expressed TLR4, CD14 and MD2 proteins.
CONCLUSION: Low or loss of expression of TLR4, CD14 and MD-2 on IECs may be an important molecular mechanism by which IECs tolerate to lipopolysaccharide, and this will be helpful to understand the pathogenesis of inflammatory bowel disease.
Key Words: N/A
0 引言
炎症性肠病(inflammatory bowel disease, IBD)指病因不明的慢性胃肠道非特异性炎症, 包括溃疡性结肠炎和克隆病. 该病不易根除, 是医学界公认的难治性疾病. 近年来, 我国该病患者逐年增多, 由于其病程迁延、诊断治疗困难, 已引起医疗、科研人员的广泛重视[1-4]. 目前, 对该病的研究多见于诊断和治疗方面, 有关病因学的研究相对较少[5]. 由于肠黏膜上皮在IBD发生发展中的重要作用, 故其病因学研究可从肠上皮细胞与肠腔内微生物及其毒素的相互作用入手. 脂多糖(lipopolysaccharide, LPS)即细菌内毒素, 能介导多种细胞炎症递质的释放[6-7]. 正常情况下, 肠上皮细胞(intestinal epithelial cell, IEC)时时刻刻都在接触大量的细菌及其内毒素却不被激活, 其中必然存在相应的耐受机制[8]. 阐明这种机制可为研究IBD的发病机制拓宽新的视野和思路. 近年来的研究发现, LPS相关受体-Toll样受体4(TLR4)、CD14和MD-2[是1999年发现的能与TLR4胞外区结合并能促进TLR4转导LPS信号的蛋白质分子, 因与分布于淋巴细胞表面的髓样分化蛋白-1(myeloid differentiation protein-1, MD-1)在结构和功能上具有明显的相似性, 故被称为MD-2]在LPS跨膜信号转导中具有重要作用[9-12], 那么肠上皮细胞对LPS的耐受是否与其表面TLR4, CD14和MD-2的表达有关? 本课题对此进行了较为系统的研究.
1 材料和方法
1.1 材料
参照Perreault et al[13]报道的方法, 建立人胚胎肠上皮细胞体外培养模型, 通过常规形态观察、超微结构观察及检测特异性的上皮细胞膜抗原来鉴定人正常肠上皮细胞(human normal intestinal epithelial cell, HNIEC)[14]. 人小肠上皮细胞株(human intestinal epithelial cell line, HIC)和人单核细胞系THP1细胞(表达TLR4, CD14和MD-2)购自中国典型培养物保藏中心(武汉). 细胞总RNA提取试剂盒购自美国Promega公司(Cat.#Z5110 RNAgentsR Total RNA Isolation System). TLR4、CD14、MD-2和看家基因L32的模板组由陈永华博士在中科院细胞所(上海)合成, 核糖核酸酶保护法(RNase protection assay , RPA)检测试剂盒由晶美生物技术公司提供. 小肠标本和结肠标本均来自大坪医院普外科手术切除标本, 经外观和病理观察, 选择正常小肠和结肠组织进行研究. 标本取出后, 立即切成约2 cm×1.5 cm×0.3 cm的小块, 置于盛有40 g/L多聚甲醛的容器中, 待进行HE染色和免疫组化检测. 免疫组化检测试剂盒购自北京中山生物技术有限公司(采用第二代LAB-SA技术, 显色系统为DAB法). CD14、TLR4、MD-2单克隆抗体(均为小鼠抗人)分别购自英国Novocastra Laboratories Ltd、英国Serotec公司、美国Imgenex公司.
1.2 方法
1.2.1 RPA检测CD14、TLR4和MD2基因mRNA表达: 肠上皮细胞传代时, 调节细胞密度为1×109/L, 混匀后接种于25 cm2培养瓶内(5 mL/个). 至对数生长期后, 分别提取细胞总RNA. 同时提取人单核细胞系THP1细胞总RNA作为阳性对照. 严格按照RPA试剂盒说明书进行操作如下: 先根据模板组合成探针并用[a-32P]UTP进行标记, 纯化后加入总RNA(加入的总RNA量为4.16 mg), 杂交过夜后, 以RNA酶消化未杂交的单链RNA, 纯化被保护的探针, 测序胶板变性聚丙烯酰胺凝胶高压电泳, 放射自显影.
1.2.2 免疫组化法检测肠黏膜上皮细胞CD14、TLR4和MD2蛋白表达: 组织标本经常规脱水、透明、浸蜡、包埋、切片、脱蜡至水、抗原修复、30 g/L H2O2孵育等程序处理后, 下按免疫组化检测试剂盒说明书进行操作. 以LPS刺激的THP1细胞做阳性对照(THP1细胞以终浓度为1 000 mg/L的LPS刺激24 h后, 收集于离心管内, 离心后均匀涂于经多聚赖氨酸处理的载玻片上, 经40 g/L多聚甲醛固定10 min后, 用30 g/L H2O2孵育, 下与组织标本免疫组化检测步骤相同). 组织切片最后用苏木精复染(把细胞核染成紫蓝色, 使细胞轮廓易于辨认), 培养细胞涂片不复染(因细胞轮廓易于辨认). 阳性结果判断标准: 细胞表面有黄褐色沉淀.
2 结果
2.1 HNIEC和HIC CD14、TLR4、MD-2mRNA表达
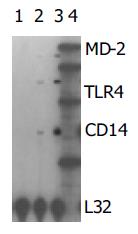
与THP1细胞相比, RPA法检测HNIEC CD14, TLR4, MD-2mRNA均呈低表达; HIC CD14, TLR4, MD-2mRNA均不表达(图1).
图1 NIEC和HIC CD14、TLR4、MD-2mRNA表达结果.
1: HIC; 2: HNIEC; 3: THP1细胞; 4: 探针.
2.2 肠黏膜上皮细胞3种内毒素受体的表达
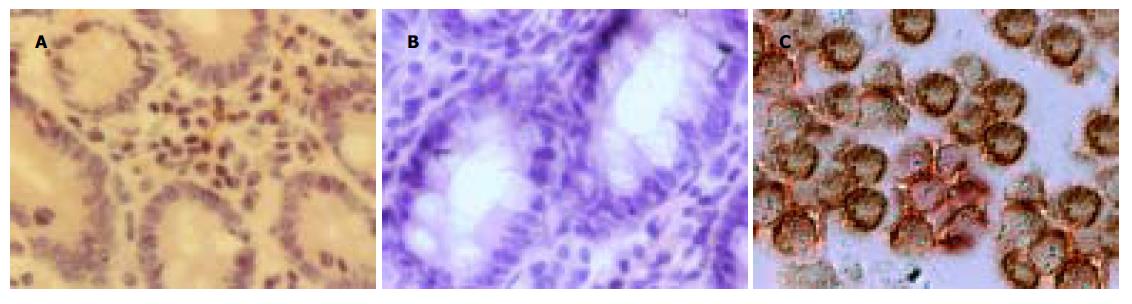
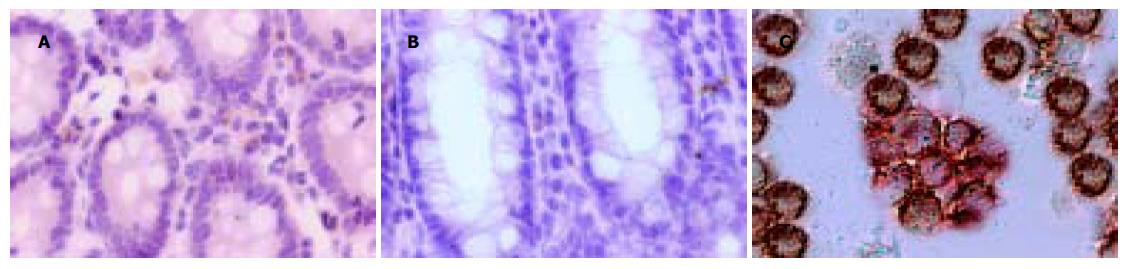
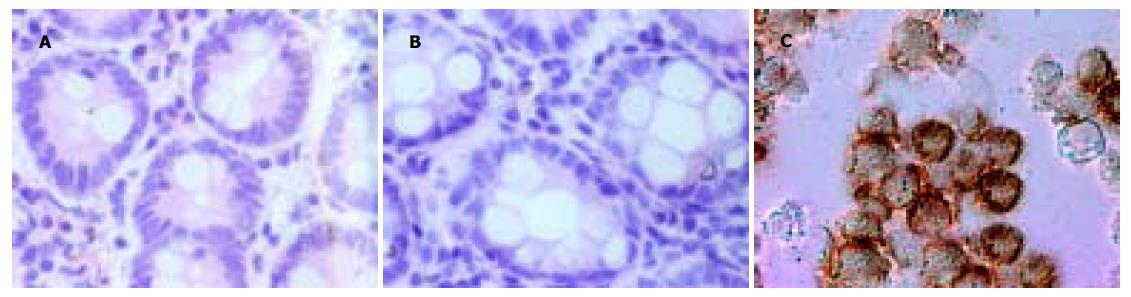
免疫组化结果显示小肠黏膜上皮细胞和结肠黏膜上皮细胞3种内毒素受体CD14、TLR4、MD-2均无表达(图2A, B; 图3A, B; 图4A, B). 而阳性对照THP1细胞3种内毒素受体均有明显表达(图2C, 图3C, 图4C).
图2 肠上皮细胞CD14表达×600.
A: 小肠黏膜; B: 结肠黏膜; C: THP1细胞.
图3 肠上皮细胞TLR4表达×600.
A: 小肠黏膜; B: 结肠黏膜; C: THP1细胞.
图4 肠上皮细胞MD-2表达×600.
A: 小肠黏膜; B: 结肠黏膜; C: THP1细胞.
3 讨论
IBD发病机制尚不清楚, 主要观点有: 白细胞、内皮细胞、细胞因子及一氧化氮在肠黏膜中的相互作用; 免疫细胞与肠黏膜上皮细胞的相互作用; 肠黏膜免疫机制紊乱; 免疫缺陷及自身免疫异常等[15]. 由于IBD的病理生理特征是无明确病原菌存在的失控性的慢性肠黏膜炎症反应[16], 而正常肠黏膜上皮细胞处于肠腔内毒素与黏膜免疫系统之间的关键部位, 持续接受内毒素的刺激却不发生炎症反应, 故阐明肠黏膜上皮细胞耐受内毒素的作用机制对探讨IBD发病机制具有重要意义. 鉴于LPS相关受体CD14, TLR4和MD-2在LPS跨膜信号转导中的重要作用, 因此我们从mRNA和蛋白质水平较为系统地研究了正常肠上皮细胞上述受体的表达规律.首先, 采用RPA法研究了HNIEC和HIC 3种LPS相关受体mRNA表达情况. RPA法又称为液相杂交法[17], 其基本原理是先根据模板组合成RNA探针并进行放射性标记, 再与提取的总RNA杂交, RNA酶可消化未杂交的单链RNA, 但不能消化杂交后的双链RNA, 因而目的基因得以保护. 检测有放射性标记的RNA:RNA杂交体的长度和浓度, 就可以对待测的mRNA进行定性和定量的分析. 与其他检测mRNA水平的方法相比, RPA法具有灵敏度高、特异性强、稳定及重复性高和信息含量丰富等优点[18-20], 可以同时检测同一标本中一组有相关功能的几个基因, 故用本方法检测mRNA表达准确可靠, 便于定量比较. 本结果表明, HNIEC CD14, TLR4和MD2 mRNA均呈弱表达, HIC CD14, TLR4和MD-2 mRNA均不表达. 用RPA法检测肠上皮细胞CD14, TLR4和MD-2 mRNA表达目前国内外尚未见文献报道. 为全面揭示肠黏膜上皮细胞LPS相关受体的表达规律, 我们又采用免疫组化方法检测了人正常小肠黏膜和结肠黏膜上皮细胞CD14, TLR4和MD-2蛋白质表达情况, 结果表明不管是小肠黏膜上皮细胞, 还是结肠黏膜上皮细胞CD14, TLR4和MD-2均不表达. 因此, 本研究结果提示: 肠上皮细胞内毒素相关受体CD14、TLR4和MD-2呈低表达或不表达. 国外学者用结肠癌细胞株作为研究对象得到的结果与本研究结果有一定的相似性. 如Funda et al[21]的研究表明, 不管是采用RT-PCR还是Western blotting, 人肠上皮细胞系SW-480、HT-29、Caco2 mCD14(膜型CD14)均有低水平表达, 而Cario et al[22]在HT-29、T84细胞中均未检测到CD14 mRNA表达. Abreu et al[23]的研究表明, 与对LPS有反应的人血管内皮细胞相比, T84、HT-29、Caco2 TLR4 mRNA表达极低, 用免疫荧光染色也表明, T84细胞只有低水平的TLR4染色. T84、HT-29、Caco2三种细胞系均无MD-2 mRNA表达. 但他们均没有同时研究三种受体的表达情况, 而本研究首次同时揭示了原代培养人正常肠上皮细胞、人肠上皮细胞株及肠黏膜上皮细胞内毒素信号转导相关受体TLR4, CD14和MD-2的表达情况. 因LPS诱导的效应细胞的激活是由CD14, TLR4, MD-2等LPS受体及其辅助分子介导的[24], 故可认为肠上皮细胞耐受LPS的重要机制之一是其表面CD14, TLR4和MD-2呈低表达或不表达.
相关基因转染实验表明:共转染cTLR4和cMD2后, IEC易被LPS激活[23], 且临床研究也表明IBD患者肠黏膜TLR4异常表达[25], 故可推测肠上皮细胞表面LPS相关受体由于遗传因素或环境因素的不同而发生异常表达, 致使其对LPS不再耐受, 通过LPS信号转导通路[26-27], 激活NF-kB, AP-1等炎症相关转录因子[28-29], 导致TNF-α、IL-8等炎症递质异常表达[30-31], 进而引起肠黏膜炎症反应, 致使IBD的发生. 综上所述, 我们不但初步阐明了肠上皮细胞耐受LPS的分子机制, 而且为进一步阐明IBD的发病机制奠定了基础, 同时为IBD的防治研究也找到了有关的理论依据.