修回日期: 2004-07-09
接受日期: 2004-07-11
在线出版日期: 2004-09-15
目的: 制备抗人HAb18G/CD147胞外区蛋白(HAb18Ged)的单抗HAb18Gedomab1, 并对其理化性质和生物学功能进行分析鉴定.
方法: 以HAb18Ged免疫Balb/c小鼠, 通过杂交瘤技术, 融合并筛选分泌抗人HAb18Ged蛋白单抗的杂交瘤细胞株, 制备腹水, 采用离子交换层析法纯化该抗体. 采用流式细胞术、免疫组化等方法对其特异性进行鉴定, 并通过明胶酶谱、I型胶原酶谱、重组基底膜降解实验研究该抗体的体外生物学功能.
结果: 获得一株稳定分泌抗人HAb18G/CD147胞外区蛋白单抗的杂交瘤细胞株HAb18Gedomab1, 滴度为: 1:106, 纯化后HAb18Gedomab1单抗的纯度大于90%, 抗体亚型属IgG1型. 流式细胞术及免疫组化结果证明, 该抗体与FHCC-98细胞膜抗原及肝癌组织均呈特异性结合. 生物学功能研究表明, HAb18Gedomab1可刺激鼠成纤维细胞(3T3)分泌明胶酶MMP-2, MMP-9及胶原酶MMP-1, MMP-8, 并具有促进基底膜降解的作用.
结论: HAb18Gedomab1单抗可特异识别HAb18Ged, 刺激MMPs分泌, 促进基底膜降解.
引文著录: 叶卉, 陈志南, 米力, 商澎, 骞爱荣, 蒋建利, 汪莉, 谢丽, 张敏. HAb18Gedomab1单抗的制备及功能研究. 世界华人消化杂志 2004; 12(9): 2061-2065
Revised: July 9, 2004
Accepted: July 11, 2004
Published online: September 15, 2004
AIM: To obtain mouse anti-human monoclonal antibodies against recombinant extracellular domain of HAb18G (HAb18Ged), and to analyze and identify its character and biological function.
METHODS: Balb/c mice were immunized with HAb18Ged. Hybridoma cell was screened by cell fusion and subcloning approach. The monoclonal antibody in the ascites was purified by ion exchange chromatography and was identified by fluorescence-activated cell sorting analysis (FACs) and immunohistochemistry. Gelatin zymography and collagenase type I zymography were used to analyze the effects of HAb18Gedomab1 on activation and production of matrix metalloproteinase (MMPs); Matrigel-boyden degradation chamber method was used to evaluate the infiltrative cells ratio.
RESULTS: A hybridoma cell HAb18Gedomab1 stably secreting anti-HAb18Ged monoclonal antibody was obtained. The titer of this McAb in ascites was 1:106. The purity of the McAb was higher than 90%. The McAb belonged to IgG1 subclass. HAb18Gedomab1 showed high specificity and affinity to the antigen of FHCC-98 cell membrane and the tissue of hepatocellular carcinoma. The McAb induced production and activation of MMP-2, MMP-9, MMP-1 and MMP-8 in mouse fibroblast cells (3T3), and also promoted the degradation of reconstituted basement membrane.
CONCLUSION: HAb18Gedomab1 can bind specifically to HAb18Ged protein. The McAb can also induce production and activation of MMPs and promote the degradation of reconstituted basement membrane.
- Citation: Ye H, Chen ZN, Mi L, Shang P, Qian AR, Jiang JL, Wang L, Xie L, Zhang M. Preparation and functional characterization of the monoclonal antibody HAb18Gedomab1. Shijie Huaren Xiaohua Zazhi 2004; 12(9): 2061-2065
- URL: https://www.wjgnet.com/1009-3079/full/v12/i9/2061.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i9.2061
肝癌相关抗原HAb18G是一种高度糖基化的膜蛋白分子. 应用我室自己制备的抗人肝癌mAbHAb18, 从人肝癌cDNA文库中筛选得到了其cDNA序列, 查询Genbank证实其与CD147分子cDNA序列开放阅读框完全一致, 与基质金属蛋白酶诱导剂EMMPRIN(extrcellular matrix metalloproteinase inducer), Basigin等为同一类分子[1-2]. 功能研究表明, HAbl8G/CD147可刺激人成纤维细胞分泌基质金属蛋白酶(matrix metalloproteinases, MMPs), 降解基底膜和细胞间质[3-5]. HAb18G/CD147胞外区是HAbl8G/CD147的主要功能区. 我们以HAb18G/CD147胞外区蛋白(HAb18Ged)为免疫原, 通过杂交瘤技术, 融合筛选获得一株特异性杂交瘤细胞株, 并对其分泌的抗HAb18G/CD147胞外区蛋白抗体进行生物学功能鉴定. 初步功能研究表明, 所获得的单抗HAb18Gedomab1可刺激鼠成纤维细胞(3T3)分泌MMPs, 并且具有促进重组基底膜降解的作用, 为进一步探讨其体内外生物学功能奠定了基础.
Balb/c小鼠购自第四军医大学动物中心; 人肝癌细胞系FHCC-98[6], 骨髓瘤细胞系SP2/0, 鼠成纤维细胞3T3均购自上海中科院细胞库; 福氏佐剂为Gibco公司产品; 聚乙二醇PEG (MWl000), I型胶原和鼠mAb亚型鉴定试剂盒ImmunoTypeTMKit均购自Sigma公司; 小牛血清购自杭州四季青生物技术公司; RPMI-1640培养基为Hyclone公司产品; 即用型超敏SP免疫组化试剂盒及DAB显色剂购自福建迈新生物技术开发公司; SP Sepharose FF购自Amersham公司; 人工重组基底膜 Matrigel购自BD Biosciences公司; 明胶、Triton X-100购自华美生物技术公司; 24孔、96孔培养板购自丹麦Nunc公司; Millicell chamber购自美国Millipore 公司; 垂直电泳槽和电泳仪为美国Bio-Rad公司产品.
1.2.1 单克隆抗体HAb18Gedomab1的制备[7-8]: 以HAb18Ged为免疫原, 对8-10 wk重18 g左右♀Balb/c小鼠进行皮下常规免疫, 抗原用量100 mg/只, 每隔2 wk腹腔加强免疫. 融合前3 d检测小鼠血清多抗的效价, 效价高者尾静脉再追加免疫1次, 剂量同上. 3 d后收集免疫小鼠脾细胞与SP2/0细胞以5:1的比例在PEG-1000作用下融合, HAT培养液选择培养. 10-15 d后取上清进行ELISA筛选阳性克隆, 将筛选的阳性克隆HAb18Gedomab1杂交瘤作有限稀释, 进行3次亚克隆. 大量扩增并液氮冻存该杂交瘤细胞, 并进行杂交瘤细胞的染色体核型分析. 将杂交瘤细胞HAb18Gedomab1以1×106个ip接种于Balb/c小鼠, 10-14 d后收集腹水. 取杂交瘤细胞HAb18Gedomab1培养上清和小鼠腹水做倍比稀释, 以HAb18Ged为检测抗原, 间接ELISA法测定抗体效价, 并以SP2/0细胞培养上清为阴性对照. 按Sigma ImmunoTypeTMKit说明进行单抗免疫球蛋白亚型鉴定. 单抗HAb18Gedomab1的纯化鉴定 (1)离子交换层析. 取HAb18Gedomab1腹水加入等体积0.01 mol/L PBS混匀, 于冰浴中进行500 g/L饱和硫酸铵盐析, 4 ℃静置过夜.采用FPLC系统SP Sepharose FF离子交换层析对HAb18Gedomab1腹水的粗提物进行纯化. 洗脱A液: 0.02 mol/L柠檬酸缓冲液(pH5.4), B液: 0.02 mol/L柠檬酸缓冲液, 1 mol/L氯化钠(pH5.4), 流速1 mL/min. (2) 鉴定. 采用ELISA法和非还原聚丙烯酰胺凝胶电泳, 浓缩胶、分离胶浓度分别为50 g/L和100 g/L, 电泳缓冲液为pH 8.3的Tris-甘氨酸缓冲液. 单抗相对亲和力的测定[9]采用间接ELISA法, 比较HAb18Gedomab1与mAbHAb18的相对亲和力. 以5 mg/L的HAb18Ged包被聚苯乙烯板, 用50 g/L脱脂奶粉封闭40 min; 将HAb18Gedomab1的起始浓度调整为160 mg/L, 然后进行4倍倍比稀释, 以100 mL/孔加入聚苯乙烯板, 室温放置1 h; 加入1:100 000稀释度的HRP标记羊抗鼠IgG抗体, 室温放置40 min, 洗涤后加入底物(OPD)溶液显色15 min, 用2 mol/L H2SO4终止反应, 测各孔A450nm值并绘出各mAb的测定曲线, 比较相对亲和力. 按达到50%最大结合的单抗浓度分析相对亲和力, 亲和力越大, 所需抗体浓度越低. 以间接免疫荧光法进行流式细胞术(FACs), 分析单抗HAb18Gedomab1与FHCC-98细胞膜抗原的结合情况.将20 mg待检抗体加入5×105个FHCC-98细胞, 结果以细胞发射荧光的百分率表示. 阳性对照为HAb18腹水, 阴性对照为SP2/0细胞培养上清, 空白对照为0.01 mol/L PBS. 采用链霉菌抗生物素蛋白-过氧化酶免疫组化法(SP法), 检测单抗HAb18Gedomab1与肝癌组织的结合情况. 将肝癌组织标本制成5 mm的连续切片, 经常规二甲苯脱蜡、梯度酒精脱苯和水化后, 加入30 mL/L过氧化氢液20 min. 正常羊血清封闭20 min后, 滴加浓度为2 mg/L的HAb18Gedomab1, 室温2 h. PBS液冲洗3次后, 依次加入生物素标记的二抗及HRP, 各孵育20 min. 新鲜配制的DAB溶液(1:50)显色5-10 min, 然后依次进行苏木素复染、脱水、透明、封片及光镜下观察结果. 阳性对照为HAb18, 阴性对照为SP2/0细胞培养上清. 阳性结果评定标准: 阳性染色位于胞膜和胞质, 呈棕黄色深棕色. 阳性染色的肿瘤细胞少于30%同类病变细胞为阴性(-), 大于30%为阳性(+), 大于70%为强阳性(++).
1.2.2 单抗HAb18Gedomab1的体外生物学功能: 改良的明胶酶谱实验[10-12]. 鼠成纤维细胞(3T3)和人肝癌细胞(FHCC-98)分别培养至对数生长期, 以1105/孔的细胞密度接种于96孔板中培养24 h. 弃培养上清, 加300 mL无血清培养液, 同时加入终浓度为100 mg/L的HAb18Gedomab1, 并设空白对照孔. 分别在10 h及20 h收集无血清培养上清, 离心4 ℃备用. 配制 8 g/L分离胶和5 g/L浓缩胶, 分离胶中加入终浓度为1 g/L明胶溶液. 取样品与1:2的样品缓冲液混匀, 每孔上样100 mL. 泳动电压为: 浓缩胶8 V/cm, 分离胶10 V/cm. 电泳结束后将凝胶移入25 g/L Triton X-100溶液中复性, 然后将凝胶至于明胶酶孵育缓冲(50 mmol/L Tris, 10 mmol/L CaCl2, 200 mmol/L NaCl pH 7.5)中孵育12-16 h. 染色、脱色至对照出现明显、清晰的负染酶带, 观察并拍照. I型胶原酶谱实验方法同改良的明胶酶谱实验, 仅改变反应底物为I型胶原, 使其终浓度为1 g/L. 重组基底膜降解实验[13]. 将滤膜正常完整的Millicell小室放入24孔板中, 在内膜上铺Matrigel胶80 mL, 待胶干. 用含1 g/L BSA的RPMI1640悬起FHCC-98和3T3细胞, 以1:1(各150 mL)加入上室, 同时加入终浓度为100 mg/L的单抗HAb18Gedomab1. 在小室的下室24孔板内加入500 mL趋化剂(3T3 无血清培养上清). 将24孔板放入37℃, 50 mL/L CO2孵箱中培养20 h. 取出小室弃去培养液, 950 mL/L乙醇固定25 min, 进行HE染色及梯度酒精脱水, 然后擦去上室中的Matrigel胶及细胞, 依次切膜、透明、封片. 光镜下计穿膜细胞数, 随机计数4个视野, 求其均值, 计数重复3次. 穿膜细胞率(‰)=穿膜细胞数/上室培养细胞数.
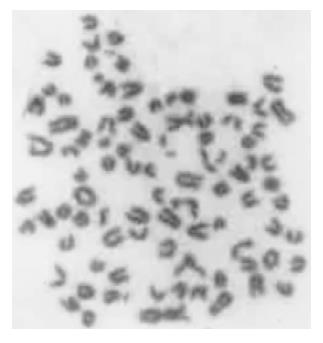
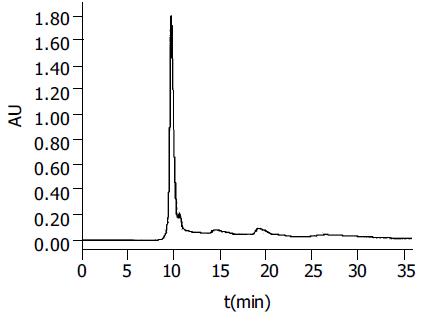
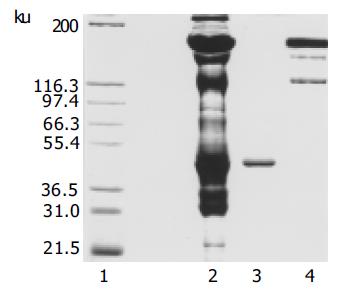
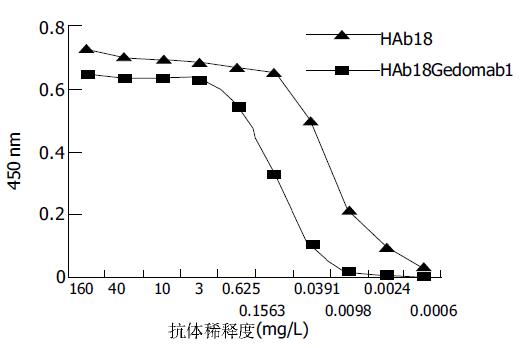
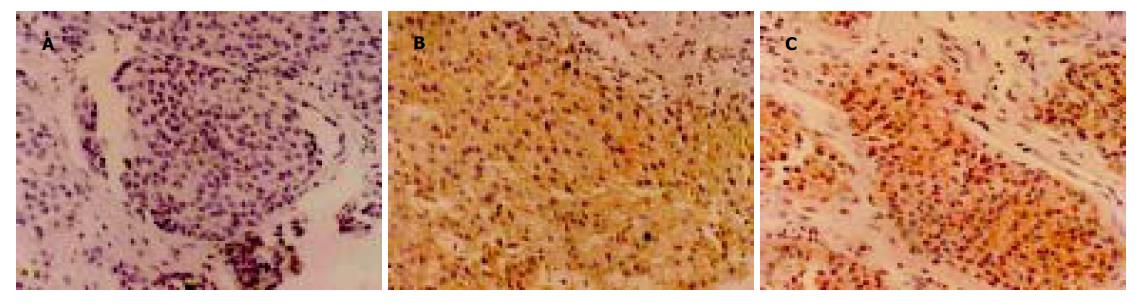
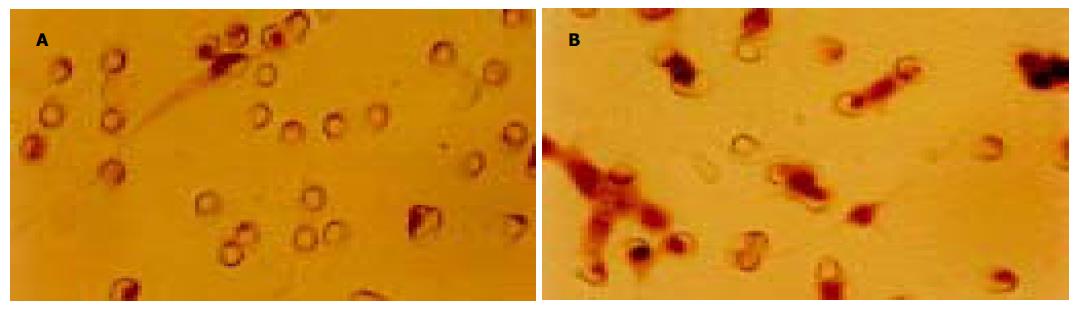
经多轮筛选获得针对HAb18G/CD147胞外区蛋白特异性较强的杂交瘤细胞株HAb18Gedomab1, 经连续3 mo传代培养, 仍能稳定分泌抗体. 杂交瘤细胞株HAb18Gedomab1的染色体鉴定结果: 染色体在58-126间, 众数104-126, 有标记染色体1-2条(图1). 将杂交瘤细胞HAb18Gedomab1扩大培养后对Balb/c小鼠进行腹腔注射, 小鼠腹水产量为2-3 mL/只. 用间接ELISA法测杂交瘤细胞HAb18Gedomab1培养上清的抗体滴度为1: 104; HAb18Gedomab1腹水的抗体滴度为为1: 106.用Sigma ImmunoTypeTMKit检测HAb18Gedomab1属IgG1型. FPLC系统SP Sepharose FF离子交换层析纯化单抗HAb18Gedomab1洗脱曲线(图2), 共出现3个蛋白吸收峰, 目标抗体峰为第1个峰, 即为单抗HAb18Gedomab1. ELISA法检测各峰A450nm, 非还原SDS-PAGE结果(图3), 纯度≥90%. 通过间接ELISA法比较单抗HAb18Gedomab1与HAb18的相对亲和力, 结果为HAb18> HAb18Gedomab1(图4). 各待检样品的细胞发射荧光的百分率分别为: SP2/0培养上清(阴性对照): 0.24%; PBS(空白对照): 0.30%; HAb18腹水(阳性对照): 97.54%; HAb18Gedomab1腹水: 97.84%; HAb18Gedomab1培养上清: 95.14%. 免疫组织化学方法检测PBS(阴性对照)(-), 胞膜、胞质无着色; HAb18(阳性对照)(++)>70%, 胞膜和胞质呈棕黄色, 胞核呈紫色; HAb18Gedomab1(++)>70%, 胞膜和胞质呈棕黄色, 胞核呈紫色(图5).
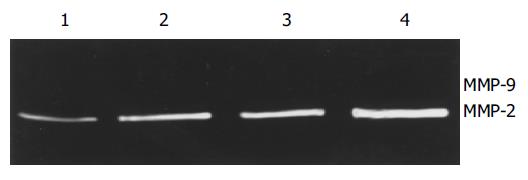
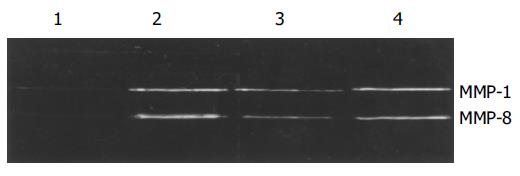
HAb18Gedomab1与FHCC-98细胞及3T3细胞共培养20 h动态明胶酶谱结果显示, HAb18Gedomab1可刺激MMP-2产生. 给药组各时间点MMP-2的含量均高于对照组各时间点, 随着时间的延长, MMP-2的量也在逐渐增加. 作用20 h后HAb18Gedomab1可刺激MMP-9的产生(图6). I型胶原酶谱结果显示, HAb18Gedomab1可刺激MMP-1, MMP-8的产生(图7). FHCC-98细胞与3T3细胞共培养, 给药组穿膜细胞数明显多于对照组穿膜细胞数, 促进 FHCC-98细胞对重组基底膜的降解. HAb18Gedomab1组穿膜细胞数为: 964±194, 穿膜细胞率为: 9.64‰, (P <0.05); 阴性对照组穿膜细胞数为: 208±83, 穿膜细胞率为: 2.08‰, (P <0.05)(图8).
酶谱实验表明, HAbl8G/CD147/Emmprin可刺激人成纤维细胞分泌MMP-l, MMP-2, MMP-3三种蛋白酶, 降解基底膜和细胞间质[3-5,14]. 此外, HAbl8G/CD147还是一个潜在的黏附分子, 其可通过与intergrin家族a3b1, a6b1形成蛋白复合物, 进而参与细胞与细胞、细胞与基质的黏附. 上述功能的发挥, 很大程度上依赖于其胞外区片段的表达及糖基化修饰作用[15-16]. 故我们所用的免疫原为在大肠杆菌中非融合表达的HAb18Ged. HAb18G/CD147在纤维化组织中高表达, 尤以肝纤维化组织表达最为显著, 其定位于肝细胞和肝脏纤维化基质中增生的胆管上皮细胞, 在HCV, AIH(自身免疫性肝炎), HBV, PBC(原发性胆汁性肝硬化)引起的肝纤维化病变中HAb18G/CD147/EMMPRIN均高表达. 这一特点显示出该分子在肝纤维化的病变进程中扮演了重要的角色, 其可能与刺激肝实质细胞、肝星状细胞分泌MMPs有关[17].
肝纤维化是各种致病因子持续作用于肝脏, 导致细胞外基质(extracellular matrix, ECM), 尤其是Ⅰ, Ⅲ, Ⅳ型胶原过度增生沉积和降解减少造成的病理性结果[18-28]. Ⅳ型胶原产物增加是肝纤维化的早期表现, 随疾病之进展转为I型胶原沉积为主. MMPs是一族参与降解各型胶原、蛋白聚糖等ECM成分的主要蛋白水解酶, 肝内发现了8种. 其在损伤肝组织重建、修复以及纤维化中均发挥着重要的作用. 将 MMPs按作用底物的不同, 可分为5大类: 其中胶原酶(MMP-l, MMP-8, MMP-13), 降解Ⅰ, Ⅱ, Ⅲ型等多种类型间质胶原和蛋白多糖核心蛋白; 明胶酶 (MMP-2, MMP-9), 降解明胶和Ⅳ, Ⅴ, Ⅶ, Ⅹ型基底膜胶原. 因此, 这两种MMPs直接参与调节ECM合成与降解的动态平衡, 与肝纤维化发生、发展及形成密切相关. 许多学者发现, 肝纤维化或肝硬化时, 肝组织内MMP-l活力下降, 甚至难以测出, 致使纤维化肝组织中基质降解不平衡, 间质胶原降解减少(尤其是Ⅰ型胶原), 造成这些胶原沉积. 而在肝纤维化的恢复期, 以纤维状基质的降解和正常肝组织的恢复为特征. 因此, 人类发生的肝纤维化是可以逆转的[29].
我们以肝纤维化组织中高表达的HAb18G/CD147胞外区蛋白为免疫原, 采用杂交瘤技术, 制备出特异性单抗HAb18Gedomab1, 并对其特异性进行鉴定. 生物学功能研究表明, HAb18Gedomab1可促进明胶酶MMP-2, MMP-9及Ⅰ型胶原酶MMP-1, MMP-8的产生; 重组基底膜降解实验提示, HAb18Gedomab1可促进FHCC-98细胞穿越重组基底膜, 即通过降解重组基底膜而实现, 其结果与酶谱结果一致. 因此提示HAb18Gedomab1具有影响Ⅰ, Ⅳ类胶原酶分泌及活化的作用, 从而为逆转肝纤维化等基质沉积相关疾病的实验研究及临床应用提供新的思路.
| 1. | Lou C, Chen ZN, Bian HJ, Li J, Zhou SB. Pharmacokinetics of radioimmunotherapeutic agent of direct labeling mAb 188Re-HAb18. World J Gastroenterol. 2002;8:69-73. [PubMed] [DOI] |
| 2. | Yang LJ, Sui YF, Chen ZN. Preparation and activity of conjugate of monoclonal antibody HAb18 against hepatoma F(ab')(2) fragment and staphylococcal enterotoxin A. World J Gastroenterol. 2001;7:216-221. [PubMed] [DOI] |
| 3. | Kanekura T, Chen X, Kanzaki T. Basigin (CD147) is expressed on melanoma cells and induces tumor cell invasion by stimulating production of matrix metalloproteinases by fibroblasts. Int J Cancer. 2002;99:520-528. [PubMed] [DOI] |
| 6. | Lou CY, Feng YM, Qian AR, Li Y, Tang H, Shang P, Chen ZN. Establishment and characterization of human hepatocellular carcinoma cell line FHCC-98. World J Gastroenterol. 2004;10:1462-1465. [PubMed] [DOI] |
| 7. | Xia HC, Hu WG, Yang XX, Li F, Zhang ZC. Preparation and primary application of monoclonal antibodies against a novel ribosome-inactivating protein Moschatin from pumpkin seeds. Acta Biochim Biophys Sin (Shanghai). 2004;36:105-110. [PubMed] [DOI] |
| 8. | Yang LJ, Wang WL. Preparation of monoclonal antibody against apoptosis-associated antigens of hepatoma cells by subtractive immunization. World J Gastroenterol. 2002;8:808-814. [PubMed] [DOI] |
| 9. | 骞 爱荣, 商 澎, 李 郁, 樊 春梅, 陈 丹, 王 春梅, 朱 平, 陈 志南. HAb18G/CD147拮抗肽对肝癌细胞表面抗原HAb18G的亲和性. 细胞与分子免疫学杂志. 2003;19:127-129. |
| 10. | Staun-Ram E, Goldman S, Gabarin D, Shalev E. Expression and importance of matrix metalloproteinase 2 and 9 (MMP-2 and -9) in human trophoblast invasion. Reprod Biol Endocrinol. 2004;2:59. [PubMed] [DOI] |
| 12. | Munshi HG, Stack MS. Analysis of matrix degradation. Methods Cell Biol. 2002;69:195-205. [PubMed] [DOI] |
| 13. | 骞 爱荣, 商 澎, 李 郁, 黄 宝成, 朱 平, 梅 其炳, 陈 志南. HAbl8G/CDl47拮抗肽抗肝癌转移作用的体外实验. 世界华人消化杂志. 2003;11:255-259. [DOI] |
| 14. | Tang W, Hemler ME. Caveolin-1 regulates matrix metalloproteinases-1 induction and CD147/EMMPRIN cell surface clustering. J Biol Chem. 2004;279:11112-11118. [PubMed] [DOI] |
| 17. | Shackel NA, McGuinness PH, Abbott CA, Gorrell MD, McCaughan GW. Insights into the pathobiology of hepatitis C virus-associated cirrhosis: analysis of intrahepatic differential gene expression. Am J Pathol. 2002;160:641-654. [PubMed] [DOI] |
| 18. | Stickel F, Urbaschek R, Schuppan D, Poeschl G, Oesterling C, Conradt C, McCuskey RS, Simanowski UA, Seitz HK. Serum collagen type VI and XIV and hyaluronic acid as early indicators for altered connective tissue turnover in alcoholic liver disease. Dig Dis Sci. 2001;46:2025-2032. [PubMed] [DOI] |
| 20. | Wang JY, Guo JS, Yang CQ. Expression of exogenous rat collagenase in vitro and in a rat model of liver fibrosis. World J Gastroenterol. 2002;8:901-907. [PubMed] [DOI] |
| 21. | Reeves HL, Friedman SL. Activation of hepatic stellate cells--a key issue in liver fibrosis. Front Biosci. 2002;7:d808-d826. [PubMed] [DOI] |
| 24. | Liu YK, Shen W. Inhibitive effect of cordyceps sinensis on experimental hepatic fibrosis and its possible mechanism. World J Gastroenterol. 2003;9:529-533. [PubMed] [DOI] |
| 25. | Schaefer B, Rivas-Estilla AM, Meraz-Cruz N, Reyes-Romero MA, Hernández-Nazara ZH, Domínguez-Rosales JA, Schuppan D, Greenwel P, Rojkind M. Reciprocal modulation of matrix metalloproteinase-13 and type I collagen genes in rat hepatic stellate cells. Am J Pathol. 2003;162:1771-1780. [PubMed] [DOI] |
| 26. | Dooley S, Hamzavi J, Breitkopf K, Wiercinska E, Said HM, Lorenzen J, Ten Dijke P, Gressner AM. Smad7 prevents activation of hepatic stellate cells and liver fibrosis in rats. Gastroenterology. 2003;125:178-191. [PubMed] [DOI] |
| 27. | Chen PS, Zhai WR, Zhou XM, Zhang JS, Zhang YE, Ling YQ, Gu YH. Effects of hypoxia, hyperoxia on the regulation of expression and activity of matrix metalloproteinase-2 in hepatic stellate cells. World J Gastroenterol. 2001;7:647-651. [PubMed] |
| 28. | Gaça MD, Zhou X, Issa R, Kiriella K, Iredale JP, Benyon RC. Basement membrane-like matrix inhibits proliferation and collagen synthesis by activated rat hepatic stellate cells: evidence for matrix-dependent deactivation of stellate cells. Matrix Biol. 2003;22:229-239. [PubMed] [DOI] |
| 29. | Acharya SK, Batra Y. Is cirrhosis of the liver reversible? The ultimate that a hepatologist wishes. Trop Gastroenterol. 2003;24:1-2. [PubMed] |