Copyright
©The Author(s) 2004. Published by Baishideng Publishing Group Inc. All rights reserved.
肝细胞癌DNA修复酶hMTH1基因mRNA及其蛋白的表达
周鹤俊, 林菊生, 周秀敏, 黎培员, 陶璐薇
周鹤俊, 林菊生, 周秀敏, 黎培员, 陶璐薇, 华中科技大学同济医学院附属同济医院肝病研究所 湖北省武汉市 430030
周鹤俊, 女, 1975-05-03生, 湖南省邵阳市人, 汉族, 2003年华中科技大学同济医学院博士生, 主要从事肝脏疾病的研究及消化系疾病的临床工作.
ORCID number: $[AuthorORCIDs]
电话: 027-83663595
收稿日期: 2004-06-24
修回日期: 2004-07-09
接受日期: 2004-07-15
在线出版日期: 2004-09-15
目的: 通过检测DNA修复酶hMTH1 mRNA及其蛋白在肝细胞癌组织及细胞株中的表达, 探讨hMTH1在肝细胞癌发生、发展及防御机制中的作用.
方法: 采用半定量逆转录聚合酶链反应(RT-PCR)研究肝癌(HT, n = 33)、癌旁组织(HST, n = 33)和正常肝细胞株(L-02)、肝癌细胞株(SMMC7721, HepG2)中hMTH1 mRNA的表达, 同时采用免疫组织化学方法原位检测了上述的肝癌组织(n = 17)及癌旁组织(n = 17)中hMTH1蛋白的表达.
结果: 绝大部分检测对象中均有不同程度hMTH1 mRNA 及其蛋白的表达.肝癌组织中hMTH1 mRNA的表达较癌旁组织显著升高(t = 2.424 , P = 0.021<0.05); SMMC7721, HepG2细胞中hMTH1 mRNA的表达显著高于L-02细胞(F = 6.810, P = 0.009<0.01).SMMC7721与HepG2细胞中hMTH1 mRNA的表达没有显著差异(P = 0.395>0.05).hMTH1蛋白主要在肝细胞胞质中表达, 肝癌组织中hMTH1蛋白水平明显高于癌旁组织(t = 2.618, P = 0.019<0.05).
结论: hMTH1mRNA及其蛋白在肝癌组织及肝癌细胞株中表达升高.
关键词: N/A
引文著录: 周鹤俊, 林菊生, 周秀敏, 黎培员, 陶璐薇. 肝细胞癌DNA修复酶hMTH1基因mRNA及其蛋白的表达. 世界华人消化杂志 2004; 12(9): 2057-2060
Expression of DNA repair enzyme hMTH1 mRNA and its protein in hepatocellular carcinoma
He-Jun Zhou, Ju-Sheng Lin, Xiu-Min Zhou, Pei-Yuan Li, Lu-Wei Tao
He-Jun Zhou, Ju-Sheng Lin, Xiu-Min Zhou, Pei-Yuan Li, Lu-Wei Tao, Institute of Liver Diseases, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, Hubei Province, China
Correspondence to: Dr. Ju-Sheng Lin, Institute of Liver Diseases, Tongji Hospital,Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, Hubei Province, China. linjusheng2001@163.net
Received: June 24, 2004
Revised: July 9, 2004
Accepted: July 15, 2004
Published online: September 15, 2004
AIM: To study the expression of DNA repair enzyme hMTH1 mRNA and protein in hepatocellular carcinoma (HCC) tissues, normal liver cell and hepatoma cell lines, and to investigate their function in the progress of HCC.
METHODS: Expression of hMTH1 mRNA in matched HCC tissues(33 cases)/surrounding tissues of HCC (33 cases), normal liver cell L-02 and hepatoma cell lines SMMC7721 HepG2 were detected by semi-quantitative reverse-transcription polymerase chain reaction (RT-PCR). hMTH1 protein was detected in corresponding HT tissues (17 cases HT) as well as their surrounding liver tissues (17 cases HST) by immunohistochemistry.
RESULTS: The expression level of hMTH1 mRNA in HT was higher than that in HST (t = 2.424 , P = 0.021<0.05). The expression level of hMTH1 mRNA in two hepatoma cell lines was higher than that in normal liver cell line (F = 6.810, P = 0.009<0.01). The expression of hMTH1 mRNA in SMMC7721 was similar to that in HepG2. hMTH1 protein was 88.2% (15 of 17) positive in HT and 82.4% (14 of 17) in HST and was mainly distributed in hepatocytesi cytoplasm. The protein level of hMTH1 in HCC tissues was correspondingly higher than in their surrounding tissues (t = 2.618, P = 0.019<0.05).
CONCLUSION: Overexpression of hMTH1 mRNA and its protein in the liver tissues of HCC and hepatoma cell lines is found.
Key Words: N/A
0 引言
我国肝细胞癌(hepatocellular carcinoma, HCC)患病率较高. 活性氧族(reactive oxygen species, ROS)在癌症的发生发展中起了一定的作用[1]. 抗氧化保护机制不能抵挡高水平ROS的作用时, 便产生氧化应激[2], 引起DNA损伤, 包括碱基修饰, DNA链断裂, DNA-蛋白交联[3], 其中8-羟基-鸟嘌呤脱氧核苷酸(8-OH-dG)是一种重要的碱基修饰产物[4], 他可由ROS直接作用于DNA链产生, 亦可由ROS氧化游离于核苷酸池中的dGTP为8-oxo-dGTP再脱焦磷酸产生, 被氧化的核苷酸池是8-OH-dG的一个重要来源[5]. 而在DNA的复制中, 8-OH-dG可以同等效率结合在DNA链中A或C的对位导致A:T→C:G及G:C→T:A颠换[6-7], 参与癌变过程[8-11]. 人MutT同源物(human MutT homologue,hMTH1)基因与Escherichia coli的Mut T同源, 其基因编码产物为8-oxo-dGTPase(或8-OH-dGTP酶), 他是一种三磷酸酶, 具有糖苷酶活性, 可水解游离核苷酸池中8-oxo-dGTP为8-oxo-dGMP, 从而阻止8-oxo-dGTP错误结合至DNA链中, 避免了DNA链的损伤[12]. 因此, hMTH1可能在人类基因组DNA氧化损伤的修复中起重要作用. 迄今, hMTH1在HCC中的研究报道颇少, 而hMTH1蛋白在肝癌中的表达至今未见报道. 我们检测了肝细胞癌癌组织、癌旁组织及L-02, SMMC7721, HepG2细胞株中hMTH1基因表达水平, 旨在探讨DNA修复酶hMTH1基因表达在HCC发生、发展及防御机制中的作用.
1 材料和方法
1.1 材料
同济医院2002/2003年肝细胞癌患者33例, 男28例, 女5例, 平均年龄48岁.取其手术切除的肝癌及相应的癌旁组织, 液氮冷冻后储存于-80 ℃冰箱待检. 所有的病例均经病理证实. 3株传代真核贴壁生长细胞, 为SMMC7721, HepG2及经SV40病毒大T抗原永生化的人胎肝细胞株L-02, 购自武汉大学中国典型培养物保藏中心. Trizol试剂购自Omega公司, Moloney鼠白血病病毒M-MLV逆转录酶等RT-PCR试剂及DMEM购自Promega公司, 胎牛血清购自杭州四季青生物工程材料有限公司. 目的基因hMTH1扩增引物序列参照文献(Int J Cancer.1996;65:437-441)为: U 5'-GCAAGAAGGAGAGACCATCG-3', D 5'-AACCAGTAGCTGTCGTCGG-3'; 内参β-actin基因序列参照NCBI的nucleotide库, 自行设计内参扩增引物序列如下: U 5'- TGGCACCACACCTTCTACAA-3'; D 5'-AGCCTGGATAGCAACGTACA-3'. 均由北京赛百盛生物公司合成. MTH1兔抗人抗体购自美国Novus Biologicals公司, 由国内深圳晶美公司代理, SP免疫组化试剂盒购自北京中山生物技术公司. 其他均为分析纯试剂.
1.2 方法
L02, SMMC7721及HepG2细胞用含100 mL/L胎牛血清、100 U/L青霉素、100 U/L链霉素的DMEM(Dulbeccos modified engle medium)培养基, 37 ℃, 50 mL/L CO2, 湿度饱和的条件下进行培养, 每株细胞均重复培养5瓶. 根据产品说明书用Trizol试剂抽提癌、癌旁组织及3株细胞中的总RNA, 测A值, 计算浓度, 依纯度鉴定质量. 用半定量RT-PCR法检测hMTH1在肝细胞癌的癌、癌旁组织及3株细胞中的表达, 以β-actin为内参照. 先吸取总RNA 3 mg, 用oligo(dT)作引物在M-MLV逆转录酶作用下逆转录生成第一链cDNA, 其体系为: 5×RT Buffer 4 mL, 10 mmoL/L dNTPs 1 mL, 50 mU/L的RNasin0.5 mL, oligo(dT) 1 mL, 200 mU/L的M-MLV RT 1 mL, 再加无RNase灭菌水, 总体积为20 mL, 42 ℃反应60 min, 90 ℃灭活5 min, 阴性对照体系除不加模板外均同上;再取逆转录产物2 mL行PCR反应, 其体系为: 25 mmoL/L MgCL2 1.5 mL, 10 mmoL/L dNTPs及4条10 pmoL/L 引物各0.5 mL, 加入10×buffer 2.5 mL及MillQ水, 94 ℃热启动5 min, 冰上冷却并加Taq酶1IU, 终体积为25 mL, 循环条件为: 94 ℃ 45 s, 57 ℃ 30 s, 72 ℃ 45 s, 30个循环后72 ℃再延伸7 min. 分别扩增出255 bp的hMTH1及159 bp的β-actin 的片段, 阴性对照体系除不加模板外均同上.取PCR产物5 mL, PCR上样缓冲液1 mL加至含0.5 mg/L的溴化乙锭15 g/L琼脂糖凝胶加样孔中行电泳, 75 V, 30 min, 随后将凝胶置紫外灯下观察桔黄色条带, 并用UVP凝胶分析系统摄像分析结果, 以曲线下面积作为PCR产物含量, 相对单位=hMTH1积分值/β-actin积分值. 对17例所收集肝细胞癌的癌及癌旁组织4 mm厚的石蜡切片进行免疫组织化学hMTH1蛋白表达研究, 采用SP法. 常规脱腊至水, 30 mL/L H2O2封闭内源性过氧化物酶, 微波行抗原修复, 抗原修复液为pH 6.0, 0.01 mol/L的柠檬酸钠缓冲液, 磷酸盐缓冲液(PBS)清洗后加正常兔血清, 甩去血清, 再滴加一抗(抗hMTH1抗体), 4 ℃孵育过夜. 并设立对照: 以PBS代替一抗为阴性对照; 以高表达hMTH1蛋白的支气管肺泡癌为阳性对照. PBS振洗再依次加二抗及经标记的链霉卵白素工作液, DAB染色, 苏木素复染, 脱水后中性树胶封片. 用HMIAS-2000高清晰度彩色医学图文分析系统进行hMTH1蛋白阳性表达定量分析, 每张切片随机挑选5个视野, 再计算其均值.
统计学处理 数据以均数±标准差(mean±SD)表示, 率的显著性差异应用SPSS 11.5软件进行t检验, 方差分析及两两比较.
2 结果
2.1 hMTH1 mRNA的表达
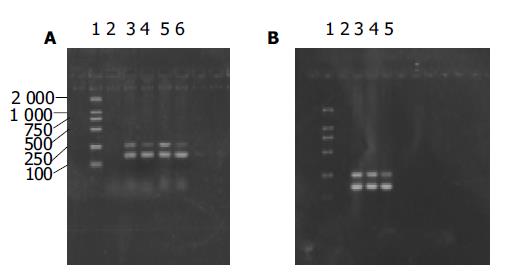
所有肝癌及癌旁组织均有不同水平的hMTH1 mRNA表达, 肝癌组织呈高表达, 与癌旁组织比(87.8%), 肝癌组织有hMTH1 mRNA水平上调. 密度分析显示, 肝癌组织中hMTH1 mRNA水平(1.138±0.092)较癌旁组织(0.820±0.093)高(t = 2.424, P<0.05图1A). 3株细胞亦均有hMTH1 mRNA的表达, 平均表达水平为: L02(0.820±0.082), SMMC7721(1.956±0.286), HepG2(1.683±0.233), 数据经方差分析及两两比较, 结果显示其他2株细胞中hMTH1 mRNA水平较L-02细胞明显升高(F = 6.810, P<0.01图1.B), SMMC7721与HepG2细胞中其表达水平没有显著差异.
图1 hMTH1 mRNA表达.
A:肝癌及癌旁组织, 1: Marker; 2:不加cDNA; 3:肝癌组织; 1; 4:癌旁组织;1; 5: 肝癌组织; 2;6:癌旁组织2. B:三株细胞, 1: Marker; 2:不加cDNA; 3: SMMC7721细胞; 4: HepG2细胞; 5: L-02细胞.
2.2 hMTH1蛋白的表达
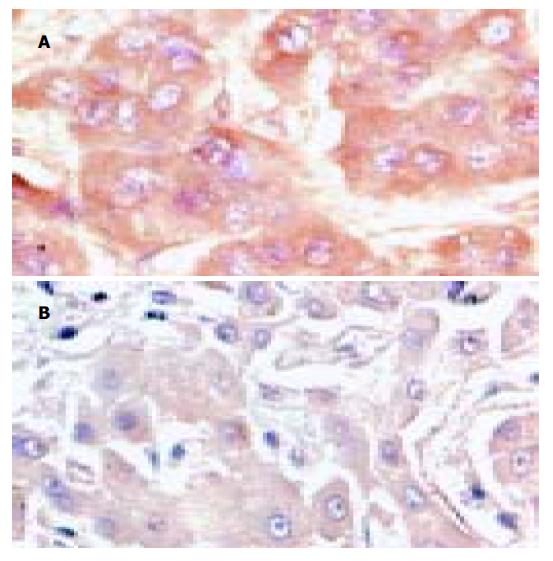
hMTH1蛋白阳性染色主要位于肝细胞胞质内(图2), 只有1例呈核染色. 癌组织阳性率为88.2%、癌旁组织为82.4%; 癌组织hMTH1蛋白表达水平灰度值(147.301±6.228)明显高于癌旁组织(135.335±4.507) (t = 2.618, P <0.05).
图2 hMTH1蛋白表达免疫组化×400.
A: 肝癌组织; B:肝癌癌旁组织.
3 讨论
持续氧化应激在癌症发生发展中起重要作用, 即癌症发病机制的持续性氧化应激学说[13-17], 研究指出, 相比癌旁组织, 癌组织中的DNA持续暴露在更高水平的ROS下, 其氧化应激程度更强. 电离辐射、环境诱变剂及细胞的自身代谢均可使细胞产生活性氧族ROS, 如OH-, O-, OH., O2 , H2 O2 , O-2等, DNA在活性氧族的作用下形成多种氧化产物, 在众多的氧化产物中, 8-OXO-dG是一种有强致突变作用的DNA氧化损伤产物. 然而真核生物都有一套修复DNA氧化损伤的防御性酶系统[18-21], 其中包括hMTH1, hOGG1[22-23],hMYH[24]. 他们可以对各种氧化损伤进行修复而与氧化损伤因子保持平衡, 从而保护机体免受氧化损伤.当机体内的活性氧族负荷超过自身防御系统的抗氧化能力时, DNA就会受到攻击而损伤, 其中可造成DNA的碱基颠换进而导致癌症. 一般认为, 氧化应激致癌的机制如下: (1)活性氧族引起永久性的DNA结构变化, 如碱基颠换后致重要的结构基因突变, 进而引起癌基因的激活及抑癌基因的失活; (2)活性氧族激活了细胞质或细胞核的信号转导途径[25-26]; (3)活性氧族调节关键蛋白及基因的活性, 而他们又具有调控有关细胞生长、分化、死亡的效应基因的功能. 现已在人乳腺癌[27-28]、胃腺癌、肺鳞癌、肺腺癌、肾细胞癌等肿瘤中检测到高水平的8-OXO-dG; 亦有研究表明, 在人肾细胞癌、前列腺癌[29]、乳腺癌、肺癌细胞系中hMTH1 mRNA呈过表达; 而且已在脑部肿瘤中检测到hMTH1蛋白过表达[30]. hMTH1基因在肝癌中表达情况的研究颇少, 而hMTH1蛋白在肝癌中的表达至今未见报道. 在本研究中, 癌组织hMTH1 mRNA水平显著高于癌旁组织, 与同类研究报道结果一致[31-32], 其机制可能是癌组织的氧化损伤远远重于癌旁组织, 而机体为了适应这种持续高水平的氧化应激, 削弱氧化损伤, 反应性地上调了hMTH1 mRNA的表达. hMTH1基因的过表达有助于减少核苷酸池中游离的8-oxo-dGTP, 防止8-oxo-dG在DNA复制中错误配入细胞DNA链中, 从而有助于保持细胞DNA的完整性. 但此时氧化损伤已经存在, 并已造成了细胞不可逆的结构和功能的变化, 甚至发生了恶性转变及癌症形成, 反应性地上调hMTH1的表达也不能阻止疾病的发展, 更不能逆转癌变. 在本研究中, 2株肿瘤细胞hMTH1 mRNA表达显著高于L-02, 同样说明肿瘤细胞氧化损伤重于非肿瘤细胞; 但2株肿瘤细胞之间的hMTH1 mRNA表达没有明显差异.免疫组化结果显示: 癌组织染色明显高于癌旁组织, 即hMTH1蛋白显著升高, 与hMTH1 mRNA检测结果是一致的.
总之, 肝癌组织中hMTH1 mRNA及hMTH1蛋白水平均高于癌旁组织, SMMC7721和HepG2 hMTH1 mRNA水平明显高于L-02;肝癌处于高水平的氧化应激状态下, hMTH1参与肝细胞DNA氧化损伤修复, 这种损伤修复是肝癌发生、发展及防御过程中发生的重要分子事件之一, 起着重要作用, hMTH1可作为诊断肝细胞癌的候选指标. 而阻断DNA的氧化损伤又可为肝癌治疗提供新的思路.