修回日期: 2004-06-14
接受日期: 2004-06-17
在线出版日期: 2004-09-15
目的: 探讨2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖诱导肝癌细胞株HepG2凋亡的可能性.
方法: 选用不同浓度的2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖与肝癌细胞株共同孵育不同时间后, 应用倒置相差显微镜、荧光显微镜、透射电子显微镜对细胞生长状况及药物作用后细胞的形态进行观察.
结果: 经2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖作用24-72 h后, HepG2肝癌细胞株出现体积缩小, 荧光染色增强, 胞核或胞质中可见致密浓染的块状或颗粒状黄绿色荧光染色. 染色质固缩, 并凝结成块, 聚集在核膜周边呈新月状或肾状, 胞质浓缩, 内质网疏松并与胞膜融合形成一个个空泡. 且凋亡细胞含量呈一定的浓度、时间相关性.
结论: 2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖具有诱导HepG2细胞凋亡的作用.
引文著录: 吴静, 寇炜, 雍建平, 王爱勤, 刘维民, 薛群基. 2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖诱导肝癌细胞凋亡的形态学变化. 世界华人消化杂志 2004; 12(9): 2049-2052
Revised: June 14, 2004
Accepted: June 17, 2004
Published online: September 15, 2004
AIM: To investigate the changes of apoptosis in hepatocellular carcinoma cells induced by 2-[(3-carboxy-1-oxoprogy1) amino]-2-deoxy-D-glucose.
METHODS: Fluorescent microscopy and transmission electron microscopy were used to observe the morphologic changes of apoptosis with different concentration of2-[(3-carboxy-1-oxoprogy1) amino]-2-deoxy-D-glucose at different time.
RESULTS: The morphologic changes of apoptosis were exhibited, including shrinkage of cell, condensation of chromatin, breakage of nuclear and formation of apoptotic bodies, but the number of apoptosis increased with the concentration 2-[(3-carboxy-1-oxoprogy1) amino]-2-deoxy-D-glucose and time.
CONCLUSION: 2-[(3-carboxy-1-oxoprogy1) amino]-2-deoxy-D-glucose can induce apoptosis of human hepatocelluar carcinoma cells (HepG2).
- Citation: Wu J, Kou W, Yong JP, Wang AQ, Liu WM, Xue QJ. Morphology of apoptosis of human hepatocellular carcinoma cell line induced by 2-[(3-carboxy-1-oxoprogy1) amino]-2-deoxy-D-glucose. Shijie Huaren Xiaohua Zazhi 2004; 12(9): 2049-2052
- URL: https://www.wjgnet.com/1009-3079/full/v12/i9/2049.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i9.2049
原发性肝癌在我国恶性肿瘤的发病率中占第3位, 由于其发展快、转移早、预后差、生存期短, 故药物仍然是治疗中晚期肝癌的主要手段. 诱导肿瘤细胞凋亡是多年来医学界一直关注的课题之一, 是目前肿瘤治疗的新途径[1-3], 因此寻找高效低毒的诱导肿瘤细胞凋亡的药物非常重要. D-氨基葡萄糖是甲壳素(chitosan)脱除乙酰基后降解而形成的单糖. 研究发现D-氨基葡萄糖的部分其他衍生物具有诱导白血病细胞K562向巨噬细胞分化的能力[4]. 而D-氨基葡萄糖衍生物2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖对肿瘤细胞的抑制作用国内外尚未见报道. 我们就D-氨基葡萄糖的衍生物对人肝癌细胞株HepG2的凋亡形态学变化进行研究, 以探讨2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖诱导HepG2细胞凋亡的作用, 为肝癌治疗提供新的理论依据.
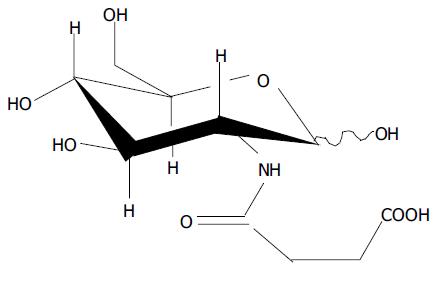
人肝癌细胞株HepG2由第四军医大学病理教研室惠赠. 2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖(图1)由中国科学院兰州化学物理研究所最新合成并提供, 经蒸馏水溶解, 0.22 um过滤除菌, 4 ℃冰箱保存. RPMI1640培养液为美国Sigma公司产品, 胰蛋白酶、丫啶橙、小牛血清为上海生物工程有限公司产品. 倒置相差显微镜、荧光显微镜为日本Olympus产品, 透射电子显微镜为日本JEM-100cx型. 将传代的人肝癌细胞株HepG2培养于37 ℃含50 mL/L CO2温箱内, 培养液为含100 mL/L小牛血清的RPMI1640全培养液,含10 g/L双抗(青霉素100 mg/L, 链霉素100 mg/L), 肝癌细胞呈贴壁生长, 每3-4 d传代1次, 并取形态良好的对数生长期细胞进行实验.
我们观察0.001, 0.005, 0.01, 0.02, 0.03 mmol/L五个药物浓度对肝癌细胞的作用, 未加药组作为对照组(用完全培养液作空白对照). 将2×105细胞接踵于96孔培养板中培养, 每组设立5个复孔, 观察不同浓度的2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖不同时间对肝癌细胞的影响. 2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖作用不同时间的肝癌细胞用2 g/L的胰酶消化后, 在细胞计数板上计数, 每孔计数2次, 每一浓度和作用时间计数3个孔.
1.2.1 倒置显微镜观察: 将不同2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖浓度作用不同时间的HepG2细胞置于倒置显微镜下观察细胞的生长状况及形态学改变, 同时观察其凋亡过程.
1.2.2 荧光染色细胞观察: 将盖玻片裁成1 cm×1 cm大小并放入由重铬酸钾和浓硫酸组成的混含液中浸泡48-72 h, 取出后用自来水、双蒸水冲洗干净后高温消毒, 备用. 取对数生长期HepG2细胞, 稀释成2×108/L, 接种于6孔培养板, 制成细胞爬片, 经2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖处理48 h后, PBS洗涤2次, 甲醇-冰醋酸固定20 min后, 加入0.1 g/L丫啶橙10 uL染色30 min, 清水冲洗, 在Olympus荧光显微镜(10×20)下观察.
1.2.3 透射电镜观察: 取对数生长期细胞置100 mL培养瓶中至细胞贴壁至1/2时, 弃旧培养液, 加入0.02 mmol/L的2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖培养48 h后, 用2.5 g/L胰蛋白酶消化并制成单细胞悬液. 置于离心管中, 12 000 r/min×20min后弃上清, 加入30 g/L戊二醛固定, 再10 g/L饿酸固定, 脱水, 环氧树脂包埋, 并制成超薄切片, 铀铅染色, 透射电镜下(日本JEM-100cx型, ×6 000)观察凋亡细胞的超微结构特征.
不同浓度的2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖可使人肝癌细胞株HepG2生长受到抑制, 表现为肝癌细胞的贴壁能力减弱, 由贴壁生长而逐渐脱落, 悬浮于培养液中, 贴壁细胞数量减少, 细胞体积缩小, 变圆; 出现核固缩, 核颜色加深, 且有时间和剂量的依赖性, 药物剂量越大, 作用时间越长, 其生长受抑制越明显,直至大部分或全部细胞死亡. 对照组肝癌细胞贴壁生长良好, 细胞轮廓清晰, 透光度好, 形态规整, 呈梭形或条索状, 细胞生长致密、旺盛, 且部分可见伪足, 几乎无脱落. 用不同浓度的D-氨基葡萄糖衍生物处理HepG2后, 其生长增生作用明显被抑制, 实验组与对照组相比有显著性差异(P <0.01)随着本药浓度的增加, HepG2细胞的增生抑制率也在增加, 表明本药对HepG2抑制生长作用在一定的时间范围内, 随着作用时间的延长, 其抑制率也相应增大(表1).
| Time | Control group | Experimental group | ||||
| 0. 001mmol/L | 0. 005 mmol/L | 0. 01 mmol/L | 0. 02 mmol/L | 0. 03 mmol/L | ||
| 24 h | 0.771±0.0442 | 0.777±0.0354 | 0.681±0.0359 | 0.678±0.0225 | 0.541±0.050 | 0.352±0.0725 |
| 48 h | 1.546±0.153 | 1.196±0.066 | 0.886±0.0357 | 0.711±0.0296 | 0.361±0.0416 | 0.142±0.0167 |
| 72 h | 1.632±0.108 | 1.410±0.0726 | 1.077±0.090 | 0.815±0.0359 | 0.366±0.0935 | 0.194±0.0292 |
| 96 h | 1.462±0.144 | 1.350±0.0296 | 1.145±0.0399 | 0.867±0.0314 | 0.376±0.108 | 0.176±0.0138 |
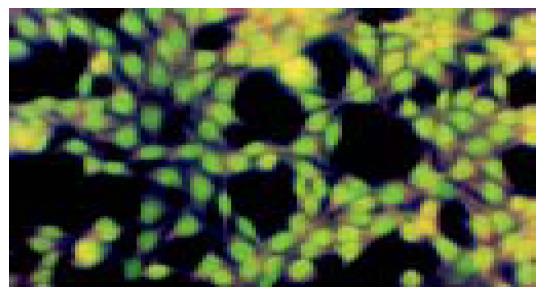
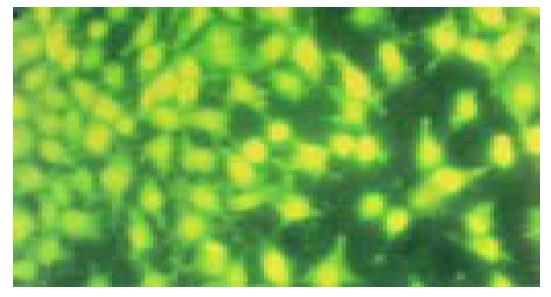
不同浓度2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖作用后的HepG2肝癌细胞在24, 48, 72和96 h均可出现细胞核体积缩小, 荧光染色增强, 同时细胞核或细胞质可见到致密浓染的块状或颗粒状的黄绿色荧光染色或黄绿色碎片, 有的甚至可见新月形核质边集现象(图2), 其中以0.02 mmol/L 2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖作用48 h的凋亡细胞最多; 对照组HepG2细胞则呈现细胞核饱满, 并出现黄色或黄绿色的均匀荧光, 细胞质为橘黄色或橘红色的均匀荧光染色(图3).
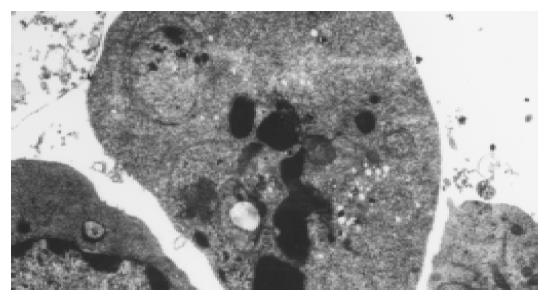
细胞质出现明显浓缩, 胞质内微绒毛减少, 基质逐渐消失, 内质网结构出现疏松并与细胞膜融合, 从而出现空泡; 而细胞核内的染色质固缩并凝集成块, 聚集在核膜的周边, 出现颗粒状、环状或新月状(图4). 对照组HepG2细胞膜完整, 细胞核和细胞器等亚单位结构清晰可见.
2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖属海洋生物制剂,是由甲壳素脱除乙酰基然后再降解形成的具有生物活性单糖分子. 其几乎分布于人体所有组织[5], 他与葡萄糖醛酸、半乳糖、硫酸葡萄糖醛酸等结合形成透明质酸、角质硫酸、肝素、硫酸肝素等重要的人体生物物质, 参与构造人体组织和细胞膜, 是蛋白多糖大分子合成的中间物质, 他不仅参与人体肝肾解毒, 发挥抗炎、刺激蛋白多糖的合成, 而且可以抑制肿瘤细胞的增长[6-7], 研究发现, 将D-氨基葡萄糖进行部分衍生化后, 对肿瘤细胞具有更强的诱导分化作用, 如: N-乙酰氨基葡萄糖能够诱导白血病细胞K562细胞向巨噬细胞分化[4,8]. 而本研究所用的2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖是由中国科学院兰州化学物理研究所最新合成的, 具有低毒高效的作用.
细胞凋亡是指在一定的生理或病理条件下遵循自身的程序自己结束其生命的过程[3], 是多细胞、生物体维持自身稳定的重要机制. 目前认为细胞凋亡受阻是多种人体疾病特别是肿瘤的重要发病机制[9-10]. 随着对凋亡分子机制的深入研究, 人们已认识到增加肿瘤细胞凋亡是一条有效的治疗肿瘤途径[11-20]. 而且细胞凋亡亦隐含着一个形态学的概念, 对其形态的观察是研究细胞凋亡的最基本的方法. Catchpoole et al[21]报道, 细胞凋亡时DNA蛋白电泳带的出现较形态学改变出现的时间晚. 因此对于细胞凋亡的检测, 特别是在凋亡发生的早期, 形态学观察尤为重要. 本研究用2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖诱导体外培养的人肝癌细胞株HepG2凋亡, 在荧光显微镜和透射电子显微镜下观察凋亡细胞的形态学改变, 主要包括: 细胞体积缩小, 核固缩, 染色质凝集以及凋亡小体的形成, 与文献[22-30]报道一致其中以0. 02 mmol/L 2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖作用48 h的凋亡细胞最多. 结果表明2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖能抑制人肝癌细胞的生长增生, 并在一定的浓度范围内诱导细胞凋亡, 这说明2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖可以通过诱导细胞凋亡的形式起到抗癌作用. 细胞凋亡是细胞自身调节的主动性死亡过程, 他不引起炎症反应, 机体不会因此发生不良反应, 因而细胞凋亡是肿瘤治疗的一个重要领域, 2-(3-羧基-1-丙酰氨基)-2-脱氧-D-葡萄糖诱导细胞凋亡的作用无疑使其在癌症防治中的作用更有意义, 为其在肿瘤治疗中的应用提供了理论基础. 但有哪些基因参与, 他们是如何参与基因调控的尚待于今后进一步研究.
| 1. | Leszczyniecka M, Roberts T, Dent P, Grant S, Fisher PB. Differentiation therapy of human cancer: basic science and clinical applications. Pharmacol Ther. 2001;90:105-156. [PubMed] [DOI] |
| 3. | Kerr JF, Wyllie AH, Currie AR. Apoptosis: a basic biological phenomenon with wide-ranging implications in tissue kinetics. Br J Cancer. 1972;26:239-257. [PubMed] [DOI] |
| 4. | Kerr JF, Winterford CM, Harmon BV. Apoptosis. Its significance in cancer and cancer therapy. Cancer. 1994;73:2013-2026. [PubMed] [DOI] |
| 5. | Wang Z, Qiao Y, Huang GS, Wang AQ, Zhang YQ, Feng JL, Yang GR, Guo Y, Liang R. Glucosamine and glucosamine hydrochloride induced leukemia cell line K562 differention into macrophage. Chin Pharmacol Bulletin. 2003;19:290-293. |
| 8. | 王 哲, 乔 岩, 黄 高升, 王 爱勤, 张 永清, 冯 骥良, 杨 国嵘, 郭 英, 梁 蓉. N- 乙酰氨基葡萄糖诱导白血病细胞K562向巨噬细胞分化. 第四军医大学学报. 2003;24:46-48. |
| 9. | Hino N, Higashi T, Nouso K, Nakatsukasa H, Tsuji T. Apoptosis and proliferation of human hepatocellular carcinoma. Liver. 1996;16:123-129. [PubMed] [DOI] |
| 11. | 侯 宝华, 卿 三华, 董 凤英, 齐 德麟, 张 刚庆, 赵 峰, 姚 学清, 彭 明. 腹腔热灌注化疗对人大肠癌细胞裸鼠腹腔种植的影响. 世界华人消化杂志. 2000;8:650-653. [DOI] |
| 15. | Deng LY, Zhang YH, Xu P, Yang SM, Yuan XB. Expression of IL 1betaconverting enzyme in 5-FU induced apoptosis in esophageal carcinoma cells. World J Gastroenterol. 1999;5:50-52. [PubMed] [DOI] |
| 17. | Sun BH, Zhao XP, Wang BJ, Yang DL, Hao LJ. FADD and TRADD expression and apoptosis in primary hepatocellular carcinoma. World J Gastroenterol. 2000;6:223-227. [PubMed] |
| 19. | Kong XP, Zou QY, Li RB, Zheng PL, Yang LP, Jin SW. Apoptosis of neoplasm cell lines induced by hepatic peptides extracted from sucking porcine hepatocytes. World J Gastroenterol. 1999;5:435-439. [PubMed] [DOI] |
| 21. | Catchpoole DR, Stewart BW. Formation of apoptotic bodies is associated with internucleosomal DNA fragmentation during drug-induced apoptosis. Exp Cell Res. 1995;216:169-177. [PubMed] [DOI] |
| 23. | Huang PL, Zhu SN, Lu SL, Dai ZS, Jin YL. Inhibitor of fatty acid synthase induced apoptosis in human colonic cancer cells. World J Gastroenterol. 2000;6:295-297. [PubMed] |
| 24. | Zhou HP, Wang X, Zhang NZ. Early apoptosis in intestinal and diffuse gastric carcinomas. World J Gastroenterol. 2000;6:898-901. [PubMed] [DOI] |
| 25. | Zhang FX, Zhang XY, Fan DM, Deng ZY, Yan Y, Wu HP, Fan JJ. Antisense telomerase RNA induced human gastric cancer cell apoptosis. World J Gastroenterol. 2000;6:430-432. [PubMed] [DOI] |
| 26. | Gu QL, Li NL, Zhu ZG, Yin HR, Lin YZ. A study on arsenic trioxide inducing in vitro apoptosis of gastric cancer cell lines. World J Gastroenterol. 2000;6:435-437. [PubMed] [DOI] |
| 30. | Eck KM, Yuan L, Duffy L, Ram PT, Ayettey S, Chen I, Cohn CS, Reed JC, Hill SM. A sequential treatment regimen with melatonin and all-trans retinoic acid induces apoptosis in MCF-7 tumour cells. Br J Cancer. 1998;77:2129-2137. [PubMed] [DOI] |