修回日期: 2004-05-02
接受日期: 2004-05-09
在线出版日期: 2004-08-15
目的: 探讨gp96在人胃癌组织及癌旁正常组织中的表达及其临床意义.
方法: 采用原位杂交技术和SABC免疫组化法, 在核酸和蛋白水平检测胃癌组织(n = 50)及癌旁正常组织(n = 50)gp96的表达.
结果: 胃癌组织及癌旁正常组织均可检测到gp96的表达, 胃癌组织gp96的表达均显著高于其癌旁正常组织(强阳性: 18/50 vs 0/50, P<0.01). gp96的表达与组织学类型显著相关(r = 0.387, P<0.05), 不同分化程度的胃癌组织之间, gp96的表达存在显著差异(P<0.05); 与肿瘤分期显著相关(r = 0.203, P<0.05), 临床Ⅲ, Ⅳ期显著高于Ⅰ, Ⅱ期(强阳性: 13/50 vs 5/50, P<0.05); 与淋巴结转移显著相关(r = 0.391, P<0.05), 有淋巴结转移者显著高于无淋巴结转移者(强阳性: 14/50 vs 4/50, P<0.05); 而gp96表达与性别、年龄及肿瘤部位无显著相关.
结论: gp96的表达与胃癌的发生、发展密切相关, 其表达水平可以作为判断胃癌预后的参考指标之一.
引文著录: 赵永亮, 余佩武, 蔡志民, 吴淼, 雷晓, 饶芸, 周立新. 胃癌组织gp96表达的临床意义. 世界华人消化杂志 2004; 12(8): 1969-1971
Revised: May 2, 2004
Accepted: May 9, 2004
Published online: August 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1969-1971
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1969.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1969
gp96 (glycoprotein of 96 ku)是一种热休克蛋白(heat shock proteins, HSPs), 属于HSP90家族, 在缺氧、肿瘤等应激条件下其合成明显增加[1]. 近年来, gp96在肿瘤的发生、发展及免疫治疗中意义已引起广泛关注. 已有的研究表明, gp96在某些肿瘤组织中表达增高, 并且与肿瘤的分化及转移密切相关[2]. 关于gp96在胃癌组织的表达情况及与胃癌生物学行为的关系如何, 目前尚不清楚. 为此, 我们采用原位杂交和SABC免疫组化技术对50例胃癌及癌旁正常胃黏膜进行gp96的检测, 以探讨gp96在胃癌发生、发展中的作用及临床意义.
第三军医大学附属西南医院普外科2002-02/2002-10行外科手术切除的新鲜胃癌标本50例, 以及同一患者距肿瘤约3-5 cm的癌旁正常组织. 患者年龄28-79岁(中位58岁), 男31例, 女19例. 经病理学证实, 高分化腺癌7例, 中分化腺癌24例, 低分化腺癌19例. 按照国际抗癌联盟(UICC)TNM分期标准, Ⅰ期6例, Ⅱ期18例, Ⅲ期19例, Ⅳ期7例. 全部标本均分为两部分, 一部分用40g/L甲醛固定和常规石蜡包埋, 行免疫组化检测; 另一部分制备冰冻切片, 进行原位杂交检测.冰冻切片制备: 将新鲜取材标本切成2 mm厚切片; 新鲜配制并过滤固定液(DEPC处理的PBS, 含40 g/L多聚甲醛, pH7.5), 将切下的组织置固定液中, 于4 ℃浸泡2 h; 倒出固定液, 将组织于4 ℃在蔗糖溶液(DEPC处理的PBS, 含30%蔗糖)中浸泡过夜, 直至组织沉到容器底部; 将组织贮存在-80 ℃; 进行切片时, 将组织升温至-20 ℃, 在低温恒温器中切成25 μm厚切片. 试剂包括山羊抗人gp96多克隆抗体(美国santa cruz biotechnology, Inc), 生物素化的兔抗山羊IgG及SABC试剂盒(武汉Boster Inc). gp96寡核苷酸探针和地高辛标记的gp96原位杂交检测试剂盒(武汉Boster Inc).
SABC免疫组化方法检测gp96的表达: 石蜡切片常规脱蜡至水, 新鲜配制30 mL/L H2O2室温5-10 min以灭活内源性酶; 热抗原修复后, 滴加正常兔血清封闭液, 室温20 min, 加入一抗(山羊抗人gp96多克隆抗体1: 200), 37 ℃ 1 h; 滴加二抗(生物素化兔抗山羊IgG); 37 ℃ 20 min; 滴加SABC , DAB显色, 苏木素轻度复染. 常规脱水, 透明, 封片. 实验中用PBS代替一抗作空白对照. 判断标准: gp96主要表达在细胞质内, 呈棕黄色颗粒. 每个视野至少观察100个细胞, 依染色强度分级: +++深棕色, ++浅棕色, +黄色, -未着色. mRNA 原位杂交方法: 原位杂交检测步骤按照Boster Inc公司检测试剂盒说明操作. 每次实验均设空白对照(即不加探针). 阳性部分呈蓝紫色. 采用Tiger图像分析仪分析, 计算阳性表达的光密度值, 数据以均数±标准差表示.等级资料采用秩和检验, 定量资料采用t检验, 相关性采用Spearman等级相关分析, SPSS 11.0统计软件进行统计分析. P<0.05表示统计学差异显著.
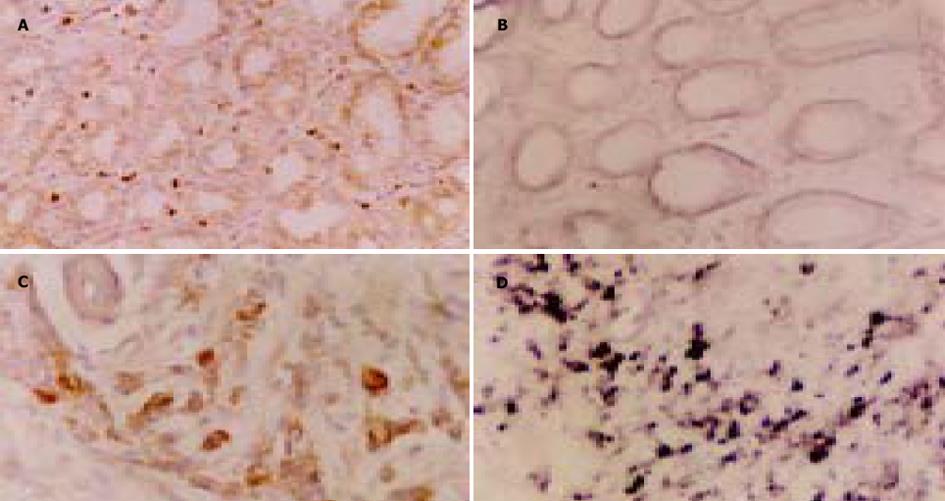
在癌旁正常黏膜中可见gp96较弱的阳性表达, 主要分布于黏膜腺体细胞的胞质内(图1). 免疫组化染色强度主要为 + (42例 + , 8例 ++ , 0例 +++) , 原位杂交结果Tiger图像分析测定其平均A值为0.47±0.24(表1).
| 分组 | gp96 protein level (case) | gp96 mRNA (mean±SD , A) | P值 | ||
| + | ++ | +++ | |||
| 男 | 5 | 20 | 12 | 1.34±0.34 | 0.286 |
| 女 | 2 | 5 | 6 | 1.21±0.46 | |
| 年龄 ≤45岁 | 2 | 7 | 2 | 1.38±0.36 | 0.632 |
| >45岁 | 5 | 18 | 16 | 1.32±0.39 | |
| 肿瘤部位 胃窦 | 3 | 13 | 8 | 1.37±0.44 | |
| 胃体 | 2 | 7 | 5 | 1.22±0.32 | 0.375 |
| 胃底 | 2 | 5 | 5 | 1.27±0.29 | |
| 分化程度 高分化 | 3 | 4 | 0 | 0.92±0.27 | |
| 中分化 | 3 | 11 | 10 | 1.27±0.31 | 0.033 |
| 低分化 | 1 | 10 | 8 | 1.50±0.38 | |
| TNM分期 Ⅰ期 | 3 | 2 | 1 | 1.20±0.31 | |
| Ⅱ期 | 2 | 12 | 4 | 0.042 | |
| Ⅲ期 | 2 | 9 | 8 | 1.41±0.41 | |
| Ⅳ期 | 0 | 2 | 5 | ||
| 淋巴结转移 有 | 2 | 15 | 14 | 1.44±0.40 | 0.032 |
| 无 | 5 | 10 | 4 | 1.21±0.33 | |
在胃癌组织癌细胞的胞质内可见到较强的阳性表达, 并可在胞核区见到未被染色的空核(图1), 免疫组化染色强度主要为 ++~+++ (7例 +, 25例 ++, 18例 +++), 原位杂交Tiger图像分析其平均A值为1.31±0.37, 明显高于其癌旁正常组织, 两组之间存在显著差异(P<0.01, 表1).
胃癌组织gp96的表达与组织学类型显著相关(r = 0.387, P<0.05), 不同分化程度的胃癌组织之间, 其表达存在显著差异(P<0.05); 与肿瘤分期显著相关(r = 0.203, P<0.05), 临床Ⅲ、Ⅳ期显著高于Ⅰ、Ⅱ期(P<0.05); 与淋巴结转移显著相关(r = 0.391, P<0.05), 有淋巴结转移者显著高于无淋巴结转移者(P<0.05); 而gp96表达与性别、年龄及肿瘤部位无显著相关(表1).
gp96是内质网最丰富的蛋白质之一, 作为分子伴侣参与其他蛋白质的折叠、转运、合成等过程, 抑制错折叠蛋白质的分泌; 与细胞内的其他肽类蛋白质结合, 参与细胞的抗损伤、修复和热耐受过程, 对新生肽具有分子伴侣作用[1,3]. 在肿瘤细胞中加工提呈肿瘤抗原以及维持细胞内环境稳定, 对细胞的生长、发育、分化及死亡具有一定的调节作用. 在肿瘤发病学、治疗和预防学中的意义已引起广泛关注, 成为近年来最活跃的研究领域之一[4-5]. 正常情况下gp96在细胞中呈低水平表达, 但在许多应激条件下可诱导其表达增加. 研究发现gp96在肿瘤组织及正常组织中的表达存在显著差异. 一些肿瘤如乳腺癌、结肠癌、肝癌和黑色素瘤等组织中都有不同程度的表达, 这种异常表达与肿瘤的分化程度、预后有关[6-8] .
将培养的肿瘤细胞进行诱导分化, 可降低肿瘤细胞gp96的表达水平. Wu et al[7] 把人结肠癌细胞株clone A用丁酸钠处理后, 通过形态学以及流式细胞仪检测发现, 丁酸钠可引起结肠癌细胞功能及形态的改变, Northern blot 和 Western blot分析发现gp96基因表达减少. Tanaka et al[8]分析了肝细胞癌与癌旁正常组织gp96的表达, 发现gp96mRNA在肝细胞癌中高表达, 并且其表达量与肝癌的组织学分级是一致的. 在肝癌细胞株中表达也增高, 其表达与细胞的生长状态无关. 用丁酸钠诱导癌细胞分化, gp96 mRNAs的表达则下调. 说明gp96与肿瘤发生、发展及细胞分化之间具有相关性. 表明这些基因的高表达是肿瘤细胞的重要特征, 将在分子水平上为肿瘤的发生提供重要线索.
我们应用免疫组织化学和原位杂交技术对胃癌组织进行gp96的表达研究, 结果表明, gp96在胃癌组织和癌旁正常黏膜内均有表达, 在胃癌组织的表达明显高于癌旁正常黏膜, 并且与组织学类型、肿瘤分期及淋巴结转移相关. 分化越差、进展越晚及有淋巴结转移时gp96的表达显著增高, 提示gp96的表达可以作为肿瘤细胞的一种标志物. 从我们的实验结果分析, 在肿瘤的发生发展过程中, 由于肿瘤组织生长快, 致使肿瘤缺血、缺氧及局部酸中毒, 细胞为了抵御这样恶劣的肿瘤微环境状态而产生gp96等热休克蛋白, 高水平的gp96等热休克蛋白可保护肿瘤细胞战胜机体内各种不利的生理环境, 在肿瘤的发生和发展中起重要作用. 胃癌细胞通过增加细胞合成gp96的水平和改变其在细胞内的定位和分布而得以保护细胞, 逃避免疫监视. 因此, gp96在癌细胞表达水平的增加可以作为癌细胞调整其抗原特性以适应生存的一种危险信号.
gp96在肿瘤细胞中的异常表达可能由于肿瘤细胞不断增生, 需要他们作为分了伴侣来调节、稳定这一增生过程. gp96通过影响增生过程参与细胞周期、细胞间信号传导, 从而使肿瘤细胞逃避免疫监视, 提示可以作为判断肿瘤预后的参考指标, 为研究肿瘤的发生、发展提供理论基础.
编辑: N/A
| 1. | Robert J. Evolution of heat shock protein and immunity. Dev Comp Immunol. 2003;27:449-464. [PubMed] [DOI] |
| 2. | Heike M, Frenzel C, Meier D, Galle PR. Expression of stress protein gp96, a tumor rejection antigen, in human colorectal cancer. Int J Cancer. 2000;86:489-493. [PubMed] [DOI] |
| 3. | Peibin Y, Shude Y, Changzhi H. Heat shock protein gp96 and cancer immunotherapy. Chin Med Sci J. 2002;17:251-256. [PubMed] |
| 4. | Liu C, Ewing N, DeFilippo M. Analytical challenges and strategies for the characterization of gp96-associated peptides. Methods. 2004;32:32-37. [PubMed] [DOI] |
| 5. | Linderoth NA, Popowicz A, Sastry S. Identification of the peptide-binding site in the heat shock chaperone/tumor rejection antigen gp96 (Grp94). J Biol Chem. 2000;275:5472-5477. [PubMed] [DOI] |
| 6. | Gazit G, Lu J, Lee AS. De-regulation of GRP stress protein expression in human breast cancer cell lines. Breast Cancer Res Treat. 1999;54:135-146. [PubMed] [DOI] |
| 7. | Wu YD, Song JD. The expression of glucose regulated protein-94 in colorectal carcinoma cells treated by sodium butyrate. Cell Res. 2000;10:115-125. [PubMed] [DOI] |
| 8. | Tanaka K, Kondoh N, Shuda M, Matsubara O, Imazeki N, Ryo A, Wakatsuki T, Hada A, Goseki N, Igari T. Enhanced expression of mRNAs of antisecretory factor-1, gp96, DAD1 and CDC34 in human hepatocellular carcinomas. Biochim Biophys Acta. 2001;1536:1-12. [PubMed] [DOI] |