修回日期: 2004-04-20
接受日期: 2004-04-29
在线出版日期: 2004-08-15
目的: 研究A-NK细胞体外抗肿瘤作用及小鼠体内抗肿瘤作用.
方法: 用淋巴细胞分离液分离健康人外周血中的血单个核细胞, PME(5 mmoL/L)室温处理40 min, PME处理后的人外周血单个核细胞重悬于AIMV中. 分为四组分别为: IL-2 (6 MU/L)组, IL-2(1MU/L)组, IL-12(5 μg/L) 组, IL-2 (1 MU/L)+IL-12(5 μg/L)组; 每瓶细胞浓度为5×109/L, 于37 ℃, 50 mL/L CO2饱和湿化空气的培养箱中水平培养4-5 h, 移去含未黏附于塑料表面的细胞悬液, 收集黏附于塑料表面的细胞(即A-NK细胞), MTT比色法检测A-NK细胞体外细胞毒作用; 然后建立肝癌细胞株裸鼠皮下移植瘤模型, 以肿瘤体积、抑瘤率、生存期等指标观察A-NK对移植瘤的抑制作用.
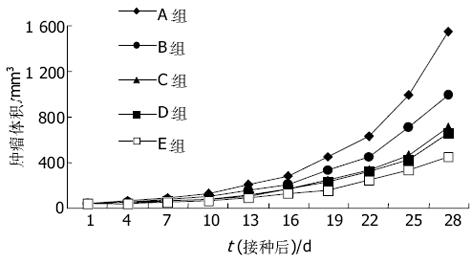
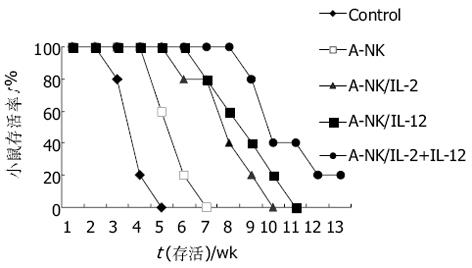
结果: A-NK+IL-2+IL-12组细胞毒活性明显高于其他三组(aP<0.05), 体内实验表明A-NK+IL-2+EL-4/IL-12治疗组的移植瘤生长速度缓慢, 体积明显小于生理盐水对照组(bP<0.05), 生存期显著延长(cP<0.05).
结论: IL-12辅助IL-2激活的A-NK细胞的体外杀伤活性较单独用IL-2或IL-12强, 体内实验显示具有明显的抗肿瘤作用.
引文著录: 赵东陆, 王志华, 张春艳, 杨悦. IL-2联合IL-12激活A-NK细胞治疗人肝癌HepG-2. 世界华人消化杂志 2004; 12(8): 1959-1961
Revised: April 20, 2004
Accepted: April 29, 2004
Published online: August 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1959-1961
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1959.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1959
黏附性淋巴因子激活的杀伤细胞(A-LAK). 其多数为CD3- CD56+的NK, 约占A-LAK 的76%, 而LAK主要为CD3+ CD56- 的T细胞. 1990年以后, 研究者们多以A-NK(IL-2 activated natural killer cells 或adherent natural killer cells)代替A-LAK这个名称. A-NK具有体外增生力强, 抗肿瘤能力强等特点, 成为更具发展潜力, 更有前途的一类免疫细胞.
6-8周龄BALB/C裸鼠25只; 雌雄兼用, 购自中国医科大学实验动物部(许可证号: SCXK(辽)2003-0009); 人肝癌细胞株HepG-2, 为本所常规液氮冻存. EL-4/IL-12为本所构建并常规液氮冻存, 其表达量为30.75 fg/24 h. RPMI1640培养基、DMEM培养基、无血清培养基(AIMV)(Gibco); 标准胎牛血清(天津血研所); MTT(四甲基偶氮唑蓝)购自华美生物制品有限公司; DMSO(天津大茂化学仪器供应站); 淋巴细胞分离液(中国医学科学院血液学研究所); PME(Sigma); PBS(灏洋生物); rhIL-2购自北京瑞得合通药业有限公司; IL-12由美国国立健康研究中心吴长有博士惠赠; 96孔培养板(costar); 酶标仪BioRAU, 450型, 美国制造. 健康人外周血(哈尔滨红十字中心血站提供)单个核细胞的制备肝素抗凝健康人外周血, 用PBS 2倍稀释后, 用人淋巴细胞分离液进行密度梯度离心, 2 000 r/min, 20 min, 吸取中间界面层的单个核细胞用PBS洗涤3次. 置于塑料管中用PME(5 mmoL/L)室温处理40 min (5×109/L), 以去除B细胞和单核巨噬细胞, 再用PBS洗涤3次备用.
A-NK细胞的诱导用PME处理后的人外周血单个核细胞重悬于AIMV中, 每瓶细胞浓度为5×109/L, 分为四组: 甲组: AIMV, IL-2(终浓度为6 MU/L); 乙组: AIMV, IL-2(终浓度为1 MU/L); 丙组: AIMV, IL-12(终浓度为5 μg/L); 丁组: AIMV, IL-2(终浓度为1 MU/L), IL-12(终浓度为5 μg/L). 于37 ℃, 50 mL/L CO2饱和湿化空气的培养箱中水平培养4-5 h, 移去含未黏附于塑料表面的细胞悬液, 收集黏附于塑料表面的细胞(即A-NK细胞), 每隔2 d换液: 50%自体条件培养基, 50%新鲜培养液, 甲组不继续加细胞因子, 其他各组IL-2或IL-12终浓度不变. 不同培养时间的A-NK细胞体外杀伤活性的检测 采用改进的四甲基偶氮唑盐(MTT)比色法. 设立效应细胞和靶细胞共同孵育孔(E+T), 效应细胞对照孔(E)和靶细胞对照孔(T), 每组设3个复孔. 靶细胞HePG-2在加样前24 h常规消化传代, 取1×107/L HepG-2细胞悬液100 μL/孔加入96孔平底培养板中, 于培养的第3, 5, 7, 和10 d分别取A-NK细胞, 充分洗涤, 按100: 1的效靶比每孔再加入100 μL浓度为1×109/L的效应细胞(A-NK). 37 ℃ 5 mL/L CO2培养箱中培养24 h, 每孔加入20 μL MTT, 37 ℃ 5 mL/L CO2培养箱中再培养4 h, 然后翻板, 每孔滴加100 μL DMSO轻轻振荡10 min后在酶标仪上570 nm处测定吸光度(A值), 取3孔均值, 公式如下: 细胞杀伤活性(%) = [1-(AE+T - AE)/AT] ×100. 荷瘤小鼠模型的建立及体内抗肿瘤实验研究取对数生长期HepG-2细胞, 用RPMI 1640洗2遍后, 以1×109/L重悬于RPMI1640中, 每只BALB/C小鼠右侧背部皮下接种0.1 mL即1×105个HepG-2细胞, 10 d后荷瘤小鼠随机分为5组, 每组5只. 甲乙丙丁各组细胞用AIMV洗2遍后, 以5×109/L重悬于AIMV中, 分别于左侧背部皮下接种: A组: 生理盐水; B组: 5×105个甲组细胞/只; C组: 5×105个乙组细胞/只, IL-2 6 MU/只; D组: 5×105个丙组细胞/只, EL-4/IL-12细胞5×105/只; E组: 5×105个丁组细胞/只, IL-2 6MU/只, EL-4/IL-12细胞5×105/只. 每隔2 d一次, 共治疗3次. 肿瘤生长速度测定和小鼠存活期的观察从治疗的第1 d开始, 采用游标卡尺测量小鼠皮下肿瘤大小, 每隔2 d一次, 绘制肿瘤生长曲线, 记录小鼠的存活期. 肿瘤体积 = (长径×短径2) π/6.
统计学处理 根据数据性质不同采用t检验和方差分析, 均以P<0.05为有统计学意义.
丁组A-NK细胞的杀伤活性均明显高于甲、乙、丙组A-NK细胞(aP<0.05, 表1). 说明IL-2 联合IL-12可以高效激活A-NK细胞, 降低IL-2的用量.
肝癌是我国最常见的恶性肿瘤之一[1-10], 自1990年代以来肝癌的年死亡率逐年上升, 已成为城市和农村的第二位和第一位[11]. 肝癌手术、化疗、放疗疗效差, 积极探索有效的抗癌新途径是肝癌治疗研究的重要方向, 基因治疗和生物治疗是目前的研究热点[12-17], 其中过继免疫疗法(adoptive immunotherapy, AIT)的基础研究和临床应用倍受重视. A-NK细胞由于其体外增生和抗肿瘤能力强, 对正常细胞无杀伤作用等优点, 成为近年来肿瘤过继免疫疗法的研究热点. 苯丙氨酸甲酯(PME)可有效去除单核巨噬细胞而不改变淋巴细胞的表型和细胞毒性, 减少肿瘤细胞产生的免疫抑制因子, 拮抗肿瘤细胞对于生物治疗疗效的抑制, 从而发挥协同抗瘤作用. 是一种简便快速的制备A-NK的方法. 郑宁et al[18-19] 采用此法获得的肝癌患者A-NK, 其增生活性和杀伤能力都有所增强, 并且提出, 苯乙酸(PA)是苯丙氨酸在人体内的自然代谢产物之一, 他对多种肿瘤都具有抑制肿瘤细胞生长, 促进诱导分化的作用. 由于完全培养基中添加血清存在安全性低、不易质控等缺点, 无血清培养基则可达到生物洁净要求, 成分明确, 质量稳定, 便于质控, 得到越来越广泛的应用. 多数研究表明, 无血清培养基可替代含血清的完全培养基, 二者所得培养物的数目和功能相当[20-21].
我们根据本课题组以往的研究成果, 改用IL-2(1 MU/L)联合IL-12(5 μg/L)获得了较高的杀伤活性, 此方法可明显降低IL-2的用量, 从而降低了大量应用IL-2所引起的毒副作用[22-24]. 同时, IL-12具有促进NK细胞的杀伤水平和黏附分子的表达, 调节淋巴细胞增生, 刺激NK细胞产生, 并与IL-2有协同作用[25-27]. 大量研究表明, IL-12具有较强的抗肿瘤作用, 且能抑制肿瘤的复发[28-30]. IL-2联合IL-12激活时间短, 减少了患者等待的时间. 实验结果显示A-NK细胞能够显著抑制皮下肿瘤生长并延长荷瘤小鼠的存活期. 目前A-NK仍限于基础实验研究, 国内外的临床试验开展的并不多, 本研究为A-NK的进一步研究和临床的应用推广提供了一定的理论依据和实验依据.
编辑: N/A
| 2. | Zhao WH, Ma ZM, Zhou XR, Feng YZ, Fang BS. Prediction of recurrence and prognosis in patients with hepatocellular carcinoma after resection by use of CLIP score. World J Gastroenterol. 2002;8:237-242. [PubMed] |
| 3. | Li G, Ma HH, Lau GK, Leung YK, Yao CL, Chong YT, Tang WH, Yao JL. Prevalence of hepatitis G virus infection and homology of different viral strains in Southern China. World J Gastroenterol. 2002;8:1081-1087. [PubMed] [DOI] |
| 4. | Tang ZY, Sun FX, Tian J, Ye SL, Liu YK, Liu KD, Xue Q, Chen J, Xia JL, Qin LX. Metastatic human hepatocellular carcinoma models in nude mice and cell line with metastatic potential. World J Gastroenterol. 2001;7:597-601. [PubMed] |
| 5. | Li Y, Tang ZY, Ye SL, Liu YK, Chen J, Xue Q, Chen J, Gao DM, Bao WH. Establishment of cell clones with different metastatic potential from the metastatic hepatocellular carcinoma cell line MHCC97. World J Gastroenterol. 2001;7:630-636. [PubMed] |
| 6. | Song ZQ, Hao F, Min F, Ma QY, Liu GD. Hepatitis C virus infection of human hepatoma cell line 7721 in vitro. World J Gastroenterol. 2001;7:685-689. [PubMed] |
| 7. | Cui J, Zhou XD, Liu YK, Tang ZY, Zile MH. Abnormal beta-catenin gene expression with invasiveness of primary hepatocellular carcinoma in China. World J Gastroenterol. 2001;7:542-546. [PubMed] [DOI] |
| 8. | Rabe C, Pilz T, Klostermann C, Berna M, Schild HH, Sauerbruch T, Caselmann WH. Clinical characteristics and outcome of a cohort of 101 patients with hepatocellular carcinoma. World J Gastroenterol. 2001;7:208-215. [PubMed] [DOI] |
| 12. | 杜 清友, 王 福生, 徐 东平, 刘 洪, 雷 周云, 刘 明旭, 王 业东, 陈 菊梅, 吴 祖泽. 新型免疫活性细胞CIK体外对肝癌细胞的杀伤. 世界华人消化杂志. 2000;8:863-866. [DOI] |
| 15. | Bremers AJ, Parmiani G. Immunology and immunotherapy of human cancer: present concepts and clinical developments. Crit Rev Oncol Hematol. 2000;34:1-25. [PubMed] [DOI] |
| 16. | Cheng JD, Rieger PT, von Mehren M, Adams GP, Weiner LM. Recent advances in immunotherapy and monoclonal antibody treatment of cancer. Semin Oncol Nurs. 2000;16:2-12. [PubMed] [DOI] |
| 17. | Kobari M, Egawa S, Shibuya K, Sunamura M, Saitoh K, Matsuno S. Effect of intraportal adoptive immunotherapy on liver metastases after resection of pancreatic cancer. Br J Surg. 2000;87:43-48. [PubMed] [DOI] |
| 18. | 郑 宁, 叶 胜龙, 孙 瑞霞, 赵 燕, 汤 钊猷. 肝癌患者A-LAK细胞与苯乙酸协同抗瘤的观察. 中国肿瘤生物治疗杂志. 2001;8:31-33. |
| 19. | Zheng N, Ye SL, Sun RX, Zhao Y, Tang ZY. Effects of cryopreservation and phenylacetate on biological characters of adherent LAK cells from patients with hepatocellular carcinoma. World J Gastroenterol. 2002;8:233-236. [PubMed] |
| 20. | 孙 婧, 陈 红松, 高 燕, 王 松霞, 张 毅, 王 宇. 无血清培养基与完全培养基对体外诱导免疫细胞支持作用的比较. 中国肿瘤生物治疗杂志. 2001;8:208-212. |
| 21. | 张 彦, 王 志华, 张 春艳. 无血清培养基与完全培养基对体外激活的A-NK细胞支持作用的比较. 中国肿瘤生物治疗杂志. 2003;10:38. |
| 22. | Hoffman DM, Gitlitz BJ, Belldegrun A, Figlin RA. Adoptive cellular therapy. Semin Oncol. 2000;27:221-233. [PubMed] |
| 23. | Melder RJ, Whiteside TL, Vujanovic NL, Hiserodt JC, Herberman RB. A new approach to generating antitumor effectors for adoptive immunotherapy using human adherent lymphokine-activated killer cells. Cancer Res. 1988;48:3461-3469. [PubMed] |
| 24. | Schwarz RE, Vujanovic NL, Hiserodt JC. Enhanced antimetastatic activity of lymphokine-activated killer cells purified and expanded by their adherence to plastic. Cancer Res. 1989;49:1441-1446. [PubMed] |
| 27. | Shin T, Nakayama T, Akutsu Y, Motohashi S, Shibata Y, Harada M, Kamada N, Shimizu C, Shimizu E, Saito T. Inhibition of tumor metastasis by adoptive transfer of IL-12-activated Valpha14 NKT cells. Int J Cancer. 2001;91:523-528. [PubMed] [DOI] |
| 28. | Kishida T, Asada H, Satoh E, Tanaka S, Shinya M, Hirai H, Iwai M, Tahara H, Imanishi J, Mazda O. In vivo electroporation-mediated transfer of interleukin-12 and interleukin-18 genes induces significant antitumor effects against melanoma in mice. Gene Ther. 2001;8:1234-1240. [PubMed] [DOI] |