修回日期: 2004-02-10
接受日期: 2004-02-21
在线出版日期: 2004-08-15
目的: 探索成体大鼠的骨髓间充质干细胞 (MSCs)的分离、体外培养方法, 观察采用不同的换液频度与细胞增生和生长的关系, 为其应用提供实验依据.
方法: 从大鼠股骨获取骨髓, 采用梯度离心的方法进行分离, 在含10 mL/L胎牛血清的DMEM中常规培养, 以MTT法检测不同的时间换液时细胞的生长曲线, 并用碱性磷酸酶 (AKP)检测的方法对分离的细胞进行鉴定.
结果: 采用梯度离心方法分离的骨髓间质干细胞的纯度较高, 细胞活性佳, AKP染色为强阴性. 首次换液后, 每天更换培养液比每隔3-4 d换液一次更有利于MSCs的增生, 原代长满培养瓶底比每隔 2-3 d换液一次平均提前2 d.
结论: 采用梯度离心的方法分离可获得纯度较高的骨髓间质干细胞, 是简单易行的分离方法, 每天更换培养液比每隔3-4 d换液一次更有利于MSCs的增生和形成形态均一的细胞集落.
引文著录: 张刚庆, 方驰华, 池达智. 大鼠骨髓间充质干细胞原代培养换液频度与细胞增生的关系. 世界华人消化杂志 2004; 12(8): 1953-1955
Revised: February 10, 2004
Accepted: February 21, 2004
Published online: August 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1953-1955
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1953.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1953
骨髓间质干细胞(mesenchymal stem cells, MSCs)在特定的条件下可以分化为多种组织和细胞[1-5], 并且外源基因易于导入和表达, 是潜在的基因治疗和干细胞研究的靶细胞. 本研究采用了梯度离心的方法分离间质干细胞, 并观察不同的更换培养液的频度与细胞增生、生长的关系, 以探索成体大鼠的骨髓 MSCs在体外分离、培养和增生较为简便、有效和实用的方法, 为其应用提供基础实验依据.
培养板、培养瓶(Sigma公司), SD大鼠(第一军医大学实验动物中心提供). 高糖DMEM、胎牛血清(Gibco.BRL公司). Percoll 分离液(Pharmacia 公司).
1.2.1 实验分组: 根据更换细胞培养液时间的不同分为三组: A组: 接种后每24 h更换培养液; B组: 接种后每48 h更换培养液; C组: 接种后每72 h更换培养液.
1.2.2 MSCs的分离: 用比重为 1.073 g/mL的percoll, 采用梯度离心的方法获取有核细胞, 调整细胞浓度为1×105个/mL, 分别接种于24孔、96孔培养板和25 mL培养瓶, 每孔或每瓶的细胞数和培养液量相同, 在相同培养条件下进行培养, 按实验设计分组的时间和方法更换培养液.
1.2.3 生长曲线绘制: 自培养24 h开始, 每天随机分别取各组细胞4孔, 以MTT比色法测定生长曲线[6].
统计学处理 SPSS软件, 采用方差分析.
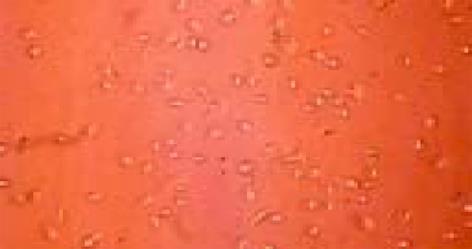
倒置显微镜下观察, 采用 Percoll梯度分离液分离成体大鼠的骨髓, 所获得的细胞绝大部分为球形的 MSCs, 其他细胞少见, 各组细胞进行AKP染色, 均呈阴性.接种后24 h内, 单个核细胞贴壁. 48 h可见部分已贴壁的细胞开始分裂增生, 细胞形态多样: 三角形、梭形、圆形等(图1). 5-7 d, 贴壁细胞体积增大, 可见多核的成纤维样细胞, 细胞有长杆状、三角形、多边形细胞等(图2). 在细胞生长增生过程中, A组细胞增生明显, 生长状态均最好, B组次之、C组细胞增生较慢, 细胞生长状态也较差. 培养第10-12 d, 细胞开始形成形态较为均一的细胞增生集落, 呈梭形或多角形, A组细胞生长增生减慢, B、C组细胞增生相对加快.
更换培养液的频度不同, 细胞的增生过程和形态变化时间不同, A组的细胞生长增生较快, 平均比B、C组达到的同样细胞数提前2-3 d. 统计学检验, A组与B、C组之间差异显著(P<0.05), B组与C组之间的差异不显著(P>0.05)(3图). 每日更换培养液的细胞生长状态好于每3 d更换培养液的细胞的生长状态.
骨髓间充质干细胞具有极强的自我复制能力和多向分化潜能, 具有独特的细胞增生分裂模式, 使外源基因易于导入和表达, 而使其成为潜在的基因治疗靶细胞[2], 是细胞治疗的基础. 但困扰MSCs广泛应用的主要原因是, 较高纯度的 MSCs的获取方法、培养增生方法和增生时间. 目前对于骨髓中的 MSCs的分离纯化的方法主要有: 贴附细胞分离法、流式细胞分离、免疫磁珠分离、梯度离心分离[7-8]. 每种方法各有优缺点: 贴附细胞分离法, 简单, 易操作, 但所得细胞的成分复杂, 骨髓 MSC的纯度有限; 流式细胞仪、免疫磁珠分离, 获得的MSCs纯度较高, 但操作繁杂, 需要昂贵的仪器和试剂, 成本较高, 并且对细胞的活性影响较大; 梯度离心分离, 操作方法简单, 实验结果证明可取得较高纯度的 MSCs. 目前对于骨髓间质干细胞的检测鉴定尚无特定的方法和特异性指标, 应用较多的是采用AKP染色法[9]. 本实验各组培养所得的细胞, 经AKP染色, 均呈阴性, 但各组之间尚存在一定差异, 特别是经过加大培养过程中的更换培养液的频度, 每天更换培养液, 可使获得的MSCs的纯度进一步得到提高.
本实验采用 Percoll梯度分离液行离心分离的方法, 成体大鼠的骨髓 MSCs分离后, 经体外培养能大量增生, 并形成细胞形态较为均一的细胞增生集落. 骨髓 MSCs的培养生长曲线显示, MSCs在体外培养条件下生长与其他细胞一样经历了生长缓滞期、对数增生期和生长平稳期. 从生长曲线可以看出, 当细胞增生到一定程度, 当细胞长满培养器皿的整个底部时, 细胞的增生放慢, 可能是细胞间的接触、生长空间缺乏所致. 不同的更换培养液的频度对细胞的生长增生有不同的影响, 每天更换培养液, 细胞增生较快, 生长良好, 比目前国内外所报道的隔日或每3 d更换培养液早2-3 d达到细胞形态、大小均一和长满瓶底.其可能原因是, 每日更换培养液, 可尽早清除非帖壁细胞和生长较差贴壁不牢固的细胞, 消除其对贴壁的基质干细胞生长增生的影响; 每日更换培养液, 可清除培养液中的不利于基质干细胞生长增生的某些物质, 其进一步机制和原因有待于深入研究.
编辑: N/A
| 2. | Toma C, Pittenger MF, Cahill KS, Byrne BJ, Kessler PD. Human mesenchymal stem cells differentiate to a cardiomyocyte phenotype in the adult murine heart. Circulation. 2002;105:93-98. [PubMed] [DOI] |
| 3. | Orlic D, Kajstura J, Chimenti S, Limana F, Jakoniuk I, Quaini F, Nadal-Ginard B, Bodine DM, Leri A, Anversa P. Mobilized bone marrow cells repair the infarcted heart, improving function and survival. Proc Natl Acad Sci U S A. 2001;98:10344-10349. [PubMed] [DOI] |
| 4. | Bianco P, Riminucci M, Gronthos S, Robey PG. Bone marrow stromal stem cells: nature, biology, and potential applications. Stem Cells. 2001;19:180-192. [PubMed] [DOI] |