修回日期: 2004-04-01
接受日期: 2004-04-05
在线出版日期: 2004-08-15
目的: 探讨肝病患者血清酸性α-醋酸萘酯酶(acid alpha naphthyl aetate esterase, α-ANAE)及其同工酶的临床应用价值.
方法: 通过比色法测定血清ANAE总活性. ANAE同工酶的检测采用琼脂糖凝胶电泳法及聚丙烯酰胺凝胶电泳法.
结果: 肝病患者包括肝炎、肝硬化及肝癌血清ANAE含量均低于对照组, 肝硬化组及肝癌组明显低于肝炎组. 通过琼脂糖凝胶电泳法可以在肝病患者血清中检出两种ANAE同工酶异常谱形. 聚丙烯酰胺凝胶电泳可分离出更多ANAE同工酶谱带.
结论: 血清ANAE含量测定可作为评价肝细胞变性坏死、肝脏合成功能异常的一项血清学指标. 肝病患者血清中检出的异常ANAE同工酶谱带性质、组成及在临床应用上的价值还有待于进一步探讨.
引文著录: 肖芸, 王燕, 戴志敏, 张维, 廖若男. 肝病患者血清酸性α-醋酸萘酯酶及其同工酶的变化. 世界华人消化杂志 2004; 12(8): 1932-1933
Revised: April 1, 2004
Accepted: April 5, 2004
Published online: August 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1932-1933
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1932.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1932
酸性α-醋酸萘酯酶(acid alpha naphthyl aetate esterase, α-ANAE EC3.1.1.1 )是一种细胞溶酶体酶, 主要作用于短链脂肪酸使其发生水解. ANAE主要分布于肝、胰、肾、小肠、单核巨噬细胞及组织细胞内. 血清ANAE主要来源于肝脏内B酯酶. 由于对血清ANAE的研究报告较少, 人们对血清ANAE在肝病患者中的变化了解得也很少, 因此我们参考文献方法[1], 对86例肝病患者血清ANAE含量进行检测, 并采用琼脂糖凝胶电泳和聚丙烯酰胺凝胶电泳两种方法检测ANAE同工酶, 初步观察血清ANAE含量及其同工酶在肝病中的变化规律, 探讨其临床运用价值.
我院2003-10/12住院肝病患者86例, 其中肝炎20例, 肝硬化35例, 肝癌31例; 男45例, 女41例, 平均年龄54(27-76岁). 肝炎及肝硬化诊断标准符合中华医学会传染病与寄生虫病学分会、肝病学分会联合修订的病毒性肝炎防治方案[2], 肝癌诊断标准符合原发性肝癌的临床诊断与分期标准[3]. 正常对照为健康体检者53名, 男27名, 女26名, 平均年龄35(28-43岁). 静脉取血2 mL, 分离血清, 于4 ℃保存, 1wk内检测. 底物液: 2 moL/L α-醋酸萘酯(上海振兴化工厂). 终止液: 1.75 moL/L冰醋酸. 显色液: 1 mmoL/L固蓝B盐(上海化学试剂站进口分装). 标准液: 2 mmoL/L α-萘酚(湘中化学试剂开发中心). 聚丙烯酰胺凝胶电泳所需试剂: 3 mL/L THB(pH8.9), 0.5 moL/L THB(pH6.7), 360 g/L Acr-10 g/L Bis(Sigma), 100 g/L Acr-25 g/L, 50 g/L TeMed(AmresCo), 12.5 g/L APS, 20×甘氨酸-Tris电极缓冲液. 721分光光度计(上海申化仪器自控公司)、DYY-Ⅲ型水平电泳槽、DYCZ-24D型垂直电泳槽(北京市六一仪器厂)、凝胶成像系统: UVP公司.
比色法测定血清酸性α-醋酸萘酯含量参照文献[1]进行. 显色反应后用721分光光度计, 520 nm波长, 以空白管调零后读取测定管和标准管吸光度, 根据标准管吸光度及含量换算受检标本血清ANAE含量. 单位定义: 每升血清在37 ℃酶反应1 s产生1 μmoL α-萘酚为一个μKat/L. 琼脂糖凝胶电泳法检测ANAE同工酶参照黄志华方法[4], 略有改进. 电泳槽及载体缓冲液采用巴比妥-巴比妥钠缓冲液(pH8.6, μ = 0.06). 于10 g/L琼脂糖-PVP凝胶板上加样后, 胶面朝上置于电泳槽上, 两侧用三层纱布搭桥, 电泳槽两侧加入同等量电泳缓冲液. 电流2 mA/cm, 电压80V, 稳定通电50 min. 取下凝胶, 加入显色液(称取α-醋酸萘酯5 mg溶于0.2 mL丙酮中, 加0.1 moL/L pH6.2磷酸盐缓冲液10 mL, 固蓝B盐10 mg振摇过滤, 再加0.04 mL吐湿20). 置37 ℃水浴显色20 min, 再用30 mL/L冰醋酸漂洗, 待漂洗的胶面清晰后观察并照相保存. 聚丙烯酰胺凝胶电泳采用75 g/L聚丙烯酰胺凝胶垂直电泳, 分别配制分离胶和浓缩胶. 首先将分离胶灌入电泳槽中, 小心在胶面上叠加1 mm厚水层, 在灯光下聚合30 min后, 倾去水层, 再灌入浓缩胶, 装好样品梳, 继续聚合2 h. 取出样品梳, 每孔加样血清10 μL , 电泳槽中加入1×电极缓冲液后开始电泳, 电压160 V, 电泳40 min后, 取下胶板显色、固定(同琼脂糖凝胶电泳).
2.1 血清ANAE含量正常参考值(n = 53)为28.0±5.8 μKat/L (mean±1.96 SD). 在肝细胞受损时, 包括肝炎、肝硬化和肝癌, 患者血清ANAE含量均明显下降, 经t检验, 与对照组相比有极显著差异. 肝硬化组与肝癌组比较无显著性差异, 二者与肝炎组比较有差异(表1). 各肝病组患者血清ANAE阳性率分别为肝炎55.0%(11/20), 肝硬化85.7%(30/35), 肝癌90.3%(28/31). 经x2检验, 肝炎组与肝硬化组、肝癌组之间比较有显著性差异(P<0.05).
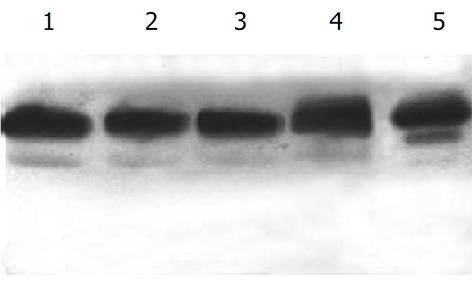
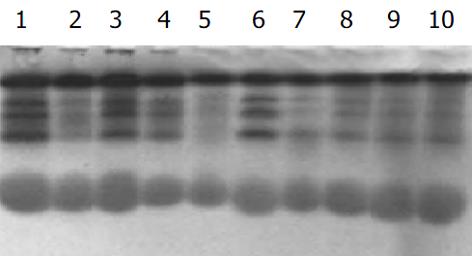
2.2 ANAE同工酶琼脂糖凝胶电泳检测按IUPAC/IUB建议从正极到负极分别用E1.2......表示相对电泳位置在位置, E1: Alb/a1, E2在a2位置, E3在a2/B位置. 血清α-ANE同工酶区带从阳极到阴极分别为E1, E2, E3, 色强度为E3>E1>E2, E1与E2几乎合并. 正常对照可见较明显的E1, E3带, E2带着色浅, 有的不易见(图1-带1). 受检的几组肝病中出现三种谱形(图1): 一种与对照相同(图1-带2, 3); 一种出现异常谱带(慢带), 靠近阳极端(图1-带4), 检出率为肝癌22.6%(7/31), 肝硬化20.0%(4/20), 肝炎5.0%(1/20); 还有一种谱形为E2色度增强(图1-带5), 仅在肝癌组中检出, 检出率为9.7%(3/31). 聚丙烯酰胺凝胶电泳检测ANAE同工酶采用75 g/L聚丙烯酰胺凝胶电泳, 经160 V 50 min电泳, 对照可分离出5条谱带(图2-1泳道). 肝病组的变化主要表现在中间区带, 表现为谱带色度减弱或出现异常谱带.
血清ANAE主要来源于肝脏内B酯酶. 当肝细胞变性、坏死和纤维化后, 血清中ANAE的活性下降[1]. 我们发现三组肝病患者血清ANAE含量均低于正常对照组, 且肝硬化和肝癌组又明显低于肝炎组. 但后二者比较无明显差异, 阳性率也较为接近(85.7%, 90.3%). 由于ANAE可作为T淋巴细胞的一个表面标志, 因此常用T淋巴细胞的ANAE活性来反映机体免疫功能. 动物实验和临床研究证明, 肿瘤患者的血清、癌组织匀浆上清液、腹水对T细胞的免疫反应有抑制作用. 当切除肿瘤而又无远处转移时, 可解除这种免疫抑制作用. 这可以解释本实验中肝癌组与肝硬化组比较无显著差异的原因, 且肝癌组并非所有患者血清ANAE含量都呈减低的表现. 为了检测ANAE同工酶, 我们采用琼脂糖凝胶电泳和75 g/L聚丙烯酰胺凝胶电泳方法分别进行检测. 正常人群的血清酸性α-ANE同工酶的谱形基本是恒定的, 肝病患者中除正常谱带外, 可检出两种异常谱带: 一是在阴极侧出现慢带, 另一异常是E2色度增强. 黄志华et al[4]研究肝癌时也检出了第一种异常谱带, 认为是E5带, 而同样也属于慢带的E4带不出现在肝癌中, 可在Ⅰ型重症糖尿病患者血清中检出. 本研究中出现此慢带异常的以肝癌组检出最多(22.6%), 其次为肝硬化组(20.0%)、肝炎组(5.0%). 另一异常谱带为E2色度增强, 仅出现在肝癌血清中, 检出率为9.7%. 应用聚丙烯酰胺凝胶电泳检测ANAE同工酶, 我们发现肝病组的变化主要表现在中间区带, 表现为谱带色度减弱或出现异常谱带. 有关ANAE同工酶的研究报道较少, ANAE同工酶及异常谱带的结构、组成及与疾病的关系还有待于进一步研究.
总之, 我们认为血清酸性α-醋酸萘酯酶活性在一定程度上可以反映肝功能损坏程度, 不同肝病时期该酶活性可能与机体免疫功能有关, 血清酸性α-醋酸萘酯酶含量测定可作为评价肝细胞变性坏死、肝脏合成功能异常的一项血清学指标. 琼脂糖凝胶电泳检测酸性α-醋酸萘酯酶同工酶, 在肝病患者血清中可以检出一些异常谱形. 有关各谱带的性质、组成及在临床上的参考价值还有待于进一步探讨.
编辑: N/A