修回日期: 2004-06-10
接受日期: 2004-06-17
在线出版日期: 2004-08-15
目的: 研究尾吊模拟失重状态下大鼠胃窦和空肠黏膜白介素2(interleukin-2, IL-2)及生长抑素(somatostatin , SS)免疫反应细胞的变化.
方法: 采用尾部悬吊模拟失重, 将大鼠分为悬吊14 d组和28 d组及相应同步对照组. 以免疫组织化学方法, 观察大鼠胃窦和空肠黏膜IL-2及SS免疫反应细胞的变化.
结果: 与正常对照组相比, 在胃窦部黏膜14 d尾部悬吊大鼠IL-2免疫反应细胞有下降趋势, 但统计学分析无明显差异, 28 d悬吊组则明显减少(P<0.01); 14 d和28 d悬吊组SS免疫反应细胞均明显减少(P<0.01). 与正常对照相比, 在空肠黏膜14 d及28 d悬吊组IL-2免疫反应细胞无明显变化(P>0.05); 14 d及28 d悬吊组SS免疫反应细胞减少(P<0.05及P<0.01).
结论: 模拟失重状态下, IL-2在大鼠胃窦部的表达下降, 在空肠变化不明显; 而SS在大鼠胃窦及空肠的表达均下降. 提示其免疫及内分泌功能发生了改变.
引文著录: 朱鸣, 吴本俨, 尤纬缔. 尾吊模拟失重大鼠胃肠道白介素2和生长抑素的表达. 世界华人消化杂志 2004; 12(8): 1880-1883
Revised: June 10, 2004
Accepted: June 17, 2004
Published online: August 15, 2004
AIM: To reveal the alterations of interleukin-2 (IL-2) and somatostatin (SS) immunoreactive cells in the gastric and jejunum mucosa of rats during simulated weightlessness.
METHODS: Experiments were conducted on 35 Sprague-Dawley rats. They were divided into 4 groups: suspended for 14 d (5 male and 5 female), control of 14 d (5 male and 5 female) and suspended for 28 d (10 male), control of 28 d (5 male). Tail-suspension (-30o) was used to simulate weightlessness. The change of IL-2 and SS immunoreactive cells in the gastric and jejunum mucosa of rats was examined by immunohistochemistry.
RESULTS: In the gastric mucosa, IL-2 immunoreactive cells in the 14 d tail-suspended rats were tended to decrease, but did not change significantly (P > 0.05). It decreased significantly in the 28 d tail-suspended rats (P < 0.01). SS immunoreactive cells decreased significantly both in the 14 d and the 28 d tail-suspended rats (P < 0.01). In the jejunum mucosa, IL-2 immunoreactive cells in the 14 d and 28 d tail-suspended rats both did not change significantly (P > 0.05). SS immunoreactive cells decreased significantly in both the 14 d and the 28 d tail-suspended rats (P < 0.05 and P < 0.01).
CONCLUSION: Decrease of IL-2 and SS cells is found in the gastric mucosa of rats under simulated weightlessness. SS cells are also decreased in jejunum mucosa, but IL-2 does not change significantly in it. The functions of immune and endocrine may be changed.
- Citation: Zhu M, Wu BY, You WD. Expression of interleukin-2 and somatostatin in gastric and jejunum mucosa in tail-suspended rats. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1880-1883
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1880.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1880
人类自从1961年已经有航天飞行的记录, 但是关于在宇宙飞行中神经内分泌及免疫系统反应的资料和数据仍较有限. 尽管内分泌和神经系统在调节机体的新陈代谢和自我平衡中起主要作用, 免疫系统对机体调节功能也不能忽视[1]. IL-2在免疫调节中起重要作用, 生长抑素是一种内分泌激素, 他存在于中枢神经系统、胃肠道和淋巴器官, 对免疫系统有广泛影响[2]. 我们以尾吊大鼠为模拟失重模型, 观察其胃窦和空肠黏膜中IL-2和SS表达的变化.
健康♂SD大鼠15只, 体质量250-300 g, 随机分为28 d实验组10只, 28 d同步对照组5只(标本取材于第四军医大学航空航天医学系实验室). 健康♂及♀SD大鼠各10只, 体质量250-300 g, 随机分为14 d实验组和14 d同步对照组各10只, 雌雄各半(标本取材于空军总医院动物实验室). 采用尾悬吊-30o作为模拟失重模型, 每只笼内悬吊一只大鼠, 尾部悬于笼顶, 使鼠的前肢踏于笼底的塑料棒上, 后肢悬空, 身体纵轴与水平面成30o. 对照组除不悬吊外, 其他条件与实验组相同. 兔抗IL-2抗血清, 武汉博士德公司提供, 工作浓度1: 50; 兔抗SS抗血清, 北京中山公司提供, 工作浓度1: 50. 二抗为北京中山公司提供的二步法免疫组化试剂PV-6001.
悬吊组和对照组分别于14 d和28 d悬吊结束时腹腔注射戊巴比妥钠(45 mg/kg)麻醉后开腹腔取出胃和空肠, 沿胃小弯及空肠纵轴剖开, 甲醛缓冲液固定标本, 按常规脱水、石蜡包埋, 3 μm切片. 采用二步法免疫组化检测. 切片经常规脱蜡至水, 用30 mL/L的过氧化氢孵育10 min, 用正常山羊血清封闭30 min, 滴加一抗, 室温过夜; TBS洗3次, 各5 min后, 滴加PV-6001, 37o孵育30 min, DAB显色, 苏木素复染, 甘油明胶封片, 显微镜下观察. 其中一抗为IL-2时需用微波修复. 阴性对照用和第一抗体同比稀释正常兔血清代替第一抗体染色. 在光学显微镜下分别计数胃窦部和空肠黏膜各免疫反应细胞的密度(阳性细胞百分比).
统计学处理 采用成组t检验比较悬吊组与对照组动物间的差异.
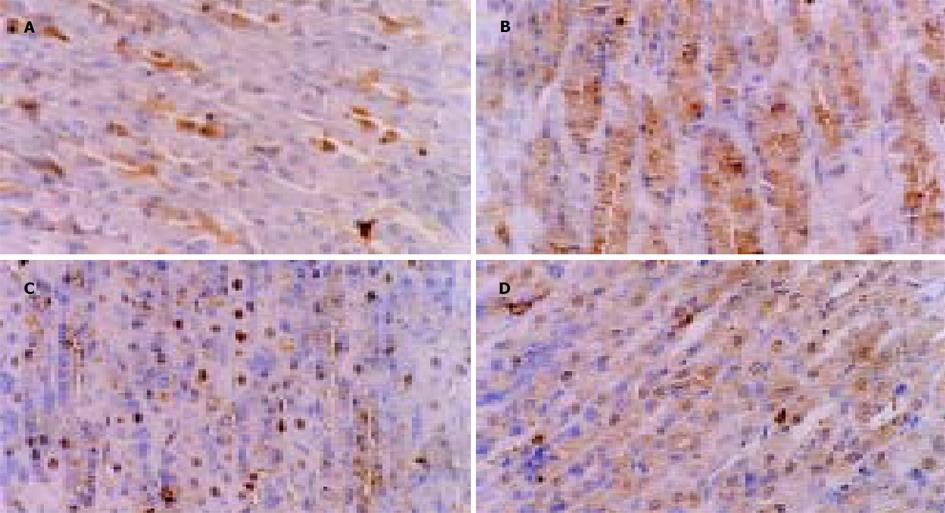
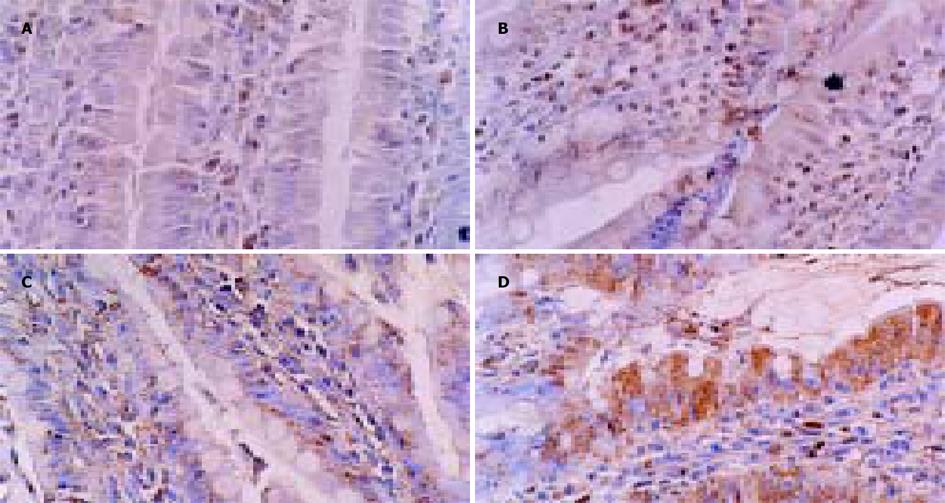
棕色颗粒分布于胃窦和空肠IL-2和SS免疫反应细胞的胞质或胞核内, 背景清晰. 胃窦部IL-2免疫反应细胞呈卵圆形或多边形, 多分布于胃窦腺上皮中下1/3(图1A, B); SS免疫反应细胞呈卵圆形、梭形或多边形, 多分布于胃窦腺上皮中上1/3(图1C, D), 悬吊组与对照组的分布相似. 空肠部IL-2免疫反应细胞呈梭形、长方形或多边形, 多分布于空肠黏膜中下1/3(图2A, B), SS免疫反应细胞呈梭形或长方形, 多分布于空肠黏膜中上1/3(图2C, D); 悬吊组与对照组的分布相似. 阴性对照切片未见特异性着色. 与正常对照组相比, 在胃窦部黏膜14 d尾部悬吊大鼠IL-2免疫反应细胞有下降趋势, 但统计学分析无明显差异, 28 d悬吊组明显减少(P<0.01); 14 d和28 d悬吊组SS免疫反应细胞均明显减少(P<0.01, 表1). 与正常对照相比, 在空肠黏膜14 d及28 d悬吊组空肠黏膜IL-2免疫反应细胞无明显变化(P>0.05); 14 d及28 d悬吊组SS免疫反应细胞减少(P<0.05及P<0.01, 表2).
由于航天飞行中多种因素的影响, 宇航员可能发生多种与免疫及内分泌功能失调有关的疾病. 但是, 太空实验受到多种条件限制, 而地面模拟失重实验具有经费少、样本大、实验条件易控制等优点, 可以预测、补充或证实航天中的一些变化[3]. Il-2是重要的细胞因子, 能同时增强体液免疫和细胞免疫应答, 但主要加强细胞免疫[4]. 消化系统恶性肿瘤患者血清可溶性IL-2受体水平较良性肿瘤及正常对照组明显增高[5]. IL-2对消化道肿瘤有一定疗效[6]. 消化性溃疡幽门螺杆菌(H. pylori )阳性组IL-2浓度明显低于H. pylori阴性组[7]. 以上研究说明IL-2与胃肠道疾病的发生及治疗有一定关联. SS是一种神经调节肽, 除在神经系统有分布外, 在胰腺、胃肠道、肾上腺、甲状腺等组织也有分布. SS在机体内可以抑制多种激素的分泌, 亦可作为神经递质和神经调节因子在中枢神经系统和外周组织发挥重要的生物学作用[8]. SS能抑制消化系肿瘤[9-10], 对胃黏膜也有较强地保护作用. 还能抑制多种外源性和内源性刺激引起的胰腺分泌, 因而用于治疗急性胰腺炎[11-12].
机体的内分泌和免疫系统之间存在着密切的相互作用[1], 有报道指出SS可导致T细胞分泌IL-2增加[13]. SS对IL-2的影响作用呈剂量依赖性, 低浓度对抗原诱导的T细胞释放IL-2没有影响, 在高浓度时可使IL-2的释放增加[2,14]. IL-2可升高SS水平[15-16]. SS和IL-2不仅在血中存在, 也存在于机体的胃肠道[17-18]. 我们通过对胃肠黏膜中SS及IL-2的研究表明, 14 d悬吊组大鼠胃窦部的IL-2呈下降趋势, 28 d悬吊组IL-2较对照组明显降低, 但是IL-2在空肠黏膜中变化不明显. 以往大多研究中模拟失重状态下IL-2是降低的. 如在2-12 mo的航天飞行中人IL-2的分泌下降[1]. 航天员由CD4+、CD8+、CD3+分泌的IL-2都明显下降[19]. 头低位模拟失重人IL-2的分泌明显下降[20]. 回转器模拟失重发现IL-2的基因表达下降[21]. 尾吊小鼠脾脏淋巴细胞悬液中IL-2减少[22-23]. 也有一些研究发现Il-2无明显变化[24-25]. 我们发现大鼠胃窦和空肠黏膜SS的表达均下降, 与傅春光et al[26]和王瑞安et al[27]的结果一致, 说明SS在模拟失重的早期在胃窦部已经开始下降; Sawchenko et al[28]的资料也显示, 宇宙飞行的大鼠在中枢部位SS的免疫染色减少. 而有报道宇航员在4 wk飞行后血中SS的分泌无变化[29], 沈冬云et al[30]以放免法测定头低位模拟失重15 d兔空肠SS的含量也未见明显变化. 这些结果的不尽相同, 可能与模拟失重的时间、失重模型和取材的部位不同有关. 由本实验推论, 模拟失重状态下大鼠胃肠道的免疫及内分泌功能可能发生了改变, 并且基本呈抑制状态. 至于IL-2 和SS的变化之间是否有关, 谁是始动因素, 如何相互作用, 还有待于进一步探讨. IL-2的改变与胃肠道疾病有一定关联, SS的改变可导致胃肠胰内分泌系统激素的变化, 从而引起胃肠道功能紊乱, 这些均有可能与胃肠道疾病的发生有关.
编辑: N/A
| 1. | Tipton CM, Greenleaf JE, Jackson CG. Neuroendocrine and immune system responses with spaceflights. Med Sci Sports Exerc. 1996;28:988-998. [PubMed] [DOI] |
| 4. | 甘 燕, 石 佑恩. 细胞因子类基因佐剂研究进展. 国外医学寄生虫病分册. 2004;31:6-11. |
| 7. | 许 英萍, 吕 宾. IL-2、IFN-γ在幽门螺杆菌感染中的作用研究. 杭州医学高等专科学校学报. 2002;23:77-79. |
| 13. | Levite M. Neuropeptides, by direct interaction with T cells, induce cytokine secretion and break the commitment to a distinct T helper phenotype. Proc Natl Acad Sci U S A. 1998;95:12544-12549. [PubMed] [DOI] |
| 14. | Cardoso A, el Ghamrawy C, Gautron JP, Horvat B, Gautier N, Enjalbert A, Krantic S. Somatostatin increases mitogen-induced IL-2 secretion and proliferation of human Jurkat T cells via sst3 receptor isotype. J Cell Biochem. 1998;68:62-73. [PubMed] [DOI] |
| 16. | 李 光辉, 曹 广文, 侯 建国, 潘 欣, 夏 广彬, 钱 松溪, 郑 家富, 戚 中田, 路 长林, 王 成海. 细胞因子对肾癌荷瘤裸鼠生长抑素的影响. 中华外科杂志. 1997;35:333-335. |
| 17. | 汪 毅, 黄 裕新, 许 才绂, 赵 国宁, 王 庆莉. 生长抑素、胃动素在人胎儿消化系统的发生与分布. 胃肠病学和肝病学杂志. 1998;7:13-16. |
| 19. | Crucian BE, Cubbage ML, Sams CF. Altered cytokine production by specific human peripheral blood cell subsets immediately following space flight. J Interferon Cytokine Res. 2000;20:547-556. [PubMed] [DOI] |
| 20. | Schmitt DA, Schaffar L, Taylor GR, Loftin KC, Schneider VS, Koebel A, Abbal M, Sonnenfeld G, Lewis DE, Reuben JR. Use of bed rest and head-down tilt to simulate spaceflight-induce immune system changes. J Interferon Cytokine Res. 1996;16:151-157. [PubMed] [DOI] |
| 21. | Walther I, Pippia P, Meloni MA, Turrini F, Mannu F, Cogoli A. Simulated microgravity inhibits the genetic expression of interleukin-2 and its receptor in mitogen-activated T lymphocytes. FEBS Lett. 1998;436:115-118. [PubMed] [DOI] |
| 24. | Nash PV, Mastro AM. Variable lymphocyte responses in rats after space flight. Exp Cell Res. 1992;202:125-131. [PubMed] [DOI] |
| 25. | Nash PV, Bour BA, Mastro AM. Effect of hindlimb suspension simulation of microgravity on in vitro immunological responses. Exp Cell Res. 1991;195:353-360. [PubMed] [DOI] |
| 28. | Sawchenko PE, Arias C, Krasnov I, Grindeland RE, Vale W. Effects of spaceflight on hypothalamic peptide systems controlling pituitary growth hormone dynamics. J Appl Physiol (1985). 1992;73:158S-165S. [PubMed] |
| 29. | Riepl RL, Drummer C, Lehnert P, Gerzer R, Otto B. Influence of microgravity on plasma levels of gastroenteropancreatic peptides: a case study. Aviat Space Environ Med. 2002;73:206-210. [PubMed] |