修回日期: 2003-11-12
接受日期: 2003-12-16
在线出版日期: 2004-08-15
目的: 应用肝硬化模型研究氨对大鼠脑细胞凋亡的影响, 以探讨氨在慢性肝性脑病时脑组织病理改变发生中的作用.
方法: 应用四氯化碳制备肝硬化动物模型, 给予模型乙酸胺负荷, 检测氨负荷前后血氨、肝功能水平; 同时应用TUNEL方法检测氨负荷前后脑细胞凋亡情况.
结果: 肝硬化动物模型肝功改变明显, 血氨增高155.74±12.70; 氨负荷后肝硬化血氨增高1699.17±181.34; 肝硬化氨负荷后脑细胞凋亡明显增多.
结论: 氨可能诱发肝硬化大鼠脑细胞发生凋亡.
引文著录: 刘洪艳, 王静艳, 雷薇, 闻颖, 刘沛. 氨对肝硬化大鼠模型脑神经细胞凋亡的影响. 世界华人消化杂志 2004; 12(8): 1865-1867
Revised: November 12, 2003
Accepted: December 16, 2003
Published online: August 15, 2004
AIM: To explore the effect of aminonia on neurocytic apoptosis in rat brain and to investigate the role of aminonia in changes of pathology of hepatic encepholopthy using the model of rat liver cirrhosis.
METHODS: A rat model of liver cirrhosis was developed by using carbontetrachloride, and then ammonium acetate was given. The blood ammonia and liver function were examined and neurocytic apoptosis in brain of the animal model were detected by TUNEL staining.
RESULTS: The levels of liver function and blood aminonia in the model were higher than those in control (155.74±12.7). After administration of ammonium acetate, the levels of blood amino were higher (1 699.17±181.34) and neurocytic apoptosis was more in brain in the rat model.
CONCLUSION: Aminonia may induce neurocytic apoptosis in rat liver cirrhosis.
- Citation: Liu HY, Wang JY, Lei W, Wen Y, Liu P. Apoptosis of neurocytes induced by ammonia in rat liver cirrhosis. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1865-1867
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1865.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1865
肝性脑病(hepatic encephalopathy, HE)是一种继发于肝炎、肝硬化和其他严重肝病, 以意识障碍为主要表现的神经精神综合征[1], 将亚临床肝性脑病计入在内, 发病率可达70%-75%, 其中部分患者发生记忆力减退、行动迟缓等大脑退行性改变, 甚至痴呆等表现. 在临床上, 部分慢性肝性脑病患者血氨明显增高, 其程度与患者所表现的神经系统早衰有一定关系, 但其病理学基础尚不清楚. 对肝硬化脑CT检查患者发现, 肝硬化肝性脑病存在患者不同程度的大脑皮质变薄和皮质下中枢萎缩. HE的发病机制尚不十分清楚, 大多数学者认为是多种因素综合作用的结果, 其中氨中毒学说是目前公认的较重要的发病机制. 我们以前的研究发现: 氨可以引起体外培养胚胎大鼠大脑皮质细胞的过度凋亡[2]. 我们在建立大鼠肝硬化模型的基础上, 给予氨负荷, 观察氨对大鼠脑神经细胞凋亡的影响, 以探讨血氨增高与脑神经细胞凋亡的关系.
健康♂Wistar大鼠50只, 质量180-220 g (由中国医科大学附属第二医院动物室提供). 喂食相同的饲料, 自来水为饮用水. 分析纯CCl4(沈阳医药公司化玻站分装厂), 橄榄油(深圳市以信工贸有限公司), 分析纯乙酸胺(大连医药公司), 硫喷妥钠(上海新亚药业有限公司). ALT检测试剂盒(上海复星长征医学科学有限公司), AST检测试剂盒(法国意杰有限公司), TBil检测试剂盒(日本纺绩株式会社), 血氨检测试剂盒(美中互利工业公司). 细胞凋亡检测试剂盒(武汉-博士德生物工程公司). 显微成像系统(日本奥林帕斯公司).
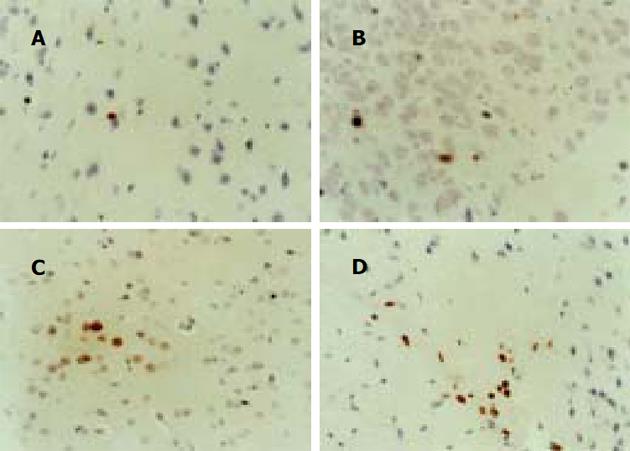
大鼠随机分为4组: (1)正常对照组(n = 10)不加外界干预因素; (2)正常氨负荷对照组(n = 10) 实验末给予氨负荷; (3)实验对照组(n = 15) 制备肝硬化模型, 不加外界干预因素; (4)实验组(n = 15) 制备肝硬化模型, 实验末给予氨负荷. 大鼠30只, 给予400 mL/L CCl4橄榄油0.2 mL/kg, ip, 2次/wk, 共12 wk; 正常对照组大鼠10只和正常氨负荷组大鼠10只给予同等量的橄榄油ip, 2次/wk, 共12 wk. 注射期间, 观察大鼠的毛色、精神状态、体重. 实验组在注射12 wk最后1次给药后2 d, 应用10 g/L硫喷妥钠(50 mg/kgip)麻醉后开腹, 经盲肠给予乙酸氨(500 mg/kg, 用0.5 mL蒸馏水稀释)[3]; 正常对照组及实验对照组经盲肠给予蒸馏水0.5 mL, 正常氨负荷对照组经盲肠给予乙酸氨, 用量同实验组. 各组大鼠在盲肠给药前及给药后20 min分别经内眦静脉用抗凝管采血0.6 mL并在30 min内检测血氨. 给药后2 h内观察大鼠的状态, 应用角膜反射及翻转反射的存在与否判断是否伴有肝性脑病的发生[4]. 2 h后处死大鼠, 处死前经心脏采血1 mL检测ALT、AST和TBil. 处死后立即取大脑及肝右叶组织, 应用40g/L多聚甲醛固定. 常规染色光镜下观察肝脏组织的改变, 以确定肝硬化模型是否形成, 观察脑组织的形态改变. 血氨应用vitros AMON 干片比色法测定; ALT应用IFCC方法测定; AST应用酶偶联连续监测方法测定; TBil应用亚硝酸酸化剂化学酸化方法测定(中国医科大学附属第二医院检验科协助检测). 脑细胞凋亡的检测用TUNEL法. 脑组织用40 g/L多聚甲醛固定24 h, 石蜡包埋. 玻片预先用多聚赖氨酸进行处理后制备切片. 切片常规脱蜡, 应用30 mL/L H2O2室温处理10 min后蒸馏水洗涤3次. 标本片加蛋白酶K (Proteinase K) 37 ℃消化15 min, TBS 洗涤3次后, 每张切片加标记液(TDT和DIG-d-UTP各1 μL, 加入18 μL标记缓冲液, 混匀后制得) 20 μL, 置切片于湿盒中, 37 ℃标记2 h. TBS洗涤3次后, 加封闭液, 室温30 min, 甩掉封闭液, 不洗. 用TBS1: 100稀释SABC后, 每张切片加20 μL, 37 ℃反应30 min, TBS洗涤4次后, DAB显色, 苏木素复染20-30 s, 脱水, 透明, 封片, 显微镜下观察. 凋亡细胞核呈深棕黄色, 并有染色质浓缩凝聚, 为深棕黄色, 紧贴核膜内面呈新月形或戒指状或呈固缩状; 有时胞核裂解成凋亡小体. 非凋亡细胞染色阴性, 呈淡蓝色. 于400倍光镜下从细胞数最多的视野开始, 计数每个视野阳性细胞占细胞总数的百分数-凋亡指数(apoptotic index, AI), 计数区域按从上到下, 从左到右的顺序计数; 共计10个视野1 000个细胞, 然后计算平均值.
统计学处理 实验数据以mean±SD表示, ALT, AST, TBil及0分血氨的比较应用方差分析, 20分血氨比较、AI比较分别采用t检验, P>0.05具有统计学意义.
实验对照组大鼠死亡8只, 实验组大鼠死亡6只, 肝硬化模型存活的大鼠毛色日益黯淡, 体重在0-4 wk增加, 4-8 wk下降, 8-12 wk又增加, 大鼠的活动迟缓, 反应迟钝, 进食量也减少. 实验组中有3只大鼠角膜反射与翻转反射消失, 证明出现肝性脑病; 正常对照组、正常氨负荷对照组及实验对照组角膜反射与翻转反射存在, 均未出现肝性脑病. 实验对照组有5只生成腹水, 实验组有6只生成腹水. 实验组及实验对照组肝小叶结构破坏, 纤维组织增生, 有明显硬化结节形成; 正常对照组及正常氨负荷对照组肝脏结构无改变; 实验组与对照组脑组织切片均未见明显异常.
2.1 血清ALT, AST, TBil实验组、实验对照组与正常对照组ALT, AST及TBil水平, 均具有显著性差异(表1), 说明肝硬化动物模型组肝功能有明显改变; 正常氨负荷对照组与正常对照组比较, 上述三种指标无差异.
肝硬化大鼠在未给氨负荷前就已经存在明显的血氨升高, 与正常对照组比较有显著差异(P<0.05); 给予氨负荷后, 实验组的血氨显著升高, 与实验对照组比较有非常显著差异(P<0.01), 与正常氨负荷组比较亦有非常显著差异(P<0.01), 说明肝硬化大鼠体内存在氨代谢紊乱. 当给予氨负荷后, 这种紊乱表现更加显著(表2).
许多学者发现HE患者虽然常规的精神功能检查正常, 但有智力检测及脑诱发电位异常[5]. 慢性HE可见特征性的Alzheimer Ⅱ型星形胶质细胞增生, 且随慢性肝病纤维化的进展而增多, 慢性肝病长期伴高氨血症可促使这种病理学改变发生. 在某些尸检中可见更明显的组织学损伤-肝脑变性. 除常见的星形胶质细胞外, 可有神经元和神经纤维的消失, 呈海绵状改变, 并有广泛缺血及坏死, 主要见于灰质区, 以基底神经节病变最为严重, CT可见明显的大脑皮质萎缩[6], 病理学检查可见大脑或小脑神经元消失, 其超微结构显示血脑屏障的通透性增加[7].
血氨的增加能干扰脑的能量代谢, 使脑组织中的ATP生成减少, 脑组织生理活动受到影响; 氨还能影响Na+-K--ATP酶的活性, 而破坏了血脑屏障的完整性, 又损害了膜的复极化; 同时干扰神经递质间的平衡, 导致中枢神经系统的功能紊乱; 氨也能使神经胶质细胞摄取谷氨酰胺盐缺陷, 造成细胞内谷氨酰胺大量堆积, 可使星型胶质细胞肿胀[8]. 高血氨可损伤脑细胞线粒体, 对培养神经元有一定的毒性作用[9]. 最近通过正电子发射X断层照相技术研究发现: HE患者脑组织内氨代谢增强, 血脑屏障对氨的通透性增加, 使氨容易进入神经系统[10]. 我们发现, 肝硬化大鼠已存在血氨升高, 而且对氨负荷耐受性下降, 给予氨负荷后, 血氨水平将更加显著升高, 再一次证实了氨在HE中的作用.
许多研究证实, 一些神经退行性疾病与神经细胞凋亡有关, 如早老性痴呆[11], 帕金森氏症[12], 脊柱肌肉萎缩[13], 肌萎缩性侧索硬化[14], 癫痫[15]. 我们发现, 氨可以使体外培养胚胎大鼠大脑皮质细胞过度凋亡[1]. 正常情况下, 脑细胞在未加任何处理因素时, 也可发生少量的细胞凋亡. 在给予氨负荷后, 实验组与实验对照组相比, 脑凋亡细胞数有所增加, 说明氨能够引起脑细胞凋亡; 实验组与正常给予氨负荷组比较, 两组的血氨水平存在明显差异, 脑细胞凋亡数也明显增加, 说明血氨越高, 细胞凋亡越明显. 本实验不仅进一步证实氨是能够诱发HE的一个因素, 而且发现氨可以促进脑细胞凋亡.
氨由于能够干扰脑的能量代谢, 这可能是氨引起肝性脑病的一个作用机制. 在氨浓度不断积累的过程中, 有可能通过细胞受体第二信使的传递, 影响相关基因调控蛋白的合成, 当这些效应达到一定阈值时, 将改变基因的表达. 由于凋亡的调节非常复杂, 他涉及众多的信号分子, 这些信号可以激活中心执行者: caspases(半胱氨酸天门冬氨酸蛋白酶)的级联放大, caspases一旦被激活, 即可引起脑神经细胞凋亡, 使部分神经元丢失或丧失功能, 出现临床上常见的神经系统早衰现象, 严重者产生神经精神症状甚至发生昏迷. 肝性脑病的发病机制非常复杂, 氨在其中是一个重要的致病因素, 我们的研究结果也证实了氨在HE发生时, 可能直接作用于脑神经细胞引起细胞凋亡, 为肝性脑病的病理改变提供了理论依据.
编辑: N/A
| 3. | 渡边 正義, 尾崎 孝幸, 平田 佳久, 吉国 義明, 木村 喜代史. 実験的肝性昏睡ラットモデルにおける血中およぴ腦 内アンモニア濃度ならびに昏睡に对するラクチト-ル(NS-4)の作用. 日薬理誌. 1995;105:97-109. |
| 4. | Bergqvist PB, Carpenedo R, Apelqvist G, Moroni F, Bengtsson F. Plasma and brain levels of oxindole in experimental chronic hepatic encephalopathy: effects of systemic ammonium acetate and L-tryptophan. Pharmacol Toxicol. 1999;85:138-143. [PubMed] [DOI] |
| 8. | Brensing KA, Textor J, Strunk H, Klehr HU, Schild H, Sauerbruch T. Transjugular intrahepatic portosystemic stent-shunt for hepatorenal syndrome. Lancet. 1997;349:697-698. [PubMed] [DOI] |
| 11. | Rose C, Michalak A, Rao KV, Quack G, Kircheis G, Butterworth RF. L-ornithine-L-aspartate lowers plasma and cerebrospinal fluid ammonia and prevents brain edema in rats with acute liver failure. Hepatology. 1999;30:636-640. [PubMed] [DOI] |
| 12. | Hetts SW. To die or not to die: an overview of apoptosis and its role in disease. JAMA. 1998;279:300-307. [PubMed] [DOI] |
| 13. | Thompson CB. Apoptosis in the pathogenesis and treatment of disease. Science. 1995;267:1456-1462. [PubMed] [DOI] |
| 14. | Antonsson B, Conti F, Ciavatta A, Montessuit S, Lewis S, Martinou I, Bernasconi L, Bernard A, Mermod JJ, Mazzei G. Inhibition of Bax channel-forming activity by Bcl-2. Science. 1997;277:370-372. [PubMed] [DOI] |
| 15. | Bredesen DE. Neural apoptosis. Ann Neurol. 1995;38:839-851. [PubMed] [DOI] |