修回日期: 2003-11-21
接受日期: 2003-12-08
在线出版日期: 2004-08-15
目的: 探讨胆囊内幽门螺杆菌(H. pylori)感染与胆囊炎发生的关系.
方法: 对手术切除的病理确诊为慢性胆囊炎的胆囊分为 H. pylori阳性组及 H. pylori阴性组, 因胆囊息肉行胆囊切除的病理证实无炎症的胆囊为对照组, 光镜观察 H. pylori 定植处黏膜上皮的变化及炎症情况、电镜观察胆囊上皮细胞超微结构变化、并检测组织炎症递质水平.
结果: 胆囊内有 H. pylori 感染的患者胆囊黏膜胃化生显著高于胆囊内无H. pylori 感染组, 胆囊内 H. pylori阴性组IL-1、IL-6、IL-8显著高于对照组, 胆囊内 H. pylori阳性组三项指标显著高于 H. pylori 阴性组及对照组.
结论: 胆囊内 H. pylori 感染可能是某些慢性胆囊炎的病因之一.
引文著录: 陈东风, 胡辂, 易萍, 刘为纹, 房殿春, 曹红. 胆囊幽门螺杆菌感染与胆囊炎的关系. 世界华人消化杂志 2004; 12(8): 1840-1843
Revised: November 21, 2003
Accepted: December 8, 2003
Published online: August 15, 2004
AIM: To study whether Helicobacter pylori (H. pylori) is associated with chronic cholecystitis.
METHODS: Chronic cholecystitis specimens confirmed by pathological analysis were divided into three groups: H. pylori infected group, H. pylori negative group and control group. The pathologic changes of cholecystitis were observed with light and electron microscopy, and the levels of interleukins (IL-1, IL-6 and IL-8) were also detected by radioimmunoassy.
RESULTS: Histological evidences of chronic choleystitis were found in the region where H. pylori colonized, including degeneration, necrosis, inflammatory cell infiltration, etc. Levels of interleukins (IL-1, 6, 8) in gallbladder homogenate were significantly higher in H. pylori-infected cholecystitis group than those in H. pylori -negative cholecystitis group and control group.
CONCLUSION: H. pylori virulence factor and interleukins may be involved in the pathogenesis of H. pylori -related cholecystitis.
- Citation: Chen DF, Hu L, Yi P, Liu WW, Fang DC, Cao H. Relationship between Helicobacter pylori and chronic cholecystitis. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1840-1843
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1840.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1840
幽门螺杆菌(Helicobacter pylori, H. pylori)在胃内有肯定的致病作用, 与胃炎、消化性溃疡病、胃癌有十分密切的关系[1-16], 既往研究发现H. pylori与胃肠外疾病和肝胆疾病有一定关系[17-25], 从我们的研究可知 H. pylori存在于胆囊, 并能从胆囊内分离培养出 H. pylori, 这说明胆囊内有活的 H. pylori存在, 那么, H. pylori与胆囊炎的关系值得研究. 本文通过电镜观察、免疫组化等方法就 H. pylori感染与胆囊炎的关系进行研究, 现报告如下.
选择81例慢性结石性胆囊炎患者, 根据以前研究、结合PCR扩增及 H. pylori培养结果, 将其分为胆囊 H. pylori感染阴性组59例, 胆囊 H. pylori感染阳性组22例做为研究组; 另选20例因胆囊息肉住院行胆囊切除术后胆囊非息肉区黏膜经病理活检证实无明显炎症, 并排除 H. pylori感染的患者作为对照组.
1.2.1 胆囊黏膜上皮细胞胃黏膜化生的观察: 采用AB/PAS黏液组织化学染色, 根据黏膜上皮组织学形态和细胞分泌黏液特点, 观察胆囊黏膜上皮细胞胃黏膜化生情况, 并观察 H. pylori 在胆囊黏膜上皮细胞表面的定植情况; 用W-S染色及抗 H. pylori抗体免疫组化染色, 光镜观察 H. pylori与胆囊上皮细胞的关系, 对慢性结石性胆囊炎患者手术切除胆囊标本, 用3%戊二醛固定, 包埋、切片, 透射电镜观察.
1.2.2 H. pylori与胆囊炎症关系: 采用光镜观察 H. pylori定植处胆囊黏膜上皮细胞的变化及炎症情况, 电镜观察胆囊上皮细胞超微结构变化.
1.2.3 胆囊黏膜匀浆白介素的测定: 所用白介素-1(interlukin-1, IL-1)、白介素6(IL-6)及白介素8(IL-8)放射免疫分析试剂盒来自北京东雅生物技术研究所. 取手术切除的胆囊黏膜组织约1 g , 加入超纯水(大坪医院外研所分子生物中心提供)用IS-1匀浆器(浙江医用机械厂)制成匀浆, 4 000 rpm 离心l5 min, 取上清液, -70 ℃冻存. 采用EC-1200放射免疫自动γ计数仪(中科院中佳公司)进行放免测定. 采用Beckman Synchron CX全自动生化测定仪(美国)进行胆囊黏膜匀浆蛋白定量.
统计学处理 数据用mean±SD表示, 资料分析采用x2检验和t检验.
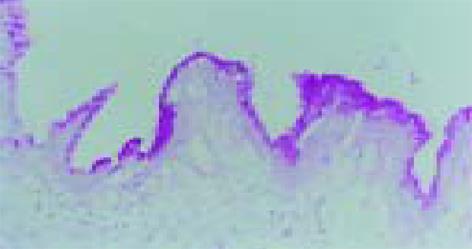
胆囊息肉患者非息肉区胆囊黏膜无PAS染色阳性黏液, 黏膜上皮细胞内无PAS阳性物质, 即无胃黏膜化生; 在慢性结石性胆囊炎患者中, 胆囊黏膜上皮呈柱状上皮细胞形态, AB/PAS染色显示中性黏液阳性, 呈现胃黏膜上皮细胞化生(图1).
慢性结石性胆囊炎患者胆囊黏膜出现胃上皮化生共25例, 占30.86%(25/81), 而对照组无1例出现胃化生(表1). 结果说明慢性结石性胆囊炎患者, 胆囊黏膜较易出现胃上皮化生, 其中胆囊内有 H. pylori感染的患者胆囊黏膜胃化生(18/22, 81.82%)显著高于胆囊内无 H. pylori感染组 (7/59, 11.86%, P<0.01), 提示胆囊黏膜胃化生可能与胆囊内 H. pylori感染有关.
| 分组 | n | 胃上皮化生 | 无胃上皮化生 |
| 对照组 | 20 | 0 | 20 |
| 慢性胆囊炎组 | |||
| 胆囊H. pylori (+) | 22 | 18 | 4 |
| 胆囊H. pylori (-) | 59 | 7 | 52 |
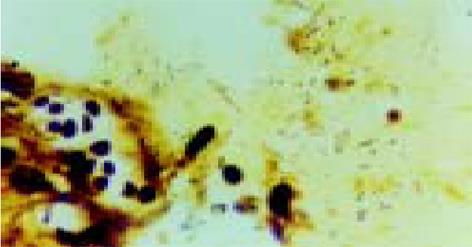
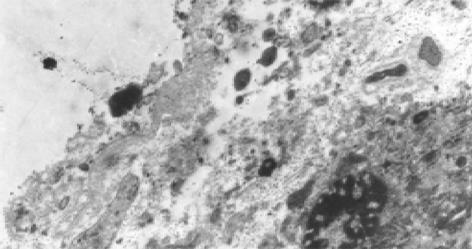
光镜下观察发现 H. pylori可以散在或密集存在于胆囊黏膜上皮细胞表面, 但也可与胆囊上皮细胞有一定距离, 个别进入上皮细胞或存在于细胞间隙, 有H. pylori存在的部位, AB/PAS染色常见柱状细胞分泌中性黏液, 显示胆囊黏膜有胃化生, 但 H. pylori所在之处也有部分无胃黏膜化生; 电镜观察 H. pylori存在于胆囊黏膜上皮细胞表面, H. pylori可与胆囊黏膜上皮细胞表面直接相贴, 也可以进入上皮细胞内, 但未见到他们之间形成紧密连接或借助菌毛与胆囊上皮细胞黏附的现象; 关于 H. pylori与胆囊炎的关系在光镜观察发现 H. pylori 存在之处胆囊黏膜上皮变性、炎细胞浸润、渗出及上皮细胞脱落, 也可出现黏膜层变薄, 上皮细胞减少, 腺体数目减少和消失等慢性炎症改变, 有时可见 H. pylori周围有炎细胞聚集, 且可见炎细胞变形正拟吞噬该菌的现象(图2), 没有 H. pylori 感染的慢性结石性胆囊炎患者大多数仅见少许炎细胞浸润, 上皮细胞完整, 但也能见到无 H. pylori感染者, 出现大量炎细胞浸润, 上皮细胞变性、坏死、脱落的急性炎症表现或出现腺体萎缩, 少许炎细胞浸润的慢性炎症表现; 在电镜观察有H. pylori感染的胆囊上皮细胞膜可出现细胞膜破坏, 细胞间连接松驰, 线粒体扩张、嵴减少或消失, 内质网扩张等变化, 其程度较无H. pylori感染者为重(图3).
2.3 胆囊黏膜匀浆IL-1、IL-6、IL-8水平, 以ng/克蛋白表示, 结果(见表2).
慢性胆囊炎患者胆囊内H. pylori (-)组IL-1、IL-6、IL-8水平显著高于对照组(P<0.01), 而胆囊内 H. pylori (+)组三项指标也显著高于对照组(P<0.01), 胆囊内 H. pylori(+)组IL-1、IL-6、IL-8水平与胆囊内H. pylori(-)组比较有显著性差异(P<0.01).
胆囊和胃同来源于内胚层, 组织结构相似, 其黏膜表面覆有黏液层 [26]. 研究发现AB/PAS染色显示约31%(25/81)的胆囊结石患者胆囊黏膜上皮细胞分泌中性黏液, 呈现胃上皮化生的表现; Caselli et al[27]也证实胆囊结石患者胆囊黏膜上皮细胞有胃化生, Roa et al[28]发现胆囊上皮细胞有胃蛋白酶原I、Ⅱ的表达; 胆囊黏膜胃化生的意义在于他为 H. pylori定植于胆囊提供了前提; 本研究结果表明胆囊内有 H. pylori感染的患者其胆囊黏膜上皮出现胃化生的比例显著高于胆囊内无 H. pylori感染的患者, 证明胆囊黏膜胃化生与胆囊内 H. pylori感染有密切关系; 本研究发现胆囊内虽有H. pylori感染, 但无胃化生的病例, 同样也有胆囊有胃化生而无H. pylori感染的病例; 这些结果说明胆囊内胃化生与胆囊内H. pylori感染二者并不是绝对的互为因果关系, 这可能是因为胃肠道许多上皮细胞都有H. pylori定植因子的受体, 因此, H. pylori可以定植于那些无胃化生的胆囊黏膜上皮细胞[29].
本研究还发现H. pylori与胆囊黏膜上皮细胞之间可相隔一定距离, 也可相互紧贴, 偶见H. pylori穿越胆囊上皮细胞, 提示H. pylori穿越细胞能力不强; 在H. pylori聚积处, 胆囊黏膜上皮细胞有变性、糜烂及坏死, 部分可见有炎细胞浸润, 局部H. pylori数量越多, 表现越明显; 电镜发现H. pylori感染处上皮细胞膜完整性破坏、线粒体肿胀, 内质网扩张, 符合细胞损伤的变化, 说明H. pylori在胆囊内的定植可以引起胆囊的炎症, 尤以慢性非化脓性炎症为主, 这些结果为H. pylori作为胆囊炎的病因之一提供了重要证据; H. pylori导致胆囊黏膜上皮细胞损伤的原因, 可能与H. pylori所特有的毒力因子如细胞毒素相关蛋白(CagA)、空泡毒素(VacA)以及H. pylori的尿素酶、脂多糖、黏液酶等有关[30].
H. pylori还可以通过介导炎症及免疫反应来损伤胆囊黏膜上皮细胞, 胆囊内无H. pylori感染组和有H. pylori感染组的胆囊黏膜匀浆IL-1、IL-6、IL-8含量均显著高于对照组(P<0.01), 这提示慢性结石性胆囊炎的发生有上述这三种细胞因子的参与; 本研究发现无论有无H. pylori感染的胆囊炎标本, IL-1、IL-6和IL-8水平显著高于对照组, 说明白介素可能参与慢性胆囊炎的发病过程, 这可能与H. pylori相关的胃炎、胃溃疡发病中白介素的作用一致[31-34]; H. pylori感染后, 他所分泌的尿素酶、脂酶、热休克蛋白等可以激活黏膜局部上皮细胞及血管内皮细胞表达IL-1、IL-6及其他细胞因子如ICAM-I等, 从而激活和趋化血管内的淋巴细胞、单核细胞黏附、游走进入H. pylori感染部位, IL-6通过其他细胞因子激活、诱导T细胞分化, 增加单核细胞、NK细胞杀伤靶细胞的功能, 可以引起H. pylori感染局部发生炎症、损伤; 研究己经证明H. pylori的CagA有强烈的刺激上皮细胞及其他细胞表达IL-8的作用, 而IL-8具有明显的激活和趋化中性粒细胞及淋巴细胞的作用 [21]. 本研究还发现, 有H. pylori感染的慢性胆囊炎患者胆囊黏膜IL-1、IL-6、IL-8显著高于无H. pylori感染的慢性胆囊炎标本, 说明H. pylori感染的确参与和加强了胆囊炎症反应, 使胆囊上皮细胞受到损伤, 出现慢性胆囊炎, 最终可导致胆囊上皮破坏, 胆囊萎缩[35-37]. 本研究提示胆囊内H. pylori感染可能是某些胆囊炎的病因之一, 其确切作用机制尚需进一步研究.
编辑: N/A
| 1. | Tsuji S, Kawano S. Peptic ulcer recurrence and Helicobacter pylori: evidence from Japan. J Gastroenterol. 2003;38:410-411. [PubMed] [DOI] |
| 3. | Guo XL, Wang LE, Du SY, Fan CL, Li L, Wang P, Yuan Y. Association of cyclooxygenase-2 expression with Hp-cagA infection in gastric cancer. World J Gastroenterol. 2003;9:246-249. [PubMed] [DOI] |
| 4. | Wang RT, Wang T, Chen K, Wang JY, Zhang JP, Lin SR, Zhu YM, Zhang WM, Cao YX, Zhu CW. Helicobacter pylori infection and gastric cancer: evidence from a retrospective cohort study and nested case-control study in China. World J Gastroenterol. 2002;8:1103-1107. [PubMed] [DOI] |
| 5. | Ren JM, Zou QM, Wang FK, He Q, Chen W, Zen WK. PELA microspheres loaded H. pylori lysates and their mucosal immune response. World J Gastroenterol. 2002;8:1098-1102. [PubMed] [DOI] |
| 6. | Ohara T, Kanoh Y, Higuchi K, Arakawa T, Morisita T. Eradication therapy of Helicobacter pylori directly induces apoptosis in inflammation-related immunocytes in the gastric mucosa--possible mechanism for cure of peptic ulcer disease and MALT lymphoma with a low-grade malignancy. Hepatogastroenterology. 2003;50:607-609. [PubMed] |
| 8. | D'Elios MM, Amedei A, Del Prete G. Helicobacter pylori antigen-specific T-cell responses at gastric level in chronic gastritis, peptic ulcer, gastric cancer and low-grade mucosa-associated lymphoid tissue (MALT) lymphoma. Microbes Infect. 2003;5:723-730. [PubMed] [DOI] |
| 9. | Konturek PC, Brzozowski T, Konturek SJ, Kwiecień S, Pajdo R, Drozdowicz D, Stachura J, Karczewska E, Hahn EG. Functional and morphological aspects of Helicobacter pylori-induced gastric cancer in Mongolian gerbils. Eur J Gastroenterol Hepatol. 2003;15:745-754. [PubMed] |
| 23. | Chen W, Li D, Cannan RJ, Stubbs RS. Common presence of Helicobacter DNA in the gallbladder of patients with gallstone diseases and controls. Dig Liver Dis. 2003;35:237-243. [PubMed] [DOI] |
| 24. | Leong RW, Sung JJ. Review article: Helicobacter species and hepatobiliary diseases. Aliment Pharmacol Ther. 2002;16:1037-1045. [PubMed] [DOI] |
| 25. | Monstein HJ, Jonsson Y, Zdolsek J, Svanvik J. Identification of Helicobacter pylori DNA in human cholesterol gallstones. Scand J Gastroenterol. 2002;37:112-119. [PubMed] [DOI] |
| 27. | Caselli M, Aleotti A, Navarra G, Carcoforo P, Cervellati F, Alvisi V. Cholesterol vesicles in areas of gastric metaplasia of gallbladder epithelium. J Submicrosc Cytol Pathol. 1996;28:251-253. [PubMed] |
| 28. | Roa I, Araya JC, Shiraishi T, Yatani R, Wistuba I, Villaseca M, de Aretxabala X. [Immunohistochemical demonstration of pepsinogens I and II in the gallbladder]. Rev Med Chil. 1992;120:1351-1358. [PubMed] |
| 29. | Lim JW, Kim H, Kim KH. Cell adhesion-related gene expression by Helicobacter pylori in gastric epithelial AGS cells. Int J Biochem Cell Biol. 2003;35:1284-1296. [PubMed] [DOI] |
| 30. | Atherton JC. H. pylori virulence factors. Br Med Bull. 1998;54:105-120. [PubMed] [DOI] |
| 31. | Straubinger RK, Greiter A, McDonough SP, Gerold A, Scanziani E, Soldati S, Dailidiene D, Dailide G, Berg DE, Simpson KW. Quantitative evaluation of inflammatory and immune responses in the early stages of chronic Helicobacter pylori infection. Infect Immun. 2003;71:2693-2703. [PubMed] [DOI] |
| 32. | Kamangar F, Limburg P, Taylor P, Dawsey S. Re: Helicobacter pylori and interleukin 1 genotyping: an opportunity to identify high-risk individuals for gastric carcinoma. J Natl Cancer Inst. 2003;95:760; author reply 760-760; author reply 761. [PubMed] [DOI] |
| 33. | Prystowsky JB, Rege RV. Interleukin-1 mediates guinea pig gallbladder inflammation in vivo. J Surg Res. 1997;71:123-126. [PubMed] |
| 34. | Yasoshima M, Kono N, Sugawara H, Katayanagi K, Harada K, Nakanuma Y. Increased expression of interleukin-6 and tumor necrosis factor-alpha in pathologic biliary epithelial cells: in situ and culture study. Lab Invest. 1998;78:89-100. [PubMed] |
| 35. | Morland CM, Fear J, Joplin R, Adams DH. Inflammatory cytokines stimulate human biliary epithelial cells to express interleukin-8 and monocyte chemotactic protein-1. Biochem Soc Trans. 1997;25:232S. [PubMed] [DOI] |
| 36. | Bäckhed F, Torstensson E, Seguin D, Richter-Dahlfors A, Rokbi B. Helicobacter pylori infection induces interleukin-8 receptor expression in the human gastric epithelium. Infect Immun. 2003;71:3357-3360. [PubMed] [DOI] |