修回日期: 2003-10-21
接受日期: 2003-11-06
在线出版日期: 2004-08-15
目的: 探讨幽门螺杆菌(H. pylori)在体外对人胆囊上皮细胞(HGBEC)的损伤作用.
方法: 采用液体增菌及人胆囊上皮细胞原代培养研究H. pylori对HGBEC的损伤作用.
结果: 从H. pylori 的生长曲线可知观察其他因素对HGBEC的影响在细胞生长最旺盛期即培养的2-6 d最为合适, H. pylori 增菌上清液及菌体破碎液对培养的HGBEC形态学及上清酶学指标ALP(33.84±6.00 vs 27.01±4.67, P<0.05), LDH (168.37±20.84 vs 55.51±17.17, P<0.01), GGT(42.01±6.18 vs 25.34±4.33 P<0.01)有明显影响.
结论: H. pylori 增菌上清液及菌体破碎液对培养的HGBEC有明显损伤作用.
引文著录: 陈东风, 胡辂, 易萍, 刘为纹, 房殿春, 曹红. 幽门螺杆菌对体外原代培养的人胆囊上皮细胞损伤作用. 世界华人消化杂志 2004; 12(8): 1835-1839
Revised: October 21, 2003
Accepted: November 6, 2003
Published online: August 15, 2004
AIM: To study the mechanism of Helicobacter pylori (H. pylori) damage to human gallbladder epithelial cells (HGBEC).
METHODS: H. pylori isolated from gallbladder were cultured in liquid medium, different concentration supernatants and sonicated extracts of H. pylori cell were added into HGBEC in primary culture. The morphous changes of the HGBEC were observed and the levels of ALP, LDH, and GGT were also examined.
RESULTS: According to the culture curve of HGBEC, it was convenient to study the changes of HGBEC by adding H. pylori sonicated extracts and H. pylori culture supenatents. Both of H. pylori sonicated extracts and H. pylori culture supenatents had significant influence on H. pylori morphous, HGBEC grew slowly, viability decreased, and detachment increased. Furthermore, cell rupture and died. The levels of ALP (33.84±6.00 vs 27.01±4.67, P < 0.05), LDH (168.37±20.84 vs 55.51±17.17, P < 0.01) and GGT(42.01±6.18 vs 25.34±4.33, P < 0.01) increased significantly in the HGBEC culture supernates, which was time-and concentration-dependent. The damage effects on HGBEC in H. pylori cultured liquid were stronger than in H. pylori sonicated extracts.
CONCLUSION: The culture supernates and sonicated extracts of H. pylori has obviously induced the damage to HGBEC.
- Citation: Chen DF, Hu L, Yi P, Liu WW, Fang DC, Cao H. Effects of Helicobacter pylori on human gallbladder epithelial cells in vitro. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1835-1839
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1835.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1835
胆囊炎的致病因素很多[1-6], 研究表明幽门螺杆菌(Helicobacter pyloric, H. pylori)可以引起胆囊定植部位黏膜损伤及炎症反应 [7-9], 为探明这些胆囊黏膜的炎症及损害是否确与H. pylori有关, 我们采用液体增菌及人胆囊上皮细胞原代培养方法探讨H. pylori 对人胆囊上皮细胞的损伤作用, 从而证明在临床胆囊炎的一些患者中, H. pylori是一种重要致病因素.
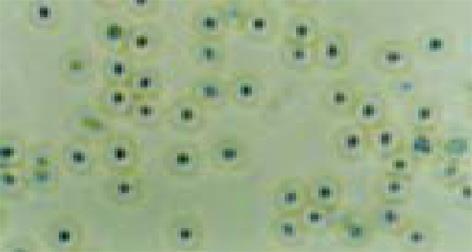
将从胆囊分离培养所得的H. pylori菌落挑转至改良布氏肉汤液体培养基中, 使终密度达到107/L, 然后将菌液移入三角形抽滤瓶中, 用真空脂密封瓶塞, 从抽滤口接橡皮管并行抽气和换气, 然后用止血钳夹闭橡胶皮管, 使瓶内氧50 ml/L; 置入THI-82型台式恒温振荡器(上海跃进医疗仪器厂)固定, 37 ℃, l50 r/min, 分别于24, 48, 72 h观察菌液混浊度, 并取菌液用721分光光度计测定A660值(1.0 A660约相当于1×1011/L)计算H. pylori密度, 涂片革兰染色观察细菌状态; 结合细菌密度及形态, 决定H. pylori生长最旺盛期, 然后停止液体增菌培养, 将细菌密度调至1011/L, 离心取上清液及沉淀, 分离冻存于-30 ℃待用; H. pylori在液体培养基中生长良好, 经过24-48 h的振荡培养可以达到1012-1013/L活菌密度, 此时细菌形态典型, 72 h后活菌密度减少, 细菌形态不典型, 出现较多球形体, 故取培养48 h用以研究较为合适; 人胆囊上皮细胞 (human gallbladder epithelial cell, HEBEC)经分离及原代培养后从HEBEC生长曲线中采用生长最旺盛期, 即培养6 d的体外原代胆囊上皮细胞进行研究[10](图1)最为合适; 另外, 将布氏汤加入培养的HGBEC中作为对照组.
将含1012/L H. pylori的增菌液用超纯水稀释成含H. pylori 1011/L, 离心所得上清液为原液, 再用超纯水稀释成1/10, 1/100浓度, 并用0.22 μm滤膜过滤后, -70 ℃冻存备用; 再将前述离心沉淀加超纯水将细菌调至1011/L, 然后用超声细胞破碎仪, 输出功率80 W, 1 min/次, 至革兰染色证实H. pylori菌体全部破碎为止, 并稀释成1/10, 1/100浓度, 再用0.22 μm滤膜过滤, -70 ℃冻存待用. 在细胞对数生长期, 加入不同浓度H. pylori增菌上清液各 150 μL、不同浓度H. pylori菌体破碎液及布氏肉汤各150 μL, 在加入后1, 2, 3及4 d分别观察细胞细胞形态、贴壁性变化, 且留取细胞培养上清液-30 ℃冻存, 在损伤最典型期收集细胞并用30 g/L戊二醛固定供电镜观察; 最后对细胞培养上清液酶学指标测定, 包括碱性磷酸酶(ALP)、乳酸脱氢酶(LDH)、谷胺酰转肤酶(GGT), 结果以nKat/L表示.
统计学处理 用SSAP10.0软件进行统计分析, 数据以mean±SD表示, 采用t检验, P<0.05差异显著.
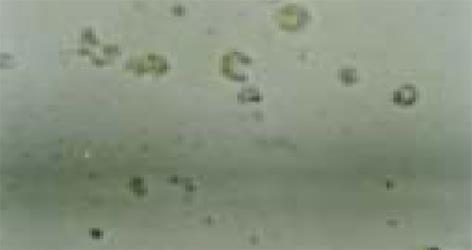
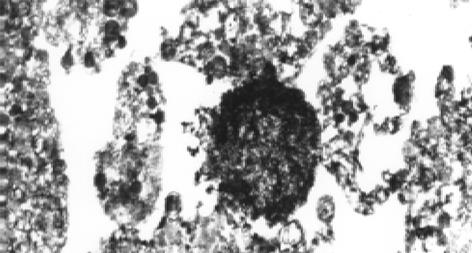
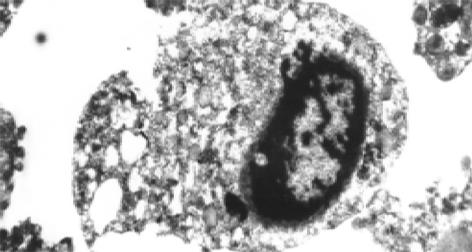
加入H. pylori增菌上清原液后2 d开始, 光镜下细胞分裂减少, 成片贴壁的HGBEC开始出现松动, 有解离趋向; 3 d 细胞数量明显减少, 胞质疏松, 分裂相减少, 出现较明显的空泡化, 细胞运动减慢, 核色加深, 4 d则见细胞破裂, 出现碎片, 也见细胞体积缩小, 核固缩, 细胞颜色变浅, 明显大小不一, 丧失黏附能力, 大量细胞死亡(图2); 将H. pylori上清菌液稀释后加入HGBEC中, 和加入此增菌原液组相比细胞损伤减轻, 存活时间延长, 贴壁持续时间较长; 加入 1/100 H. pylori上清液, 其细胞形态无明显变化, 也即1/100 H. pylori上清对HGBEC损伤作用不明显; 对照组 (加入布氏肉汤液)细胞变化与末加任何其他物质的HGBEC生长变化一致, 在7 d后才开始出现细胞活力减低, 数量逐渐减少, 于14 d培养的HGBEC全部死亡. 电镜观察发现加入H. pylori上清原液3, 4 d的HGBEC细胞零散、体积缩小, 胞质疏松肿胀, 线粒体肿胀可见到髓鞘样改变, 明显空泡化, 也可见到胞核固缩、染色质集聚, 分散成块, 局部区域胞核及核膜结构不完整, 甚至整个细胞核形成致密体, 乃至胞核结构消失, 细胞破碎(图3), 说明H. pylori上清液对HGBEC有明显的损伤作用, 空泡化明显, 该作用呈时间依赖性和剂量依赖性.
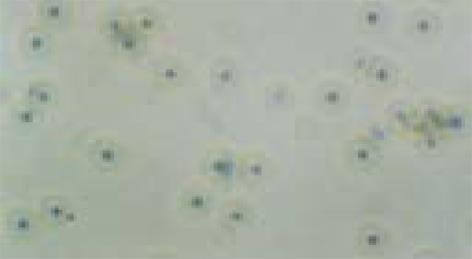
加入H. pylori菌体超声破碎原液后2 d起, 光镜下原代培养的HGBEC便开始出现细胞分裂减少, 但细胞形态尚无明显改变; 3 d出现贴壁细胞解离, 游离细胞运动减慢, 细胞形态开始出现变化, 随后可见细胞数量减少, 空泡化及HGBEC黏附性丧失, 细胞变形, 核固缩, 乃至细胞破裂、死亡, 但整个程度轻于H. pylori上清液的作用. 1/10的菌体破碎液对HGBEC有轻微损伤作用, 1/100则无明显损伤作用(图4); 电镜下细胞可呈现不规则形态, 体积缩小, 胞质疏松, 可见空泡化, 但空泡化较加入H. pylori上清液减少, 内质网、线粒体扩张, 核缩小, 染色质聚积, 细胞最后也出现破裂、死亡, 但整个程度较H. pylori上清液损伤为轻(图5).
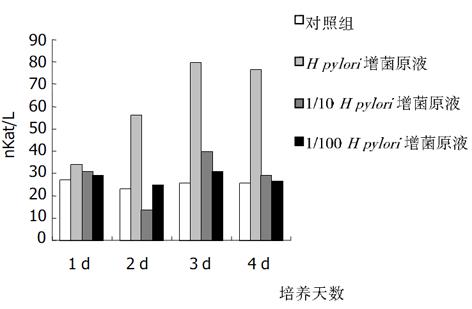
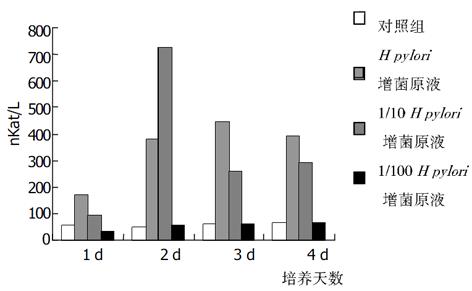
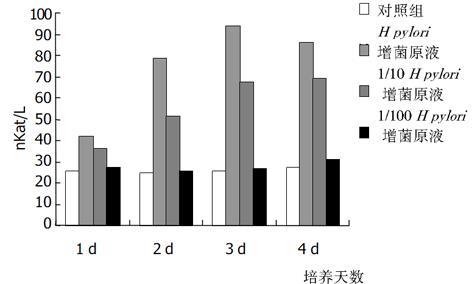
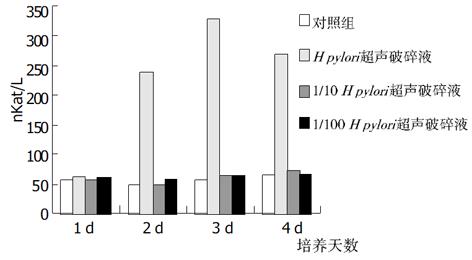
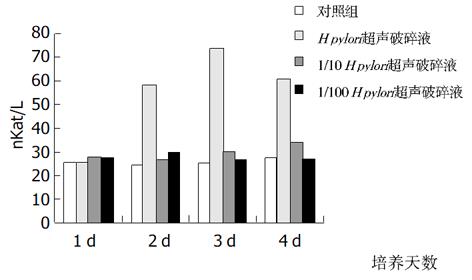
加入不同浓度增菌液对HGBEC培养上清液中, 三项酶学指标在任何1 d都显著高于对照组(P<0.01), 加入1/10 H. pylori增菌液第2, 3 d时三项酶学指标仍显著高于对照组(P<0.01), 4 d时只有LDH和GGT显著高于对照组(P<0.01); 加入1/100 H. pylori 增菌液后上清液中酶学指标与对照组比较皆无显著差异(P>0.05); 按时间进行观察, 加入H. pylori增菌原液及1/10稀释液后, 上清液酶学指标逐天进行性升高(P<0.01,), 但4 d与3 d比较则无显著性差异(P>0.05, 图6-8).
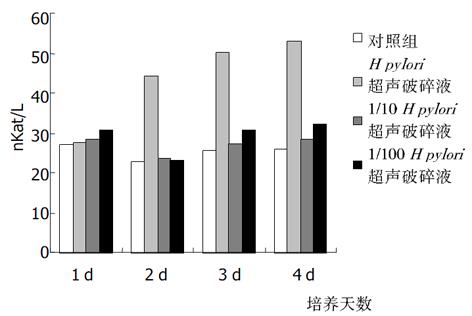
加入H. pylori菌体破碎液后2, 3, 4 d HGBEC培养上清液中ALP, LDH, GGT水平较对照组显著升高(P<0.01), 而加入1/10, 1/100菌体破碎液则上清液酶学指标无明显影响(P>0.05), 按时间顺序比较, 在加入H. pylori菌体原液后2 d起, ALP, LDH, GGT水平逐天进行性增高(P<0.01), 但4 d与3 d 比较, 则无显著性增加(P>0.05, 图9-11).
从上述结果可以看出, H. pylori增菌上清液对培养的HGBEC上清酶学指标有明显影响, 随着加入的H. pylori增菌上清液浓度减小, 对酶学指标影响也逐渐减小, 即对细胞损伤、细胞通透性影响逐渐减小; H. pylori菌体破碎液也有类似的作用, 但较H. pylori增菌上清液作用明显减弱.
我们发现加入H. pylori增菌上清液后, HGBEC迅速出现细胞分裂、运动、黏附能力减弱, 随之出现明显的空泡化, 细胞破裂、坏死, 也有部分细胞呈现细胞凋亡; H. pylori菌体破碎液也有类似作用, 但作用较弱. 导致上述变化的原因可能是H. pylori经液体增菌在持续振荡的条件下, 其毒性物质很容易从菌体中分泌到液体培养基内, 使得增菌上清液中含有许多毒性物质或代谢产物, 当将其进入培养的HGBEC中, 使得毒性物质作用于HGBEC, 出现细胞膜受损, 通透性增加, 胞质疏松, 空泡化, 线粒体、内质网扩张, 核膜及核受损, 从而导致细胞分裂能力下降, 代谢障碍, 细胞最终破裂、死亡[11-12]; 在光镜和电镜下见到的胞质疏松、明显空泡化, 这一现象在H. pylori与众多细胞如Hela细胞、肝细胞作用时都可见到, 这主要与H. pylori含有空泡细胞毒素, (vacuolating cytotoxinA, VacA)有关[13-14]; 当VacA作用于离子转运蛋白使其功能紊乱后, 则HGBEC的离子转运会受到影响; 新生的空泡是以细胞内质网为主要成分并与溶酶体融合而成, 事实上细胞内空泡的形成本能是细胞自我吞噬的过程. H. pylori另一个重要毒素是细胞毒素相关蛋白CagA, 他与细胞钠通道蛋白同源性高, 当他作用于HGBEC时, 则使HGBEC钠泵受影响, 从而导致细胞肿胀、破裂、最终死亡. 我们推测, 从胆囊内分离出的H. pylori对HEBEC的损伤作用, 如同H. pylori对胃黏膜上皮细胞损伤作用一样, 主要通过H. pylori本身的酶、毒素如VacA、CagA、尿素酶、脂酶、磷脂酶A、溶血素及脂多糖等起作用[15-19]; 除此之外, H. pylori可能还通过激活炎细胞、分泌炎性递质, 以及细胞免疫、体液免疫、自身免疫等途径造成胆囊黏膜上皮细胞的损伤, 从而发生胆囊炎症[20-22]; 与此同时, H. pylori的毒性因子还可以活化抑制细胞增生的因子, 促进细胞凋亡调控基因BCL-2, BAx, FAS等表达, 诱导细胞凋亡产生[11], 这与我们观察到的HGBEC中出现类似细胞凋亡的现象相一致. H. pylori菌体破碎液对HGBEC损伤作用较H. pylori增菌液作用弱, 这可能是菌体内最主要毒性因子是脂多糖, 相对于H. pylori其他毒素如VacA, CagA, 他不是H. pylori最主要的毒性因子[23], 因此, 其对HGBEC损伤作用较轻微.
由于胆囊上皮细胞内含有ALP, LDH及CGT, 测定HEBEC培养上清液中这三项酶学指标的含量, 可以反映出HGBEC的功能状态及细胞膜性结构的完整性. 本研究表明向培养的HGBEC中加入H. pylori上清及菌体破碎液, 都在一定程度上增加了细胞培养上清液中这三种酶的活性, 结合此时细胞活力减弱、分裂减少, 细胞培养上清液中这三种酶水平升高不可能用细胞功能增强、酶合成增加来解释, 而主要是细胞受到损伤, 膜性结构被破坏, 细胞内酶漏出释放到上清液中所致; 从另一个侧面证明H. pylori上清液、菌体破碎液能破坏细胞膜性结构, 甚至造成细胞破裂, 使得细胞培养上清液中ALP, LDH, GGT升高; 细胞培养上清液酶学指标测定值随实验时间延长而增加, 但4 d则较3 d无明显增加, 这反映出HGBEC从轻微损伤到逐渐加重, 细胞内酶漏出逐渐增加的过程; 当细胞破裂、死亡后, 细胞内酶全部漏出, 故细胞培养上清液中酶含量不再继续增加. 本研究提示: H. pylori可以引起胆囊上皮细胞损伤, 可能是临床上胆囊炎发病的一种因素.
编辑: N/A
| 11. | Neu B, Randlkofer P, Neuhofer M, Voland P, Mayerhofer A, Gerhard M, Schepp W, Prinz C. Helicobacter pylori induces apoptosis of rat gastric parietal cells. Am J Physiol Gastrointest Liver Physiol. 2002;283:G309-G318. [PubMed] [DOI] |
| 12. | Bebb JR, Letley DP, Rhead JL, Atherton JC. Helicobacter pylori supernatants cause epithelial cytoskeletal disruption that is bacterial strain and epithelial cell line dependent but not toxin VacA dependent. Infect Immun. 2003;71:3623-3627. [PubMed] [DOI] |
| 13. | Supajatura V, Ushio H, Wada A, Yahiro K, Okumura K, Ogawa H, Hirayama T, Ra C. Cutting edge: VacA, a vacuolating cytotoxin of Helicobacter pylori, directly activates mast cells for migration and production of proinflammatory cytokines. J Immunol. 2002;168:2603-2607. [PubMed] [DOI] |
| 14. | McClain MS, Schraw W, Ricci V, Boquet P, Cover TL. Acid activation of Helicobacter pylori vacuolating cytotoxin (VacA) results in toxin internalization by eukaryotic cells. Mol Microbiol. 2000;37:433-442. [PubMed] [DOI] |
| 15. | Silva CP, Pereira-Lima JC, Oliveira AG, Guerra JB, Marques DL, Sarmanho L, Cabral MM, Queiroz DM. Association of the presence of Helicobacter in gallbladder tissue with cholelithiasis and cholecystitis. J Clin Microbiol. 2003;41:5615-5618. [PubMed] [DOI] |
| 16. | Dohmen K, Shigematsu H, Miyamoto Y, Yamasaki F, Irie K, Ishibashi H. Atrophic corpus gastritis and Helicobacter pylori infection in primary biliary cirrhosis. Dig Dis Sci. 2002;47:162-169. [PubMed] [DOI] |
| 17. | Banić M, Buljevac M, Kujundzić M, Jelić D, Dominis M, Colić-Cvrlje V, Kardum D, Katicić M. [Extra-gastrointestinal tract diseases and Helicobacter pylori infection]. Lijec Vjesn. 2002;124 Suppl 1:63-68. [PubMed] |
| 18. | Kuroki T, Fukuda K, Yamanouchi K, Kitajima T, Matsuzaki S, Tajima Y, Furui J, Kanematsu T. Helicobacter pylori accelerates the biliary epithelial cell proliferation activity in hepatolithiasis. Hepatogastroenterology. 2002;49:648-651. [PubMed] |
| 19. | Leong RW, Sung JJ. Review article: Helicobacter species and hepatobiliary diseases. Aliment Pharmacol Ther. 2002;16:1037-1045. [PubMed] [DOI] |
| 20. | Bäckhed F, Torstensson E, Seguin D, Richter-Dahlfors A, Rokbi B. Helicobacter pylori infection induces interleukin-8 receptor expression in the human gastric epithelium. Infect Immun. 2003;71:3357-3360. [PubMed] [DOI] |
| 21. | Straubinger RK, Greiter A, McDonough SP, Gerold A, Scanziani E, Soldati S, Dailidiene D, Dailide G, Berg DE, Simpson KW. Quantitative evaluation of inflammatory and immune responses in the early stages of chronic Helicobacter pylori infection. Infect Immun. 2003;71:2693-2703. [PubMed] [DOI] |
| 22. | Nedrud JG, Blanchard SS, Czinn SJ. Helicobacter pylori inflammation and immunity. Helicobacter. 2002;7 Suppl 1:24-29. [PubMed] [DOI] |
| 23. | Hansen PS, Petersen SB, Varning K, Nielsen H. Additive effects of Helicobacter pylori lipopolysaccharide and proteins in monocyte inflammatory responses. Scand J Gastroenterol. 2002;37:765-771. [PubMed] [DOI] |