修回日期: 2004-04-21
接受日期: 2003-05-17
在线出版日期: 2004-08-15
目的: 研究广西人上消化道疾病患者幽门螺杆菌(H. pylori)细胞毒素相关蛋白(cagA)基因的阳性率, 从而明确广西人群感染H. pylori菌株的毒力状况.
方法: 在广西南宁市几家大医院的慢性胃炎(CG)、消化性溃疡(PU)患者胃黏膜中分离出45株H. pylori, 用特异性引物扩增H. pylori cagA基因的297 bp片段, 经聚合酶链反应(PCR)进行检测. 同时收集患者临床和胃镜诊断资料, 分析H. pylori cagA基因与胃十二指肠疾病的关系.
结果: 在45株H. pylori中有84.4%(38/45)的菌株含有cagA基因, 其中PU患者感染菌株cagA基因阳性率为76.0%(19/25), CG患者cagA基因阳性率为95.0%(19/20), 二者比较差异无显著性(x2 = 3.054, P>0.05), 各年龄组患者感染H. pylori菌株cagA基因阳性率差异无显著性(P>0.05), 而女性患者阳性率(100.0%)显著高于男性(73.1%, P<0.01).
结论: 广西人上消化道疾病患者H. pylori cagA基因阳性菌株感染率较高; PU患者感染菌株cagA基因阳性率低于CG患者; 女性患者感染H. pylori 菌株cagA基因阳性率明显高于男性; 但各年龄组患者阳性率无差异.
引文著录: 黄赞松, 唐国都, 王超, 李素艳, 姜海行. 广西人上消化道疾病患者幽门螺杆菌cagA基因检测及其临床意义. 世界华人消化杂志 2004; 12(8): 1831-1834
Revised: April 21, 2004
Accepted: May 17, 2003
Published online: August 15, 2004
AIM: To study the positive rate of Helicobacter pylori (H. pylori) cagA gene of strains and the virulence of H. pylori infecting patients in Guangxi, China.
METHODS: H. pylori strains were isolated in gastric biopsy specimens from the patients with chronic gastritis and peptic ulcer in Nanning area of Guangxi. The sequence of D008/R008 primers were used to amplify 297 bp fragment of cagA gene and PCR were used to detect the frequency of cagA gene in the 45 H. pylori isolates.
RESULTS: The positive rate of cagA gene in H. pylori strains was 84.4% (38/45). The positive rate of cagA gene in peptic ulcer (PU) patients was 76.0% (19/25), which was lower than that in chronic gastritis (CG) patients (95.0%,19/20), but there was no significant difference (P > 0.05). The positive rate of cagA gene was higher in female patients than that in male patients (100.0% vs 73.1%, P < 0.01). The positive rate of cagA gene in different age groups was no significant difference (P > 0.05).
CONCLUSION: The positive rate of cagA gene in H. pylori strains among patients in Guangxi is high, and the positive rate is lower in PU patients than that in CG patients, and higher in male than female patients. But there is no significant difference in different age groups.
- Citation: Huang ZS, Tang GD, Wang C, Li SY, Jiang HX. Detection of Helicobacter pylori cagA gene in patients with digestive diseases in Guangxi and its clinical significance. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1831-1834
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1831.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1831
自1982年, Warren和Marshall成功地从慢性胃炎(CG)患者胃黏膜活检组织中分离出幽门螺杆菌(Helicobacter pylori, H. pylori)[1]以来, 已有的研究表明H. pylori感染是目前世界上最常见的细菌感染, 全世界近一半人口感染H. pylori [2-3], 发展中国家更高, 中国人群H. pylori感染率为61%. 1994年世界卫生组织(WHO)已将H. pylori列为第一类生物致癌因子[4-5]. 细胞毒素相关基因A (cytotoxin associated gene A, cagA)阳性H. pylori为毒力菌株, 与PU, CG, 胃癌和MALT淋巴瘤的关系密切[6-11]. 在H. pylori诸多的致病因素中, cagA倍受关注. 为明确广西人群感染H. pylori菌株的毒力状况, 我们从上消化道疾病患者胃黏膜分离出45个H. pylori菌株, 应用PCR方法检测cagA基因, 分析cagA基因的分子流行病学现状, 探讨该基因与不同胃肠道疾病的关系.
2001-11/2002-07广西医科大学第一附属医院、广西区人民医院、解放军303医院、南宁市第二人民医院和广西武警总队医院因上消化道疾病行胃镜检查胃黏膜活检H. pylori培养, 分离出H. pylori 45株, 男26例, 女19例, 年龄20-82(平均45.9岁). 内镜及病理证实为十二指肠溃疡(DU)17例, 胃溃疡(GU)6例, 复合溃疡2例, 慢性胃炎(CG)20例. 每例患者分别于胃窦及胃体各活检1块组织行病理检查. H. pylori 标准菌株NCTC11637(cagA+)为中国预防医学科学院流行病研究所惠赠. PCR仪为美国PE Biosystems公司生产5700型基因合成仪, 电泳仪为北京六一仪器厂生产的DYY-III-8B型, 显影仪为上海产 Model ZF-3型紫外光检测仪. 引物D008, 引物R008, dNTP, TaqE, MgCL2, 10×PCR Buffer, 均购于上海生工生物工程技术服务有限公司.
取胃肠疾病患者胃窦膜活检标本, 于空肠弯曲菌基础培养基(由上海疾病控制腹泻病防治中心提供, 加入100 mL/L脱纤维羊血及抗生素)上37 °C微需氧条件下培养72 h, 取少许H. pylori菌落置于冻存液200 μL中. 细菌DNA模板的制备采用煮沸裂解法, 取H. pylori混悬液1 μL加入裂解液200 μL及蛋白酶K(终浓度200 mg/L), 经55 °C水浴10 min, 煮沸10 min, 以1×104 r/min离心5 min, 取上清液5 μL用于PCR扩增. PCR引物针对cagA基因保守区设计, 由上海生工生物工程技术服务有限公司合成: D008: 5-ATAATGCTAAATTAGACAACTTGAGCGA-3 (nt 1751-1778), R008: 5-TTAGAATAATCAACAAACATCACGCCAT-3 (nt 2 021-2048), 扩增靶片段长度为297 bp. PCR反应液体积20 μL, 内含有1 μmoL D008/R008引物, 2.0U Taq DNA聚合酶, 0.4 mmoL dNTP, 2.0 mmoL MgCl2. 反应条件: 94 °C变性 5 min, 35个循环(94 °C变性1 min, 55 °C退火1 min, 72 °C延伸1.5 min), 终止延伸72 °C 5 min. PCR产物经18 g/L琼脂糖凝胶电泳, 0.5 mg/L溴化乙锭染色, 于紫外灯下显影. 以菌株NCTC11637(cagA+)DNA作为阳性对照, 去离子水作空白对照.
统计学处理 采用x2 检验, 数据以阳性百分率表示, P<0.05为差异有显著性.
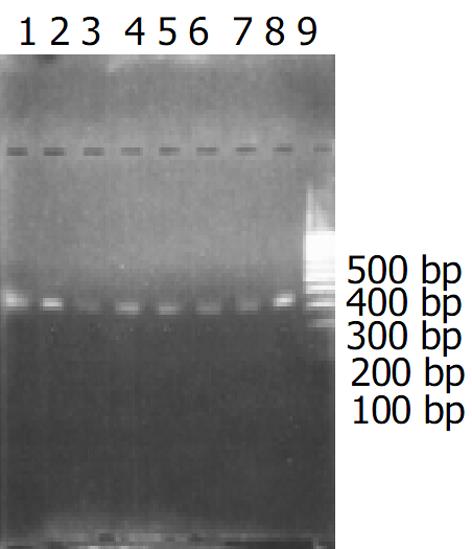
应用PCR法检测临床分离H. pylori菌株的cagA基因, 阳性率为84.4%(38/45, 图1).
PU患者感染菌株cagA基因阳性率为76.0%(19/25), 其中DU 患者82.4%(14/17), GU患者50.0%(3/6), 复合性溃疡100.0%(2/2), 低于CG患者(95.0%, 19/20), 但二者差异无显著性(P>0.05). 各年龄组患者感染H. pylori菌株cagA基因阳性率(20-39岁, 40-59岁, 60岁-阳性率分别为87.5%, 83.3%和81.8%)差异无显著性(P>0.05), 而女性患者阳性率(100.0%, 19/19)显著高于男性(73.1%, 19/26, x2 = 6.058, P<0.01).
H. pylori是人类最常见的一种致病菌, 是CG和PU的重要致病因素, 与胃癌的发生密切相关, 世界卫生组织国际癌症研究机构已将该菌列入第一类致癌原. 人群中H. pylori感染率约为50%左右, 仅有少部分人表现出不同程度的症状. CagA是H. pylori主要的毒力因子之一, 可作为评价H. pylori毒力的指标. CagA抗原是亲水性的、表面暴露的128kDa的蛋白, 有较高的免疫原性, 不同菌株的cagA基因长度及产物不同. cagA基因总长约5 925 bp, 包含一个3 440 bp的开放阅读框架(ORF), G+C比例为37%. 西方国家的研究结果认为, cagA 阳性H. pylori为毒力菌株, 与PU、萎缩性胃炎、胃癌发生的关系极为密切. Kidd et al[12]应用PCR法检测发现95%的胃炎、胃癌和消化性溃疡患者感染的H. pylori为cagA 阳性菌株, 提示cagA可能与十二指肠溃疡、胃癌及慢性活动性胃炎的发生有关. 国外学者[13]根据H. pylori是否表达CagA和VacA蛋白, 提出将临床分离菌株分为二型, 即Ⅰ型(含cagA基因, 表达CagA及VacA蛋白)和Ⅱ型(不含cagA基因, 不表达CagA及VacA蛋白), 另有部分中间型(仅表达其中的一个毒力因子)存在, 并证明I型与较严重的胃十二指肠疾病发生相关. 国外学者曾采用Southern杂交及PCR方法检测cagA基因, 发现Ⅰ型菌株在临床分离株中约占67%-88%, 新近在亚洲人群中的研究结果显示, 90% H. pylori临床分离菌株CagA呈阳性表达, CagA的表达在H. pylori相关的不同胃十二指肠疾病之间没有显示出明显的差异.
H. pylori分离株cagA基因的阳性率具有明显的地区差异. 国外学者[13]对意大利的H. pylori分离株进行cagA检测, 阳性率为67.4%, 在日本, Okinawa地区的H. pylori cagA+ 菌株明显高于Fukui地区[14]. 中国香港地区的H. pylori cagA+ 菌株为88.9%[15]. 代丽萍 et al[16]、Chen et al[17]、Yan et al[18]和李晓波 et al[19]分别对北京市、浙江省、杭州市和上海市的H. pylori分离到的菌株进行cagA基因检测, 阳性率为89.5%、96.2%、97.2%和84.8%, 明显高于其他国家水平, 提示我国H. pylori分离株毒力因子的表达属高水平, 这将有助于进一步研究毒力因子与H. pylori相关疾病的关系. 我们采用针对H. pylori cagA基因保守区的特异性引物进行PCR检测, 结果显示广西人群感染H. pylori cagA+ 菌株为84.4%, cagA的阳性率在H. pylori相关的PU和CG之间没有显示出明显的差异, 因未对CagA及VacA抗原同时进行检测, 尚无法对H. pylori进行分型. 广西人胃十二指肠疾病患者H. pylori cagA+ 菌株感染率与西方发达国家、香港地区和上海市相似, 略低于浙江省的96.2%和北京市的89.5%的感染率, 但高于以往报道的广西人cagA+菌株感染率的65.1%[20]. 迄今为止, Ⅰ型和Ⅱ型细菌之间的确切关系仍不清楚. Ⅱ型细菌除了不含有cagA基因, 不表达VacA蛋白外, 突出特点是生长缓慢, 约需5 d左右, 而Ⅰ型细菌仅需2-3 d. 分子水平研究发现, Ⅱ型细菌从cagA基因5′上游缺失20个kb以上的基因片段(4a). 缺失的部分可能编码其他的毒力因子, 可能存在控制VacA表达的调节成分. 由于缺失的部分存在于所有的Ⅱ型细菌, 因此, Ⅱ型细菌除缺乏cagA的表现型, 也应包括缺乏丢失部分的表现型特征, 这些特征可能与CagA阳性的表达无关, 也很可能与cagA一起负责cagA阳性表型特征. 同时, 由于菌株的基因型受地理分布及环境的影响, 这种差异可能还表现在cagA基因本身的序列改变. Miehlke et al [21]采用两对引物(引物1为本研究所采用的引物, 即297 bp片段, 引物2扩增序列位于297 bp片段下游, 长度为1 418 bp), PCR检测两组来自韩国及美国H. pylori菌株的cagA基因. 结果显示, 297 bp片段的检出率分别为98.3%及88.0%, 而1.4 kb的产物仅在1.7%的韩国H. pylori分离物中检测到, 提示PCR方法扩增cagA基因297 bp片段特异性较高, 同时亦表明H. pylori cagA基因的序列可能存在地理分布的差异, 因此是否我国H. pylori感染菌株亦存在上述差异值得进一步研究.
cagA基因在不同年龄、性别患者感染H. pylori菌株中的分布研究报道尚少. 我们的研究结果显示cagA基因在青年、中年、老年组中的感染率无显著性差异, 与国内上海报道的结果一致. 而男性的感染率低于女性, 与上海的男性阳性率高于女性不同, 此结果需进一步扩大样本研究. 尽管cagA基因已明确为评价H. pylori毒力的指标之一, 且与其他cag族基因共同构成H. pylori的"致病岛", 但其确切致病作用目前尚不清楚, 最初认为, cagA可能与H. pylori VacA的表达有关, 但目前许多学者认为VacA的表达可能不需要cagA的存在. 我们以前的研究发现cagA+ 的慢性胃炎患者IL-8升高[22] , 提示cagA 致病可能与cagA+H. pylori刺激胃上皮细胞产生IL-8增加, 从而增强炎症有关. 我们的研究结果显示cagA基因阳性率与上消化道疾病之间的差异无显著性, 与Zhou et al[23]的研究结果类似. 而国外有报道cagA+H. pylori与胃窦活动性炎症及MALT淋巴瘤有一定关系, 也有报道cagA+H. pylori在上消化道疾病之间无明显差异性[24-31]. 因此, 尚无直接证据表明cagA直接参与某些特殊胃肠道疾病的致病过程, cagA基因尚不能作为确定H. pylori感染致某种胃肠道疾病的单一指标, 今后需要大量菌株样本作进一步研究.
编辑: N/A
| 2. | Michetti P, Kreiss C, Kotloff KL, Porta N, Blanco JL, Bachmann D, Herranz M, Saldinger PF, Corthésy-Theulaz I, Losonsky G. Oral immunization with urease and Escherichia coli heat-labile enterotoxin is safe and immunogenic in Helicobacter pylori-infected adults. Gastroenterology. 1999;116:804-812. [PubMed] [DOI] |
| 3. | Rollan A, Giancaspero R, Fuster F, Acevedo C, Figueroa C, Hola K, Schulz M, Duarte I. The long-term reinfection rate and the course of duodenal ulcer disease after eradication of Helicobacter pylori in a developing country. Am J Gastroenterol. 2000;95:50-56. [PubMed] [DOI] |
| 4. | Vandenplas Y. Helicobacter pylori infection. World J Gastroenterol. 2000;6:20-31. [PubMed] [DOI] |
| 6. | Suganuma M, Kurusu M, Okabe S, Sueoka N, Yoshida M, Wakatsuki Y, Fujiki H. Helicobacter pylori membrane protein 1: a new carcinogenic factor of Helicobacter pylori. Cancer Res. 2001;61:6356-6359. [PubMed] |
| 7. | Nakamura S, Matsumoto T, Suekane H, Takeshita M, Hizawa K, Kawasaki M, Yao T, Tsuneyoshi M, Iida M, Fujishima M. Predictive value of endoscopic ultrasonography for regression of gastric low grade and high grade MALT lymphomas after eradication of Helicobacter pylori. Gut. 2001;48:454-460. [PubMed] [DOI] |
| 8. | Uemura N, Okamoto S, Yamamoto S, Matsumura N, Yamaguchi S, Yamakido M, Taniyama K, Sasaki N, Schlemper RJ. Helicobacter pylori infection and the development of gastric cancer. N Engl J Med. 2001;345:784-789. [PubMed] [DOI] |
| 9. | Morgner A, Miehlke S, Fischbach W, Schmitt W, Müller-Hermelink H, Greiner A, Thiede C, Schetelig J, Neubauer A, Stolte M. Complete remission of primary high-grade B-cell gastric lymphoma after cure of Helicobacter pylori infection. J Clin Oncol. 2001;19:2041-2048. [PubMed] [DOI] |
| 10. | Kate V, Ananthakrishnan N, Badrinath S. Effect of Helicobacter pylori eradication on the ulcer recurrence rate after simple closure of perforated duodenal ulcer: retrospective and prospective randomized controlled studies. Br J Surg. 2001;88:1054-1058. [PubMed] [DOI] |
| 11. | Gao HJ, Yu LZ, Bai JF, Peng YS, Sun G, Zhao HL, Miu K, L XZ, Zhang XY, Zhao ZQ. Multiple genetic alterations and behavior of cellular biology in gastric cancer and other gastric mucosal lesions:H. pylori infection, histological types and staging. World J Gastroenterol. 2000;6:848-854. [PubMed] [DOI] |
| 12. | Kidd M, Lastovica AJ, Atherton JC, Louw JA. Heterogeneity in the Helicobacter pylori vacA and cagA genes: association with gastroduodenal disease in South Africa? Gut. 1999;45:499-502. [PubMed] [DOI] |
| 13. | Kikuchi S. Epidemiology of Helicobacter pylori and gastric cancer. Gastric Cancer. 2002;5:6-15. [PubMed] [DOI] |
| 14. | Zhou W, Yamazaki S, Yamakawa A, Ohtani M, Ito Y, Keida Y, Higashi H, Hatakeyama M, Si J, Azuma T. The diversity of vacA and cagA genes of Helicobacter pylori in East Asia. FEMS Immunol Med Microbiol. 2004;40:81-87. [PubMed] [DOI] |
| 17. | Chen XJ, Yan J, Mao YF, Li LW. [Investigation on cagA/vacA dominant genotypes and the coinfection of Helicobacter pylori isolates from patients in Zhejiang]. Zhonghua Liu Xing Bing Xue Za Zhi. 2003;24:1031-1035. [PubMed] |
| 18. | Yan J, Wang Y, Shao SH, Mao YF, Li HW, Luo YH. Construction of prokaryotic expression system of 2 148-bp fragment from cagA gene and detection of cagA gene, CagA protein in Helicobacter pylori isolates and its antibody in sera of patients. World J Gastroenterol. 2004;10:1183-1190. [PubMed] |
| 19. | 李 晓波, 刘 文忠, 徐 蔚文, 施 尧, 萧 树东. 上海地区幽门螺杆菌菌株cag 致病岛基因 cagA、cagE、cagT 检出率及临床意义. 中华消化杂志. 2000;20:371-373. |
| 21. | Miehlke S, Kibler K, Kim JG, Figura N, Small SM, Graham DY, Go MF. Allelic variation in the cagA gene of Helicobacter pylori obtained from Korea compared to the United States. Am J Gastroenterol. 1996;91:1322-1325. [PubMed] |
| 22. | 潘 小炎, 黄 赞松, 王 小谷, 覃 志坚, 李 壮, 陶 箭. 幽门螺杆菌CagA相关胃炎与IL-8, IL-6及TNF-α关系的探讨. 广西医科大学 学报. 2003;20:347-349. |
| 23. | Zhou J, Zhang J, Xu C, He L. cagA genotype and variants in Chinese Helicobacter pylori strains and relationship to gastroduodenal diseases. J Med Microbiol. 2004;53:231-235. [PubMed] [DOI] |
| 24. | Brito CA, Silva LM, Jucá N, Leal NC, de Souza W, Queiroz D, Cordeiro F, Silva NL. Prevalence of cagA and vacA genes in isolates from patients with Helicobacter pylori-associated gastroduodenal diseases in Recife, Pernambuco, Brazil. Mem Inst Oswaldo Cruz. 2003;98:817-821. [PubMed] [DOI] |
| 25. | Lobo Gatti L, Agostinho Jn F, De Lábio R, Balbo Piason F, Carlos Da Silva L, Fagundez De Queiroz V, Peres CA, Barbieri D, De Arruda Cardoso Smith M, Marques Payão SL. Helicobacter pylori and cagA and vacA gene status in children from Brazil with chronic gastritis. Clin Exp Med. 2003;3:166-172. [PubMed] [DOI] |
| 26. | Lehours P, Ménard A, Dupouy S, Bergey B, Richy F, Zerbib F, Ruskoné-Fourmestraux A, Delchier JC, Mégraud F. Evaluation of the association of nine Helicobacter pylori virulence factors with strains involved in low-grade gastric mucosa-associated lymphoid tissue lymphoma. Infect Immun. 2004;72:880-888. [PubMed] [DOI] |
| 27. | Yang GF, Deng CS, Xiong YY, Gong LL, Wang BC, Luo J. Expression of nuclear factor-kappa B and target genes in gastric precancerous lesions and adenocarcinoma: association with Helicobactor pylori cagA (+) infection. World J Gastroenterol. 2004;10:491-496. [PubMed] [DOI] |
| 28. | Saribasak H, Salih BA, Yamaoka Y, Sander E. Analysis of Helicobacter pylori genotypes and correlation with clinical outcome in Turkey. J Clin Microbiol. 2004;42:1648-1651. [PubMed] [DOI] |
| 29. | Wen S, Felley CP, Bouzourene H, Reimers M, Michetti P, Pan-Hammarstrom Q. Inflammatory gene profiles in gastric mucosa during Helicobacter pylori infection in humans. J Immunol. 2004;172:2595-2606. [DOI] |
| 30. | Kidd M, Lastovica AJ, Atherton JC, Louw JA. Conservation of the cag pathogenicity island is associated with vacA alleles and gastroduodenal disease in South African Helicobacter pylori isolates. Gut. 2001;49:11-17. [PubMed] [DOI] |
| 31. | Miehlke S, Yu J, Schuppler M, Frings C, Kirsch C, Negraszus N, Morgner A, Stolte M, Ehninger G, Bayerdörffer E. Helicobacter pylori vacA, iceA, and cagA status and pattern of gastritis in patients with malignant and benign gastroduodenal disease. Am J Gastroenterol. 2001;96:1008-1013. [PubMed] [DOI] |