修回日期: 2004-04-01
接受日期: 2004-04-13
在线出版日期: 2004-08-15
目的: 探讨血清胃蛋白酶原含量作为幽门螺杆菌根除疗效判定指标的应用价值.
方法: 对359例幽门螺杆菌相关性胃疾病患者采取常规三联疗法进行除菌治疗, 利用免疫量度放射分析法(IRMA)分别在治疗前和治疗后1、5、18 mo时测定其血清胃蛋白酶原含量, 同时利用胃黏膜HE染色、H. pylori抗体 ELISA检测及H. pylori-DNA PCR检测三种方法联合判定H. pylori除菌治疗效果.
结果: 与治疗前相比, 除菌组血清PGI、PGII值显著降低(64.52±31.74 vs 48.02±25.69 μg/L, P<0.01; 11.22±6.12 vs 7.58±5.41 μg/L, P<0.01), PGI/II比值显著升高(6.54±3.57 vs 7.96±4.39, P<0.01). 各胃疾病组成功除菌后血清PGI、PGII值均低于治疗前水平. 治疗后1、5 mo时, 除菌组血清PGI、PGII均显著低于治疗前水平(PGI: 66.83±28.04 vs 52.54±27.96 μg/L, P<0.01; 11.85±4.91 vs 6.55±3.59 μg/L, P<0.01; PGII: 60.19±29.30 vs 43.94±26.27 μg/L; 10.93±6.12 vs 6.66±5.30 μg/L, P<0.01;), PGI/II比值则显著升高(5.84±2.38 vs 8.95±4.61, P<0.01; 6.60±4.21 vs 8.35±4.82, P<0.01); 18 mo时仅PGI值显著降低(68.12±36.05 vs 50.11±23.50 μg/L, P<0.01). 未除菌组血清PG水平治疗前后无明显变化.
结论: 血清胃蛋白酶原含量检测适用于幽门螺杆菌除菌疗效的判定, PGI/II比值可作为早期除菌疗效的判定指标.
引文著录: 孙丽萍, 宫月华, 袁媛. 血清胃蛋白酶原含量作为幽门螺杆菌除菌疗效判定指标的研究. 世界华人消化杂志 2004; 12(8): 1827-1830
Revised: April 1, 2004
Accepted: April 13, 2004
Published online: August 15, 2004
AIM: To investigate the utilization of serum pepsinogen (PG) as an index for Helicobacter eradication.
METHODS: Serum PGI and PGⅡ concentrations were detected with immunoradiometric assay (IRMA) in 359 patients with H. pylori infection, who were treated for eradication by routine triple therapy, before and 1, 5 and 18 mos after treatment. Three methods were used to determine the result of eradication: HE staining, Hp-DNA PCR and ELISA analysis.
RESULTS: Compared to serum level before treatment, serum PGI and PGⅡ concentrations decreased significantly in the eradication group (64.52±31.74 vs 48.02±25.69 μg/L, P < 0.01; 11.22±6.12 vs 7.58±5.41 μg/L, P < 0.01), and PGI/II ratio also increased significantly (6.54±3.57 vs 7.96±4.39, P < 0.01). Serum PGI and PGⅡ levels decreased after eradication in different disease groups. 1 and 5 mos after treatment, serum PGI and PGⅡconcentrations in the eradication group were significantly lower than those before treatment (PGI: 66.83±28.04 vs 52.54±27.96 μg/L, P < 0.01; 11.85±4.91 vs 6.55±3.59 μg/L, P < 0.01; PGII: 60.19±29.30 vs 43.94±26.27 μg/L; 10.93±6.12 vs 6.66±5.30 μg/L, P < 0.01), and PGI/Ⅱratio were significantly higher than the latter (5.84±2.38 vs 8.95±4.61, P < 0.01; 6.60±4.21 vs 8.35±4.82, P < 0.01); The marked drop was found with PGI/Ⅱratio 18 mos after treatment (68.12±36.05 vs 50.11±23.50 μg/L, P < 0.01). There were no remarkable changes with serum PG concentrations in uneradication group.
CONCLUSION: Serum pepsinogen levels are suitable for determining the effect of H. pylori eradication. PGI/Ⅱ ratio can be used as a good marker for determination in the early eradication.
- Citation: Sun LP, Gong YH, Yuan Y. Serum pepsinogen concentration as an index for Helicobacter pylori eradication. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1827-1830
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1827.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1827
幽门螺杆菌(Helicobacter pylori, H. pylori)感染与多种胃良、恶性疾病的发生发展密切相关, 国际癌症研究中心(IARC)已将其列为Ⅰ类致癌因子. 根除H. pylori治疗能明显改善急性和慢性胃炎, 降低消化性溃疡的复发, 使低度恶性的MALT得到治愈, 并有可能终止胃癌的发生, 因此除菌治疗对H. pylori相关性胃疾病的治疗及胃癌防治意义重大[1-5]. 但由于存在H. pylori感染的复发或再感染的问题, 因而除菌疗效的判定十分必要. 目前根据是否需要作内镜检查可将H. pylori根除疗效判定的方法分为侵入性和非侵入性两大类, 侵入性方法如快速尿素酶试验、组织学检查等容易给患者带来痛苦, 非侵入性的方法如13C或14C尿素呼气试验等也存在一定的局限性[6-10], 因此有必要建立一种简便、易行且有效、适宜的H. pylori根除判定方法. 胃蛋白酶原(pepsinogen, PG)是胃黏膜特异性功能酶-胃蛋白酶的无活性前体, 可分为PGI和PGII两种生化和免疫活性不同的亚群. 血清PG水平是反映胃黏膜功能和状态的良好指标, 且血清PG检测方法具有无创、简便、快速等优点. 本研究旨在通过检测H. pylori相关性胃疾病患者除菌治疗前后的血清PG含量, 揭示其动态变化规律, 进而探讨血清PG水平作为H. pylori根除疗效判定指标的应用价值.
研究对象来自辽宁庄河胃癌高发区普查人群, 经病理组织学诊断及H. pylori感染判定后, 将359例H. pylori相关性胃疾病患者(包括浅表性胃炎129例, 胃糜烂/溃疡50例, 浅表萎缩性胃炎59例, 萎缩性胃炎80例和异型增生41例)随机分成3组: A组72例(男39例, 女33例), 平均年龄48.56岁; B组150例(男89例, 女61例), 平均年龄48.25岁; C组137例(男77例, 女60例), 平均年龄48.83岁, 3组病例在年龄、性别及胃疾病构成上差异无统计学意义. 采用铋制剂、阿莫西林和甲硝唑常规三联疗法进行H. pylori除菌治疗, A组于治疗后1 mo检测, B组于治疗后5 mo检测, C组于治疗后18 mo检测. 分别在治疗前和治疗后不同时间采集受检者空腹静脉血, 分离血清后-20 ℃保存待测; 同时胃镜下取胃黏膜活检组织, 用于病理组织学诊断和H. pylori组织学及DNA检测.
胃黏膜HE染色行H. pylori组织学检查、 ELISA法检测血清H. pylori抗体(上海晶莹生物技术公司)和PCR法检测胃黏膜H. pylori DNA(上海复华公司), 分别在除菌治疗后1, 5, 18 mo时采用上述三种方法联合判定H. pylori除菌疗效: 二者或二者以上阳性判为H. pylori阳性, 否则为阴性. 采用免疫量度放射分析法(IRMA), 在治疗前和治疗后1、5、18 mo时分别检测血清PGI, PGII含量(北京佳科生物技术公司), 并计算PGI/II比值.
统计学处理 用SPSS11.5软件进行统计学处理, t检验和方差分析比较各组间差异. P<0.05有统计学意义.
治疗前3组病例血清PGI、PGII及PGI/II比值组间差异无统计学意义(见表1).
| 分组 | A | B | C | P |
| PGI | 64.04±26.49 | 60.08±27.87 | 65.14±32.08 | 0.413 |
| PGII | 11.15±5.01 | 10.50±5.37 | 10.89±5.62 | 0.648 |
| PGI/II比值 | 6.10±2.37 | 6.39±3.16 | 6.44±2.75 | 0.662 |
经过除菌治疗后131例(36.49%)除菌成功, 其中A组27例(37.50%), B组55例(36.67%), C组49例(35.77%), 3组间H. pylori根除率差异无统计学意义.
与治疗前相比, 治疗后除菌组血清PGI、PGII值显著降低(分别降低为治疗前的76.5%和70.3%), PGI/II比值显著升高(为治疗前的125.4%), 各组间差异有统计学意义; 未除菌组血清PGI、PGII值降低和PGI/II比值升高无统计学意义(分别为治疗前的95.6%、99.0%和100.9%) (见表2) .
2.2 不同疾病组除菌治疗前后血清PG水平变化的比较与治疗前相比, 成功除菌的各疾病组血清PGI、PGII水平均有不同程度的降低, PGI/II比值有不同程度的升高, 其中: 浅表性胃炎组血清PGI、PGII值显著降低; 浅表萎缩性胃炎和异型增生组血清PGII值显著降低, PGI/II比值显著升高; 萎缩性胃炎组血清PGII值显著降低; 余者组间差异无统计学意义. 未除菌的各疾病组血清PG含量变化无明显差异(表3).
| 胃疾病 PGI | P | PGII | P | PGI/II比值 | P | |||||
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | |||||
| 除菌组 | 浅表性胃炎 | 73.69±37.11 | 47.36±30.10 | 0a | 10.43±6.21 | 6.92±4.55 | 0.004a | 7.72±3.43 | 8.04±4.50 | 0.634 |
| 胃糜烂、溃疡 | 62.90±26.40 | 50.09±21.14 | 0.074 | 11.19±6.85 | 8.10±4.60 | 0.190 | 6.17±2.28 | 6.87±2.15 | 0.365 | |
| 浅表萎缩性胃炎 | 59.17±36.72 | 46.79±23.09 | 0.162 | 12.13±6.16 | 7.49±6.21 | 0.038a | 4.90±1.95 | 8.92±5.03 | 0.004a | |
| 萎缩性胃炎 | 55.19±17.38 | 45.03±21.08 | 0.035a | 10.98±5.12 | 8.58±6.38 | 0.091 | 5.82±2.52 | 7.10±4.26 | 0.131 | |
| 异型增生 | 64.91±32.40 | 53.27±28.84 | 0.201 | 12.43±6.88 | 7.15±5.71 | 0a | 6.94±5.99 | 9.16±5.03 | 0.047a | |
| 未除菌组 | 浅表性胃炎 | 64.62±29.42 | 63.93±31.96 | 0.833 | 10.79±5.31 | 10.75±6.74 | 0.954 | 6.44±2.39 | 7.09±4.20 | 0.169 |
| 胃糜烂、溃疡 | 56.83±19.73 | 67.22±29.55 | 0.078 | 9.51±3.51 | 11.10±5.29 | 0.141 | 6.26±1.96 | 6.95±4.02 | 0.306 | |
| 浅表萎缩性胃炎 | 67.86±31.44 | 56.13±22.56 | 0.022 | 10.56±4.93 | 10.01±3.54 | 0.559 | 6.93±2.75 | 5.91±2.55 | 0.055 | |
| 萎缩性胃炎 | 50.87±22.85 | 53.05±29.36 | 0.545 | 9.31±3.80 | 10.31±6.54 | 0.197 | 5.63±2.06 | 5.62±2.61 | 0.984 | |
| 异型增生 | 72.67±27.96 | 57.37±19.46 | 0.025 | 13.87±6.07 | 11.89±5.05 | 0.194 | 5.52±2.16 | 5.61±3.21 | 0.900 | |
与治疗前相比, 除菌组治疗后1、5 mo检测时, 血清PGI和PGII值显著降低, PGI/II比值显著升高, 各组间差异有统计学意义. 治疗后18 mo检测时, 仅血清PGI值显著降低. 未除菌组在各时间检测组间差异均无统计学意义. (表4).
| 时间 | PGI | P | PGII | P | PGI/II比值 | P | ||||
| 治疗前 | 治疗后 | 治疗前 | 治疗后 | 治疗前 | 治疗后 | |||||
| 除菌组 | 1 mo | 66.83±28.04 | 52.54±27.96 | 0.027a | 11.85±4.91 | 6.55±3.59 | 0a | 5.84±2.38 | 8.95±4.61 | 0.002a |
| 5 mo | 60.19±29.30 | 43.94±26.27 | 0a | 10.93±6.12 | 6.66±5.30 | 0a | 6.60±4.21 | 8.35±4.82 | 0.006a | |
| 18 mo | 68.12±36.05 | 50.11±23.50 | 0.002a | 11.19±6.79 | 9.18±6.04 | 0.149 | 6.86±3.35 | 6.98±3.58 | 0.842 | |
| 未除菌组 | 1 mo | 62.38±25.69 | 61.87±30.15 | 0.91 | 10.73±5.08 | 10.62±5.85 | 0.906 | 6.25±2.37 | 6.86±4.06 | 0.334 |
| 5 mo | 60.01±27.17 | 56.89±26.96 | 0.315 | 10.25±4.91 | 10.48±5.23 | 0.907 | 6.26±2.36 | 6.37±3.86 | 0.791 | |
| 18 mo | 63.49±29.74 | 62.49±30.07 | 0.762 | 10.73±4.89 | 11.25±.653 | 0.45 | 6.20±2.33 | 6.21±2.92 | 0.981 | |
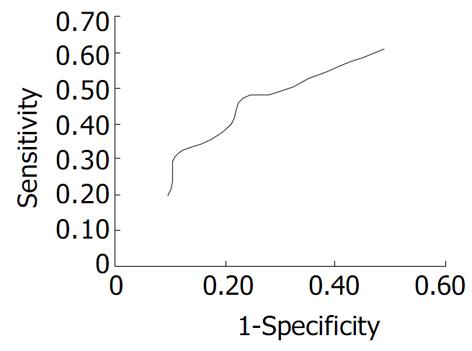
由前述结果可见: 与PGI或PGII相比, 除菌治疗前后PGI/II比值的变化更有意义, 且在除菌治疗后早期的变化更为明显, 因此我们绘制了PGI/II比值变化率(治疗后/治疗前×100%)的ROC曲线(receptor operated characteristic curve)以确定其判定除菌的最适Cut-off值(图1). 以变化率 = 130%为Cut-off值, 其灵敏度47.3%, 特异度76.8.%, 准确度66.0%, 阳性预测值54.0%, 阴性预测值71.7%; 以变化率 = 170%为Cut-off值, 其灵敏度30.5%, 特异度89.0%, 准确度67.7%; 阳性预测值61.6%, 阴性预测值69.1%.
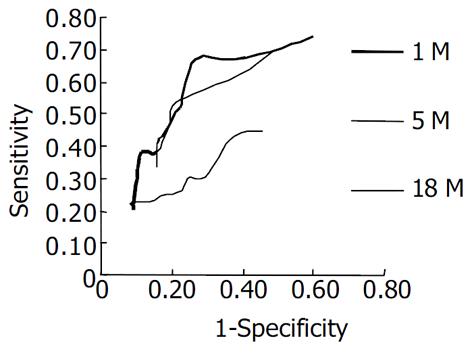
治疗后不同时间PGI/II比值变化率的ROC曲线如图2所示. 以治疗后 1 mo 时PGI/II比值变化率 = 130%为Cut-off值, 其灵敏度66.7%, 特异度73.3%, 准确度69.9%, 阳性预测值60. 0%, 阴性预测值76.8%. 以治疗后5 mo时PGI/II比值变化率 = 130%为Cut-off值, 其灵敏度52.7%, 特异度80.0%, 准确度70.0%. 阳性预测值60.4%, 阴性预测值74.5%; 以该值 = 160%为Cut-off值, 其检测灵敏度38.2%, 特异度88.4%, 准确度70.0%, 阳性预测值65.6%, 阴性预测值71.2%.
H. pylori感染首先引起慢性活动性胃炎, 持续感染后形成慢性弥漫性胃炎, 病变程度和范围逐渐增加最终导致胃黏膜萎缩变薄, 胃酸分泌量亦会随着胃黏膜萎缩的进展而减少. 抗生素根除H. pylori感染后可能会终止这一过程, 部分逆转萎缩、肠化等癌前病变, 阻止疾病的进一步发展[11-13]. 随着人们对H. pylori相关性胃疾病认识的统一, 根治H. pylori感染在此类疾病的治疗中已成为重要的环节. 目前常用的非侵入性试验有血清学试验、尿素呼气试验和粪便幽门螺杆菌抗原检测等, 上述方法因各自的局限性作为临床常规检测受到一定限制, 如: 血清H. pylori-IgG抗体在菌体根除后较长时间内仍保持阳性, 一般需6 mo后才能检出其滴度的降低; 而尿素呼气试验虽可反映受检当时菌体的存在状况, 但因其直接受H. pylori尿素酶活性影响, 而抗生素或PPI阻滞剂等在投药过程中或投药后均可影响尿素酶活性, 因此容易造成假阴性结果, 且检测需要特殊仪器设备和费用较高[6-10].
胃蛋白酶原是由主细胞分泌的一种存在于胃黏膜和血液循环中的蛋白酶原, PGI主要来源于胃体腺的主细胞和颈黏液细胞, PGII则来源于全胃腺(胃贲门腺、胃体腺、胃窦幽门腺)和近端十二指肠Brunner腺. 血清PG水平可以反映不同部位胃黏膜的形态和功能, 起到"血清学活检"的作用[14]. 研究证实血清PG水平与H. pylori感染相关, H. pylori 感染后可刺激主细胞, 通过增加主细胞内钙离子流、cAMP和磷酸肌醇浓度而刺激PG的合成和分泌, 主要是PGII[15-17]. 成功根除H. pylori可以改善炎细胞浸润, 使胃黏膜的慢性炎症得到明显改善, 恢复胃分泌功能, 进而影响血清PG水平[18-20], 那么血清PG含量变化可否作为一种新的H. pylori根除判定方法呢?我们对359例H. pylori相关性胃疾病患者进行常规除菌治疗, 通过比较治疗前后的血清PG含量变化发现, 成功除菌组的血清PGI, PGII值均较治疗前显著降低, 其中PGII水平的降低更为明显(为治疗前的70.3%), 因而PGI/II比值明显升高; 而未除菌组血清PG水平与治疗前相比无明显变化. 按不同胃疾病分组考察除菌前后血清PG含量变化, 结果表明成功除菌的各疾病组也具有上述变化规律, 但其变化程度不尽一致: 与治疗前相比, 除菌后浅表性胃炎组血清PGI、PGII值显著降低; 浅表萎缩性胃炎和异型增生组血清PGII值显著降低, PGI/II比值显著升高; 萎缩性胃炎组血清PGII值显著降低. 结果提示, 血清PGI、PGII及PGI/II比值均可作为H. pylori除菌疗效的判定指标, 但在具体应用时, 有必要根据疾病的不同进行适当选择.
为进一步探讨时间因素对血清PG含量变化的影响, 我们又比较分析了除菌治疗后不同时间血清PG含量的变化情况, 发现除菌治疗后早期(1, 5 mo)除菌组血清PG水平与治疗前相比即显出明显差异, 尤其是PGI/II比值显著升高; 而晚期(18 mo)PGI/II比值与治疗前相比已无明显差异. 提示: 血清PGI/II比值可作为早期除菌疗效的判定指标. 治疗后不同时间PGI/II比值变化率的ROC曲线显示: 治疗后1 mo变化率 = 130%时检测灵敏度(66.7%)、特异度(73.3%)尚好; 而治疗后5 mo变化率 = 130%或160%时, 虽特异度达80.0%以上, 但灵敏度较低.
总之, 血清PG含量作为H. pylori根除的判定指标, 在除菌治疗后早期即有明显变化; 与血清PGI或PGII相比, 除菌治疗前后PGI/II比值的变化更有意义, 变化率 = 130%可作为H. pylori根除与否的参考Cut-off值. 今后仍需进行扩大规模的深入研究, 以进一步提高其灵敏度和特异度.
编辑: N/A
| 3. | Vandenplas Y. Helicobacter pylori infection. World J Gastroenterol. 2000;6:20-31. [PubMed] [DOI] |
| 4. | Huang XQ. Helicobacter pylori infection and gastrointestinal hormones:a review. World J Gastroenterol. 2000;6:783-788. [PubMed] [DOI] |
| 5. | Cai L, Yu SZ, Zhang ZF. Helicobacter pylori infection and risk of gastric cancer in Changle County,Fujian Province,China. World J Gastroenterol. 2000;6:374-376. [PubMed] [DOI] |
| 11. | Hirasawa R, Tatsuta M, Iishi H, Yano H, Baba M, Uedo N, Sakai N. Increase in apoptosis and decrease in ornithine decarboxylase activity of the gastric mucosa in patients with atrophic gastritis and gastric ulcer after successful eradication of Helicobacter pylori. Am J Gastroenterol. 1999;94:2398-2402. [PubMed] [DOI] |
| 12. | Tari A, Kodama K, Kurihara K, Fujihara M, Sumii K, Kajiyama G. Does serum nitrite concentration reflect gastric carcinogenesis in Japanese Helicobacter pylori-infected patients? Dig Dis Sci. 2002;47:100-106. [PubMed] [DOI] |
| 13. | Shinotani A, Nishioka S, Iguchi M, Yanaoka K, Okada K, Tamai H, Mantanl Y, Itoh H, Graham DY. Duodenal erosions after eradication of Helicobacter pylori infection. Gastrointestinal Endoscopy. 2001;54:448-453. [DOI] |
| 15. | Lorente S, Doiz O, Serrano MT, Castillo J, Lanas A. Helicobacter pylori stimulates pepsinogen secretion from isolated human peptic cells. Gut. 2002;50:13-18. [DOI] |
| 17. | Mertz HR, Peterson WL, Walsh JH. "Familial hyperpepsinogenemia" and Helicobacter pylori infection. Am J Gastroenterol. 2000;95:943-946. [PubMed] |
| 18. | Kikuchi S, Kurosawa M, Sakiyama T, Tenjin H, Miki K, Wada O, Inaba Y. Long-term effect of Helicobacter pylori infection on serum pepsinogens. Jpn J Cancer Res. 2000;91:471-476. [PubMed] [DOI] |
| 19. | Karita M, Noriyasu A, Kosako E, Teramukai S, Matsumoto S. Relationship between pepsinogen I&II and H. pylori infection considered with grade of atrophy and gastroduodenal diseases. Dig Dis Sci. 2003;48:1839-1845. [PubMed] [DOI] |
| 20. | Ito M, Haruma K, Kamada T, Mihara M, Kim S, Kitadai Y, Sumii M, Tanaka S, Yoshihara M, Chayama K. Helicobacter pylori eradication therapy improves atrophic gastritis and intestinal metaplasia: a 5-year prospective study of patients with atrophic gastritis. Aliment Pharmacol Ther. 2002;16:1449-1456. [PubMed] [DOI] |