修回日期: 2004-06-11
接受日期: 2004-06-17
在线出版日期: 2004-08-15
目的: 了解原发性结直肠癌的临床病理特点和患者的遗传易感性.
方法: 调查经组织病理学证实的结直肠癌患者594例, 统计性别、年龄、家族恶性肿瘤史、个人恶性肿瘤史、肿瘤发生部位和数目、组织学类型等情况. 肿瘤发生部位分为脾曲近侧结肠、脾曲远侧结肠和全结直肠. 家族内有两个或更多个一级和/或二级亲属患有结直肠癌者, 定义为具有结直肠癌遗传易感性; 家族内有两个或更多个一级和/或二级亲属患有恶性肿瘤者, 定义为具有恶性肿瘤遗传易感性. 家族符合Amsterdam标准、Amsterdam标准Ⅱ和日本标准等中任何一个者均可诊断为遗传性非息肉病性结直肠癌(HNPCC). 根据诊断肿瘤时的年龄大小将患者分为7组.
结果: 结直肠癌患者的诊断年龄呈偏态分布, 中位诊断年龄为65.1岁. -70岁组患者最多, 在70岁以前(含70岁), 各年龄组患者的构成比随年龄增加而增大, 发病呈高龄化趋势; 但70岁以后即-80岁组和大于80岁组患者的构成比随年龄增加而降低. 肿瘤发生部位以脾曲远侧结肠为主(73.6%), 脾曲近侧结肠占25.9%, 直肠占45.3%; 肿瘤发生部位与患者的诊断年龄没有明显的相关性(P>0.05). 组织学类型以腺癌为主(87.5%), 黏液腺癌占8.2%, 印戒细胞癌占2.5%; 印戒细胞癌的构成比随年龄增大而增加(P<0.05). 多原发癌患者占13.1%, 其中多原发结直肠癌占10.1%. 17.2%的患者具有恶性肿瘤遗传易感性, 5.2%的患者具有结直肠癌遗传易感性; 符合Amsterdam标准、Amsterdam标准Ⅱ和日本标准的HNPCC的发生率分别为0.5%, 2.9%和2.4%. 多原发癌、多原发结直肠癌均与患者的恶性肿瘤家族史相关(P<0.01), 有恶性肿瘤家族史的结直肠癌患者, 更易发生多原发癌和多原发结直肠癌. 但多原发癌及多原发结直肠癌均与患者的结直肠癌家族史无明显的相关性(P>0.05).
结论: 结直肠癌患者诊断年龄呈非正态分布曲线, 发病呈老龄化趋势, 部位以脾曲远侧结肠为主, 组织学类型以腺癌为主; 17.2%的患者具有恶性肿瘤遗传易感性; 多原发癌及多原发结直肠癌的发生均与患者的恶性肿瘤家族史相关.
引文著录: 张渊智, 武子涛, 李世荣. 原发性结直肠癌594例的临床病理与遗传易感性. 世界华人消化杂志 2004; 12(8): 1809-1813
Revised: June 11, 2004
Accepted: June 17, 2004
Published online: August 15, 2004
AIM: To analyze the features of clinical pathology and hereditary predisposition of primary colorectal cancer (CRC) patients.
METHODS: A total of 594 primary CRC inpatients were continuously investigated in our hospital and cooperation hospitals. They were proved to be primary colorectal cancer by histopathological examination. The following data of all patients should be registered: sex, family history of colorectal cancer, site, number and histological type of primary cancer. Tumor sites were classified as proximal colon to the splenic flexure, distal colon to the splenic flexure and whole colorectum. Hereditary predisposition of CRC is that CRC patients have two or more first- or second-degree relatives (or both) with CRC. And hereditary predisposition of malignant tumor is that CRC patients have two or more first- or second-degree relatives (or both) with malignant tumor. Hereditary nonpolyposis colorectal cancer (HNPCC) was diagnosed by any of Amsterdam criteria, Amsterdam criteria II and Japanese criteria of HNPCC. CRC patients were divided into seven groups by the age being diagnosed.
RESULTS: The distribution of the age diagnosed as colorectal cancer was not normal distribution. The median diagnosed age of CRC patients was 65.1 years. There were more patients in -70 years group than other groups. In age of 70 years before, the proportion of patients was increasing with the increasing of age and more elder patients were found. But in more than 70 years old group, the proportion of patients was decreased by the increasing of patients age. Most of colorectal caner were located distal to the splenic flexure, and rectal cancer was in 45.3% patients. There was no correlation between tumor site and the age in CRC (P > 0.05). The most frequent histological type was adenocarcinoma (87.5%). In addition, the proportion of mucoid adenocarcinoma and signet-ring cell carcinoma were 8.2% and 5.2%, respectively. The proportion of signet-ring cell carcinoma was higher in older groups (P < 0.05). As to the proportion of multiple primary cancers, multiple primary CRCs, hereditary predisposition of cancer and hereditary predisposition of colorectal cancer were 13.1%, 10.1%, 17.2% and 5.2%, respectively. The incidence of HNPCC diagnosed by Amsterdam criteria, Amsterdam criteria Ⅱ and Japanese criteria of HNPCC were 0.5%, 2.9% and 2.4%, respectively. The correlation had been found between the occurrences of multiple primary cancers and multiple primary CRCs with familial history of malignant tumors (P < 0.05), and there were more multiple primary cancers and multiple primary CRCs in CRC patients with familial history of malignant tumors. But obvious correlation was not found between the occurrence of multiple primary cancers and multiple primary CRCs with familial history of CRCs (P > 0.05).
CONCLUSION: Age of patients with colorectal cancer is not normal distribution, and the proportion of elder patients with colorectal cancer becomes higher in all CRC patients. Most of tumors locate distal to the splenic flexure and adenocarcinoma is the most common histological type. There are 17.2% colorectal cancer patients with hereditary cancer predisposition. The occurrences of multiple primary cancers and multiple primary CRCs are correlated with familial history of malignant tumors.
- Citation: Zhang YZ, Wu ZT, Li SR. Clinical pathology and hereditary predisposition in patients with primary colorectal cancer: An analysis of 594 cases. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1809-1813
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1809.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1809
原发性结直肠癌(colorectal cancer, CRC)是临床上常见的恶性肿瘤, 我国的发病率和死亡率呈逐年上升的趋势[1-2], 及时了解近年来发病的患者的临床病理特点, 对于我国原发性结直肠癌的防治工作具有重要的意义. 在所有结直肠癌患者中, 大约有20%左右的患者具有遗传易感性, 即家族内有两个或更多个一级和/或二级亲属患有结直肠癌[3]. 我们通过分析北京及其周边地区的594例结直肠癌的病例资料, 探讨中国人结直肠癌的临床病理特点及患者的肿瘤遗传易感性.
为2002-01/2002-12收治的具有完整记录并经组织学检查确诊的594例结直肠癌患者. 病理诊断报告按1986年全国结直肠癌病理协作组制定的全国结直肠癌病理研究统一规范进行, 分为腺癌、黏液腺癌、印戒细胞癌、其他(包括未分化癌、腺鳞癌、鳞癌和类癌)等组织学类型. 男325例, 女269例, 男女比例为1.21: 1, 年龄21-95岁. 根据诊断肿瘤时的年龄大小将患者分为7组, 即≤30岁、-40岁、-50岁、-60岁、 -70岁、-80岁和 >80岁等组.
所有患者均填写原发性结直肠癌患者调查表, 内容包括姓名、性别、出生日期、确诊结直肠癌的时间、家族恶性肿瘤史、个人恶性肿瘤史、肿瘤发生部位和数目、组织学类型等情况. 组织学类型包括腺癌(分为高分化、中分化和低分化)、黏液腺癌、印戒细胞癌、类癌和其他类型(包括未分化癌、鳞癌、腺鳞癌等)等; 对于同时存在2种以上分化程度不同的成分的腺癌患者, 按分化程度较低者统计; 腺癌与其他组织学类型同时存在时, 按其他组织学类型统计; 黏液腺癌与印戒细胞癌同时存在者, 则分别统计. 肿瘤发生部位分为脾曲近侧结肠、脾曲远侧结肠和全结直肠, 脾曲近侧结肠限定在盲肠、升结肠、结肠肝曲和横结肠; 脾曲远侧结肠癌限定在结肠脾曲、降结肠、乙状结肠和直肠; 脾曲近侧结肠和远侧结肠均有肿瘤发生者, 则统计为全结直肠癌. 如患者家族内有两个或更多个一级和/或二级亲属(包括患者本人)患有结直肠癌, 则定义为具有结直肠癌遗传易感性[3]; 参考上述标准, 如患者家族内有两个或更多个一级和/或二级亲属患有恶性肿瘤(包括患者本人), 则定义为具有恶性肿瘤遗传易感性. 遗传性非息肉病性结直肠癌(hereditary nonpolyposis colorectal cancer, HNPCC)的临床诊断标准分为Amsterdam标准、Amsterdam标准Ⅱ和日本标准. Amsterdam标准为[4]: 家系中至少有3个亲属患结直肠癌(1)其中1例必须是另外2例的一级亲属(2)至少连续累及两代人(3)至少1例患者在50岁以前诊断(4)排除家族性腺瘤病(familial adenomatous polyposis, FAP)(5)组织病理学检查证实肿瘤. Amsterdam标准Ⅱ为[5]: 家系中至少有3个亲属患HNPCC相关癌(结直肠癌、子宫内膜癌、小肠癌、输尿管或肾盂癌), (1)其中1例是另外2例的一级亲属(2)至少连续影响2代人(3)至少1例患者在50岁以前诊断(4)排除FAP(5)组织病理学检查证实肿瘤. 对Amsterdam标准Ⅱ中结直肠外肿瘤谱略作修改, 包括胃癌、肝癌等多种器官的恶性肿瘤[5]. 日本HNPCC诊断标准为[6]: 一个结直肠癌患者有2个以上一级亲属患有结直肠癌或一个结直肠癌患者有1个一级亲属患有结直肠癌, 并具备下列条件之一者: (1)患癌年龄<50岁; (2)右半结肠受累; (3)有同步癌或异时癌; (4)伴有肠外癌; 此外还必须排除FAP. 符合上述任何一个标准者均可诊断为HNPCC.
统计学处理 采用SPSS 10.0统计软件包对资料进行描述性分析, 相关性检验采用x2检验, 显著性水准α = 0.05; 计量资料的正态性检验采用动差法, 显著性水准α = 0.20, 分布曲线的偏度与峰度均为P>0.20时可认为资料服从正态分布.
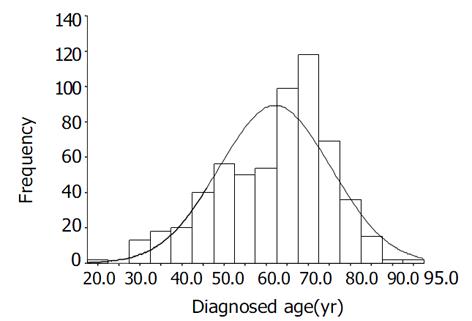
结直肠癌患者的诊断年龄呈非正态分布曲线(偏度系数检验时P<0.20, 峰度系数检验时P>0.20). 患者的中位诊断年龄为65.1岁, 平均诊断年龄为62.1±13.3岁. ≤30岁、-40岁、-50岁、-60岁、-70岁、-80岁、80岁小于等年龄组的患者例数分别为7(1.2%), 39(6.6%), 81(13.6%), 102(17.2%), 199(33.5%), 133(22.4%), 33(5.6%), 其中-70岁组患者最多. 在70岁以前(含70岁), 各年龄组患者的构成比随年龄的增加而增大, 发病呈高龄化趋势; 但70岁以后, -80岁组和大于80岁组的患者构成比随年龄的增加而降低(图1). 肿瘤发生部位在脾曲近侧结肠者154例(25.9%), 脾曲远侧结肠者437例(73.6%), 全结直肠者3例(0.5%), 其中直肠癌269例(45.3%). 脾曲远侧结肠癌和脾曲近侧结肠癌的构成比均与患者的诊断年龄无明显的相关性(P>0.05), 脾曲远侧、近侧结肠肿瘤的发生情况均与诊断年龄无关; 直肠癌的发生情况也与诊断年龄无明显的相关性(P>0.05, 表1). 腺癌为惟一癌者共520例(87.5%); 其中的高分化腺癌占21.5%, 中分化腺癌占66.4%, 低分化腺癌占12.1%. 黏液腺癌和印戒细胞癌分别为49例(8.2%)和15例(2.5%), 其中5例(0.8%)患者同时具有黏液癌和印戒细胞癌. 此外, 还有类癌7例(1.2%); 其他组织学类型5例(0.8%), 包括腺鳞癌1例(56岁), 恶性淋巴瘤2例(分别为52岁、69岁), 恶性间质瘤1例(69岁), 直肠恶性黑色素瘤2例(分别为65岁、68岁), 降结肠恶性小细胞癌(32岁). 腺癌的分化程度及黏液腺癌的发生均与患者的诊断年龄无明显的相关性(P>0.05); 印戒细胞癌的发生与患者的诊断年龄相关(P<0.05, 表2), 构成比随年龄的增长而增加. 类癌和其他组织学类型例数过少, 没有进行统计学分析. 既往患恶性肿瘤和/或同时具有多个原发癌灶即多原发恶性肿瘤的患者共有78例, 占13.1%; 其中多原发结直肠癌既往患结直肠癌和/或同时具有多个结直肠癌原发癌灶的患者60例, 占10.1%.
| 年龄(岁) | 发病部位1 | 直肠2 | ||
| 脾曲近侧 | 脾曲远侧 | 全结直肠 | ||
| ≤30 | 1 (14.3) | 6 (85.7) | 0 (0.0) | 3 (42.9) |
| -40 | 11 (28.2) | 28 (71.8) | 0 (0.0) | 20 (51.3) |
| -50 | 13 (16.0) | 66 (81.5) | 2 (2.5) | 38 (46.9) |
| -60 | 33 (32.4) | 69 (67.6) | 0 (0.0) | 42 (41.2) |
| -70 | 56 (28.1) | 143 (71.9) | 0 (0.0) | 93 (46.7) |
| -80 | 32 (24.1) | 100 (75.2) | 1 (0.7) | 63 (47.4) |
| > 80 | 8 (24.2) | 25 (75.8) | 0 (0.0) | 10 (30.3) |
| 合计 | 154 (25.9) | 437 (73.6) | 3 (0.5) | 269 (45.3) |
家族中有两个或两个以上一级和/或二级亲属患恶性肿瘤的患者共102例, 占17.2%, 即17.2%的患者具有恶性肿瘤遗传易感性; 家族中有两个或两个以上一级和/或二级亲属患结直肠癌的患者31例, 占患者总数的5.2%, 即5.2%的患者具有结直肠癌遗传易感性. 3例患者的家族符合Amsterdam标准诊断的HNPCC家系(0.5%), 17例患者的家族符合Amsterdam标准Ⅱ诊断的HNPCC家系(2.9%), 14例患者的家族符合日本标准诊断的HNPCC家系(2.4%). 无恶性肿瘤家族史的多原发癌和多原发结直肠癌患者分别为54例(9.1%)、40例(6.7%), 有家族史者分别为24例(4.0%)、20例(3.4%); 无结直肠癌家族史的多原发癌和多原发结直肠癌患者分别为71例(12%)、54例(9.1%), 有家族史者分别为7例(1.2%)、6例(1.0%). 多原发癌、多原发结直肠癌的发生均与恶性肿瘤家族史相关(P<0.01, 表3), 具有恶性肿瘤家族史的原发性结直肠癌患者, 更易发生多原发癌和多原发结直肠癌. 但多原发癌及多原发结直肠癌的发生均与结直肠癌家族史无明显的相关性.
结直肠癌是消化系统最常见的恶性肿瘤之一, 近年来发病率和死亡率均有逐年上升的趋势[1-2], 并且发病高峰年龄后移[7-8]. 本组594例结直肠癌, 在70岁以前(含70岁), 各年龄组患者的构成比随年龄的增大而增加, 其中-70岁组患者的构成比最大(33.5%), 与张明刚et al[7]、莫维光et al[9]关于同一时期患者的报道类似. 目前国内在选择描述原发性结直肠癌患者发病或诊断年龄分布集中趋势的指标方面, 存在较大的差异[7,9]. 平均年龄与中位年龄是目前描述患者发病或诊断年龄集中趋势时最常使用的两个指标, 但二者的应用范围具有明显的差异. 均数是用于描述对称性分布即正态分布资料集中趋势的指标, 而中位数则常用于描述偏态分布资料的集中位置, 反映位次居中的观察值水平; 在正态分布资料中, 均数和中位数在理论上数值是相同的, 而在偏态分布资料中, 均数则不能较好地反映分布的集中趋势. 本组结直肠癌患者的诊断年龄分布为非正态分布(偏度系数检验时P<0.20, 峰度系数检验时P>0.20), 因此与平均年龄相比较, 中位发病或诊断年龄是描述原发性结直肠癌患者发病或诊断年龄集中趋势更为准确的指标. 本组患者的中位诊断年龄为65.1岁, 与张明刚et al[7]关于同一时期北京地区患者的报道(62岁)相似, 但与万德森 et al[8]关于南方地区人群的报道差异较大. 原因可能是: (1)地区差异, 包括环境、遗传背景、生活方式、平均寿命等因素; (2)资料所处时代和跨越的年代不同, 本组资料为21世纪收集的、仅跨越1年的资料, 与其他所处年代和跨越时间不同的资料之间缺乏可比性. 本组在70岁以前(含70岁)诊断为原发性结直肠癌的年龄组, 患者的构成比随年龄增大而增加, 但70岁以后年龄组的患者的构成比则随年龄的增大而下降, 这是由于人类寿命的有限性客观上造成了老年人群(尤其是大于70岁者)绝对数量的急剧减少, 最终导致来自于这部分人群的患者的绝对数量急剧减少.
本组结直肠癌发生部位在脾曲近侧结肠者占25.9%, 脾曲远侧结肠者占73.6%, 其中直肠发生肿瘤的患者占45.3%, 与国内大部分报道相似[7-8,10], 但直肠癌的构成比与莫维光et al[9]的报道相差较大, 可能与地区差异有关. 在各年龄组中, -60岁组脾曲近侧结直肠癌的构成比最高(32.4%), ≤30岁组最低(14.3%), 但年龄组之间的差异无显著性意义(P>0.05), 与国内其他相关报道类似[7,10]. 欧美国家的研究显示, 随着年龄的增大, 脾曲近侧结肠癌的比例明显增加, 尤其在高龄患者中更为明显[11-12]; 日本的资料也显示了类似的结果[13], 明显不同于我们的研究和国内其他学者的报道[7,10]. 原发性结直肠癌的发生与社会经济、生活水平、生活方式、生活环境、人种、遗传等多种因素有关, 尤其是与膳食结构的关系更为密切[12,14-17]. 而且肿瘤的发生部位也与人种、体形、生活习惯、遗传等因素密切相关[12,18-21], 中国人与欧美人、日本人等原发性结直肠癌发生部位的差异, 可能与这些因素有关. 原发性结直肠癌的主要组织学类型有腺癌、黏液腺癌、印戒细胞癌、类癌, 此外还有未分化癌、鳞癌、腺鳞癌等类型; 其中腺癌又可分为高分化、中分化、低分化等3种类型.本组资料中, 腺癌最多(87.5%), 其次是黏液腺癌(8.2%)、印戒细胞癌(2.5%)和类癌(1.2%), 其中5例(0.8%)患者同时具有黏液腺癌和印戒细胞癌. 腺癌、黏液腺癌、印戒细胞癌等组织学类型的构成比与国内部分学者的报道相似[10,21]; 与国内其他报道存在差异, 主要原因可能是采用的组织学分类方法不同, 无法进行比较[7,9]. 规范化和使用统一的临床病理组织学分类方法, 将有助于推动我国原发性结直肠癌的研究与防治. 在腺癌患者中, 以中分化腺癌最为常见(占66.4%), 低分化腺癌最少(占12.1%). 本组结直肠癌患者是否发生腺癌、腺癌的分化程度及是否发生黏液腺癌等均与患者的诊断年龄无关(P>0.05); 印戒细胞癌的发生与患者的诊断年龄相关(P<0.05), 构成比随年龄的增长而增加, 明显不同于国内其他学者的相关报道 [10,21]. 由于本组黏液腺癌与印戒细胞癌的样本数量较少, 结直肠癌组织学类型与患者年龄的相关性有待进一步研究.
遗传易感性(hereditary predisposition)是指由遗传因素决定的易于罹患某种(某类)疾病的倾向性(susceptibility). 目前认为肿瘤是基因染色体异常引起的疾病, 其中一些遗传性肿瘤按照经典的孟德尔方式传递, 但在更多情况下遗传的只是肿瘤的易感性, 即易感基因(predisposing genes), 在个体易感染状态下如再发生体细胞突变, 突变细胞就容易转化为肿瘤细胞. 在临床上一般通过患者的恶性肿瘤家族史和个人史判断恶性肿瘤遗传易感性的大小. 西方国家的研究发现, 大约20%的原发性结直肠癌患者具有遗传风险, 即家族内有两个或更多个一级和/或二级亲属患有结直肠癌; 其中5%-10%的患者属于孟德尔遗传, 即常染色体显性遗传[3]. 上海地区的资料显示, 原发性结直肠癌患者家族中一级亲属发生两个或更多个结直肠癌者占5.6%[22]. 在本组的北方原发性结直肠癌患者中, 家族中一级和/或二级亲属发生两个或更多个结直肠癌的患者占5.2%, 一级和/或二级亲属发生两个或更多个恶性肿瘤的患者占17.2%, 与上海地区存在一定的差异, 原因可能与本组资料样本含量较小和南、北人群的地区、遗传等差异有关. 国外研究显示, 至少有一个原发癌是结直肠癌的多原发癌患者, 与单原发结直肠癌患者相比较, 更可能是HNPCC (P<0.0 001)[23]. 本组患者中, 发生多原发恶性肿瘤、多原发结直肠癌的患者分别占13.1%、10.1%, 其中无家族史者分别占9.1%和6.7%, 并且多原发恶性肿瘤、多原发结直肠癌的发生均与患者的恶性肿瘤家族史相关(P<0.01), 有恶性肿瘤家族史者更常发生多原发恶性肿瘤与多原发结直肠癌; 但与患者是否具有结直肠癌家族史, 没有明显的相关性(P>0.05). 上述结果与国外学者的相关报道类似[24], 国内尚未见类似的报道. 如果把具有恶性肿瘤家族史和/或多原发癌患者作为具有恶性肿瘤遗传易感性的患者, 本组的原发性结直肠癌患者中具有恶性肿瘤遗传易感性的患者高达26.3%(156/594), 而具有结直肠癌遗传易感性(包括无恶性肿瘤家族史的多原发结直肠癌患者与有结直肠癌家族史的患者)者亦占14.3%(85/594). HNPCC综合征, 又称Lynch综合征(lynch syndrome), 是最常见的一种常染色体显性遗传结直肠癌综合征, 外显率高达80%-85%, 约占所有结直肠癌患者的1-3%[25]. 在我国原发性结直肠癌人群中, 符合Amsterdam标准诊断的HNPCC的发生率为1.1%-2.6%[26-28], 符合Amsterdam标准Ⅱ诊断的HNPCC的发生率为3.6%-8.7%[28-29], 符合日本HNPCC临床诊断标准的HNPCC的发生率为1.6%-3.5%[26-27,30-31]. 本组原发性结直肠癌患者中, 符合Amsterdam标准、Amsterdam标准Ⅱ和日本标准等诊断的HNPCC的发生率分别为0.5%、2.9%和2.4%. 符合Amsterdam标准诊断的HNPCC的发生率较国内其他学者的报道低[26-28], 可能与本组患者样本量较小有关; 符合其他标准的HNPCC的发生率与国内其他学者的报道相当[26-31].
原发性结直肠癌是一种与社会、环境、遗传等多种因素密切相关的恶性肿瘤, 在社会发展的不同时期及时分析和认识原发性结直肠癌的临床病理特点和遗传易感性, 对结直肠癌的防治具有重要的意义. 本组资料虽然仅覆盖北京及其周边地区, 但在一定程度上反映了北方地区结直肠癌的临床病理特征和人群的易患性, 资料具有很好的代表性, 为我国尤其是北京地区结直肠癌的防治工作, 提供了一定的科学依据.
编辑: N/A
| 2. | 郑 晶泉, 冯 莉莉, 阮 晓楠, 陆 勇. 上海浦东新区大肠癌发病的流行病学研究. 中国慢性疾病预防与控制. 2003;11:110-111. |
| 3. | Lynch HT, de la Chapelle A. Hereditary colorectal cancer. N Engl J Med. 2003;348:919-932. [PubMed] [DOI] |
| 4. | Vasen HF, Mecklin JP, Khan PM, Lynch HT. The International Collaborative Group on Hereditary Non-Polyposis Colorectal Cancer (ICG-HNPCC). Dis Colon Rectum. 1991;34:424-425. [PubMed] [DOI] |
| 5. | Vasen HF, Watson P, Mecklin JP, Lynch HT. New clinical criteria for hereditary nonpolyposis colorectal cancer (HNPCC, Lynch syndrome) proposed by the International Collaborative group on HNPCC. Gastroenterology. 1999;116:1453-1456. [PubMed] [DOI] |
| 6. | Fujita S, Moriya Y, Sugihara K, Akasu T, Ushio K. Prognosis of hereditary nonpolyposis colorectal cancer (HNPCC) and the role of Japanese criteria for HNPCC. Jpn J Clin Oncol. 1996;26:351-355. [PubMed] [DOI] |
| 11. | Cooper GS, Yuan Z, Landefeld CS, Johanson JF, Rimm AA. A national population-based study of incidence of colorectal cancer and age. Implications for screening in older Americans. Cancer. 1995;75:775-781. [PubMed] [DOI] |
| 12. | Nelson RL, Dollear T, Freels S, Persky V. The relation of age, race, and gender to the subsite location of colorectal carcinoma. Cancer. 1997;80:193-197. [PubMed] [DOI] |
| 13. | Okamoto M, Shiratori Y, Yamaji Y, Kato J, Ikenoue T, Togo G, Yoshida H, Kawabe T, Omata M. Relationship between age and site of colorectal cancer based on colonoscopy findings. Gastrointest Endosc. 2002;55:548-551. [PubMed] [DOI] |
| 14. | 陈 坤, 裘 炯良, 张 扬. 大肠癌危险因素的Meta分析. 浙江大学学报(医学版). 2002;31:254-258. |
| 15. | Zheng S, Cai SR. Colorectal cancer epidemiology and prevention study in China. Chinese German J Clin Oncol. 2003;2:72-75. [DOI] |
| 17. | Giovannucci E. Diet, body weight, and colorectal cancer: a summary of the epidemiologic evidence. J Womens Health (Larchmt). 2003;12:173-182. [PubMed] [DOI] |
| 18. | Platz EA, Giovannucci E, Rimm EB, Rockett HR, Stampfer MJ, Colditz GA, Willett WC. Dietary fiber and distal colorectal adenoma in men. Cancer Epidemiol Biomarkers Prev. 1997;6:661-670. [PubMed] |
| 19. | Slattery ML, Curtin KP, Edwards SL, Schaffer DM. Plant foods, fiber, and rectal cancer. Am J Clin Nutr. 2004;79:274-281. [PubMed] |
| 20. | Wei EK, Giovannucci E, Wu K, Rosner B, Fuchs CS, Willett WC, Colditz GA. Comparison of risk factors for colon and rectal cancer. Int J Cancer. 2004;108:433-442. [PubMed] [DOI] |
| 23. | Brown SR, Finan PJ, Bishop DT. Are relatives of patients with multiple HNPCC spectrum tumours at increased risk of cancer? Gut. 1998;43:664-668. [PubMed] [DOI] |
| 24. | Slattery ML, Mori M, Gao R, Kerber RA. Impact of family history of colon cancer on development of multiple primaries after diagnosis of colon cancer. Dis Colon Rectum. 1995;38:1053-1058. [PubMed] [DOI] |
| 25. | Chung DC, Rustgi AK. The hereditary nonpolyposis colorectal cancer syndrome: genetics and clinical implications. Ann Intern Med. 2003;138:560-570. [PubMed] [DOI] |
| 28. | Cai SJ, Xu Y, Cai GX, Lian P, Guan ZQ, Mo SJ, Sun MH, Cai Q, Shi DR. Clinical characteristics and diagnosis of patients with hereditary nonpolyposis colorectal cancer. World J Gastroenterol. 2003;9:284-287. [PubMed] [DOI] |