修回日期: 2004-03-11
接受日期: 2004-03-24
在线出版日期: 2004-08-15
目的: 探讨谷胱甘肽S-转移酶(GST)T1空白基因型和吸烟与散发性大肠腺癌(SCRAC)遗传易感性关联.
方法: 应用多重PCR技术, 检测GSTT1基因多态性.
结果: GSTT1空白基因型在吸烟大于10支/d的对照组和SCRAC组中的频率差异有显著性(x2 = 5.35, P = 0.021), 在重度吸烟的远端SCRAC(x2 = 6.48, P = 0.011)、非老年人SCRAC(x2 = 4.53, P = 0.033)及低分化肿瘤(x2 = 4.02, P = 0.045)与重度吸烟的对照组之间的频率差异均有显著性, 不同Dukes 分期重度吸烟的SCRAC分别与重度吸烟的对照组比较, GSTT1空白基因型频率的差异无显著性.
结论: GSTT1空白基因型提高了重度吸烟的个体患SCRAC的危险性, GSTT1空白基因型与重度吸烟的远端SCRAC的易感性之间存在关联, 肿瘤多见于非老年患者, 多呈低分化性腺癌.
引文著录: 时昭红, 陈金霞, 邓长生, 周燕. 散发性大肠腺癌易感性与吸烟和GSTT1空白基因型. 世界华人消化杂志 2004; 12(8): 1806-1808
Revised: March 11, 2004
Accepted: March 24, 2004
Published online: August 15, 2004
AIM: To analyze the association genetic polymorphisms of glutathione S-transferase T1 (GSTT1) and smoking with genetic susceptibility to sporadic colorectal adenocarcinoma (SCRAC).
METHODS: All subjects were unrelated Han people in Hubei province of China. Using multiplex PCR, we studied the genetic polymorphisms of the GSTT1 genes.
RESULTS: The difference of frequency of GSTT1 null genotype between severely-smoking SCRAC and the severely-smoking controls reached statistical significance (x2 = 5.35,P = 0.021). The frequency of GSTT1 null genotype was more common in the distal SCRAC with severely-smoking(x2 = 6.48, P = 0.011), in the non-elder SCRAC with severely-smoking (x2 = 4.53, P = 0.033), and in the poorly-differentiated SCRAC with severely-smoking (x2 = 4.02, P = 0.045) when compared with the severely-smoking controls. On the other hand, compared with the severely-smoking controls, all the difference of frequency of GSTT1 null genotype in severely-smoking SCRAC with various Dukes stages did not reach statistical significance, respectively.
CONCLUSION: The GSTT1 null genotype may augment the risk of SCRAC with severely-smoking, especially the non-elder patients, and most tumors are distal SCRACs and poorly-differentiated SCRAC.
- Citation: Shi ZH, Chen JX, Deng CS, Zhou Y. Correlation of GSTT1 gene polymorphism and smoking with susceptibility to sporadic colorectal adenocarcinoma in China. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1806-1808
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1806.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1806
毒物代谢酶的遗传多态现象是肿瘤遗传易感性的重要方面. 谷胱甘肽S-转移酶(GST)T1是II相毒物代谢酶的重要成员, 广泛存在多态性, 具有GSTT1基因多态的个体对进入体内致癌物的降解能力下降, 机体易患恶性肿瘤[1-2]. 燃烧的烟草烟雾中含有多种致癌物质, 长期吸食烟草的个体与多种恶性肿瘤相关. 我们探讨GSTT1基因多态和吸烟与散发性大肠腺癌(SCRAC)遗传易感性关联.
经病理组织学确诊的SCRAC患者104例, 来自武汉市一医院及武汉大学中南医院消化内科内镜室. 重度吸烟的SCRAC 56例, 其中≥60岁者32例; 肿瘤位于近端大肠者15例; Dukes分期: A期14例、B期20例、C期22例; 高分化腺癌10例、中度分化性腺癌26例、低分化腺癌20例. 对照组101例, 为同期在两院体检的无血缘关系的健康人. 研究对象均为湖北地区汉族人, 其性别比、平均年龄相似.
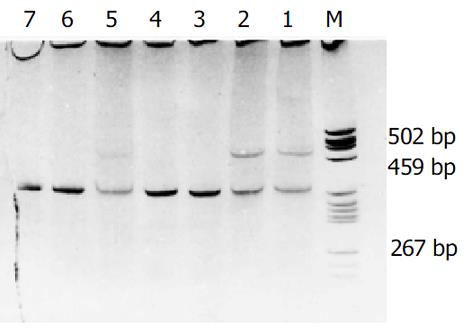
GSTT1基因型检测(多重PCR法) 以研究对象外周血提取的基因组DNA(碘化钠法)为模板, 行多重PCR检测, 参照GenBank提供的DNA序列设计引物二对, 扩增GSTT1的引物为: 5'-TTCCTTACTGGTCCTCACATCTC-3'和5'-TCACCGGATCATGGCC AGCA-3', 同时扩增β-globulin为内参照, 所用引物为: 5'-CAACTTCATCCACGTTCACC-3'和5'-GAAGAGCCAAGGACAGGTAC-3'. 反应条件为: 97 ℃预变性5 min后, 95 ℃变性45 s, 57 ℃退火45 s, 72 ℃延伸60 s, 循环35次后, 72 ℃再延伸5 min. PCR产物经50 g/L聚丙烯酰胺凝胶电泳(PAGE), 1.8 g/L硝酸银染色分析结果(如图示GSTT1非空白基因型的PCR产物长480 bp、β-globulin的PCR产物长268 bp).
统计学处理 以x2检验分析病例组、对照组之间GSTT1空白基因型频率分布的差异, 以非条件Logistic回归法计算表示相对危险度的比值比(P)及95%可信区间(CI). P值均以潜在的混淆因素如年龄、性别和吸烟状态等校正. 本研究中, 轻度吸烟者定义为每日吸烟超过1支, 持续1年以上; 每日超过10支者定义为重度吸烟者.
本组研究对象中, 对照组: 男女比为70/31, 年龄均数为55.8±15.4岁, GSTT1空白基因型频率为47.5%(48); SCRAC组分别为67/37, 59.2±15.8岁和60.6%(63), 两组间男女比、年龄均数以及GSTT1空白基因型频率的差异均无显著性, 可初步认为GSTT1空白基因型与SCRAC的发生无关系. 病例组中重度吸烟人数比例显著高于对照组(x2 = 8.50, v = 2, P = 0.014), 据此计算, 重度吸烟引起SCRAC相对危险度为2.30(95%CI = 1.32-4.02).
GSTT1空白基因型在不吸烟的对照组与SCRAC组之间及在吸烟小于10支/d的对照组与SCRAC组之间的频率差异均无显著性(前者x2 = 0.34, P = 0.56; 后者x2 = 0.51, P = 0.47); GSTT1空白基因型在吸烟大于10支/d(重度吸烟)的对照组和SCRAC组中的频率分别为47.1%、71.7%, 其差异有显著性(x2 = 5.35, P = 0.021, 表1), 提示: GSTT1空白基因型提高了重度吸烟的个体患SCRAC的危险性, 其危险性上升了近2倍.
重度吸烟老年人SCRAC的平均年龄明显高于对照组, 其差异有显著性(t = 2.55, v = 64, P<0.05); GSTT1空白基因型在重度吸烟的远端SCRAC (x2 = 6.48, P = 0.011)及非老年人SCRAC(x2 = 4.53, P = 0.033)与重度吸烟的对照组之间的频率差异均有显著性; 重度吸烟的低分化肿瘤中, GSTT1空白基因型频率显著高于重度吸烟的对照组(x2 = 4.02, P = 0.045), 不同Dukes 分期重度吸烟的SCRAC分别与重度吸烟的对照组比较, GSTT1空白基因型频率的差异无显著性. 提示, GSTT1空白基因型与重度吸烟的远端SCRAC的易感性之间存在关联, 且肿瘤多见于非老年患者, 多呈低分化性腺癌, 与Dukes C期无关(表2)(图1).
| 分组 | n | 男/女 | 年龄mean±SD | GSTT1空白基因型(n) | 校正OR(95%Cl) |
| 重度吸烟对照组 | 34 | 25/9 | 55.2±16.0 | 47.1% (16) | |
| 重度吸烟SCRAC | 56 | 39/17 | 59.4±15.5 | 71.4% (40) | 2.81 (1.15-6.82) |
| 近端 | 15 | 9/6 | 58.2±15.4 | 60.0% (9) | 1.69 (0.50-5.74) |
| 远端 | 41 | 30/11 | 59.6±15.8 | 75.6% (31)b | 3.49 (1.33-9.14) |
| 非老年 | 24 | 14/10 | 55.4±13.6 | 75.0% (18)b | 3.38 (1.10-10.40) |
| 老年 | 32 | 25/7 | 64.8±14.4b | 68.9% (22) | 2.48 (0.91-6.74) |
| Dukes A | 14 | 10/4 | 59.0±15.2 | 71.4% (10) | 2.81 (0.76-10.40) |
| Dukes B | 20 | 15/5 | 59.8±15.0 | 70.0% (14) | 2.63 (0.82-8.39) |
| Dukes C | 22 | 14/8 | 58.2±14.8 | 72.7% (16) | 3.00 (0.96-9.40) |
| 高分化 | 10 | 7/3 | 59.2±14.4 | 70.0% (7) | 2.63 (0.60-11.55) |
| 中分化 | 26 | 17/9 | 58.6±15.0 | 69.2% (18) | 2.53 (0.88-7.29) |
| 低分化 | 20 | 15/5 | 59.4±15.4 | 75.0% (15)b | 3.38 (1.02-11.15) |
因吸烟、食过熟或熏制肉食及工作环境等人们经常接触杂环芳香胺类和多环芳烃类致癌物, 该类致癌物在肝内、肠黏膜上皮细胞内及肠腔内常被细胞色素P450(CYP)1A2、N-乙酰化转移酶(NAT)等活化为N-羟基代谢物、N-乙酰氧化芳香胺及二羟基酮环氧化物等前致癌物[1,3]. 而GST携带的活性基团-谷胱甘肽易与上述前致癌物结合, 并促进其排出体外, 是体内重要的解毒酶. GST呈空白基因型的个体, 肠内致癌原增多, 大肠癌的危险性增加. 多数学者认为GSTT1空白基因型与大肠癌遗传易感性有关[2,4-5], 但也有持异议者[6-8]. Zhang et al[4]报告, 携带GSTT1空白基因型的个体易患大肠癌, 且以老年患者和低分化性腺癌多见, 认为GSTT1是大肠内致癌物的重要解毒酶. Welfare et al[5]指出, NAT2基因多态可能是大肠癌的危险因素, 而且呈GSTT1空白基因型和NAT2慢代谢型的个体, 患大肠癌的危险性显著增加(P = 2.3, 95%CI = 1.1-5.0). Gertig et al[6]则认为, GSTT1空白基因型并不增加大肠癌的危险性(P = 0.8, 95%C1 = 0.5-1.2), 我们的研究结果也认为GSTT1空白基因型与SCRAC的易感性无关联[7-8]. 上述研究结论的差异, 可能与不同种族的研究对象之间生活方式、饮食习惯及遗传素质的差异有关.
吸烟是否为大肠癌独立的危险因素, 国内无流行病学研究支持. Inoue et al[9]认为吸烟与大肠癌的危险性明显相关, 且该相关性不受GSTM1及CYP1A1基因多态性的影响. Giovannucci et al[10]报道, 吸烟与大肠腺瘤及大肠癌强相关, 且长期吸烟明显增加大肠腺瘤和大肠癌的危险性. 我们发现, 病例组中重度吸烟人数比例显著高于对照组, 重度吸烟引起SCRAC的相对风险度为2.30(95%CL = 1.32-4.02); 重度吸烟(吸烟大于10支/d)的SCRAC患者GSTT1空白基因型的频率显著高于重度吸烟的对照组(P = 0.021, 校正P = 2.81, 95% = 1.15-6.82), 可初步认为GSTT1空白基因型可明显提高重度吸烟的个体患SCRAC的危险性.
目前, GSTT1空白基因型与重度吸烟的SCRAC临床病理特征的关系探讨少见报道. 我们对重度吸烟的SCRAC分组研究发现: GSTT1空白基因型在重度吸烟的远端SCRAC、非老年人SCRAC、低分化肿瘤中频率显著高于重度吸烟的对照组, 而不同Dukes 分期重度吸烟的SCRAC分别与重度吸烟的对照组比较, 其频率差异无显著性, 我们的结果提示, GSTT1空白基因型与重度吸烟的远端SCRAC的易感性之间存在关联, 肿瘤多见于非老年患者, 以低分化性腺癌多见, 与Dukes C期无关.
然而, 烟草烟雾中致癌物有多种, 机体有多种途径接触到芳香胺类致癌物, 而致癌物在体内可有多条代谢途径、多种代谢酶参与. 因此, 需联合其他的毒物代谢酶进一步研究.
编辑: N/A
| 1. | de Kok TM, van Maanen JM. Evaluation of fecal mutagenicity and colorectal cancer risk. Mutat Res. 2000;463:53-101. [PubMed] [DOI] |
| 2. | Setiawan VW, Zhang ZF, Yu GP, Li YL, Lu ML, Tsai CJ, Cordova D, Wang MR, Guo CH, Yu SZ. GSTT1 and GSTM1 null genotypes and the risk of gastric cancer: a case-control study in a Chinese population. Cancer Epidemiol Biomarkers Prev. 2000;9:73-80. [PubMed] |
| 3. | Landi S. Mammalian class theta GST and differential susceptibility to carcinogens: a review. Mutat Res. 2000;463:247-283. [PubMed] [DOI] |
| 4. | Zhang H, Ahmadi A, Arbman G, Zdolsek J, Carstensen J, Nordenskjöld B, Söderkvist P, Sun XF. Glutathione S-transferase T1 and M1 genotypes in normal mucosa, transitional mucosa and colorectal adenocarcinoma. Int J Cancer. 1999;84:135-138. [PubMed] [DOI] |
| 5. | Welfare M, Monesola Adeokun A, Bassendine MF, Daly AK. Polymorphisms in GSTP1, GSTM1, and GSTT1 and susceptibility to colorectal cancer. Cancer Epidemiol Biomarkers Prev. 1999;8:289-292. [PubMed] |
| 6. | Gertig DM, Stampfer M, Haiman C, Hennekens CH, Kelsey K, Hunter DJ. Glutathione S-transferase GSTM1 and GSTT1 polymorphisms and colorectal cancer risk: a prospective study. Cancer Epidemiol Biomarkers Prev. 1998;7:1001-1005. [PubMed] |
| 9. | Inoue H, Kiyohara C, Marugame T, Shinomiya S, Tsuji E, Handa K, Hayabuchi H, Onuma K, Hamada H, Koga H. Cigarette smoking, CYP1A1 MspI and GSTM1 genotypes, and colorectal adenomas. Cancer Res. 2000;60:3749-3752. [PubMed] |
| 10. | Giovannucci E, Rimm EB, Stampfer MJ, Colditz GA, Ascherio A, Kearney J, Willett WC. A prospective study of cigarette smoking and risk of colorectal adenoma and colorectal cancer in U.S. men. J Natl Cancer Inst. 1994;86:183-191. [PubMed] [DOI] |