修回日期: 2004-02-21
接受日期: 2004-03-24
在线出版日期: 2004-08-15
目的: 探讨细胞间隙连接蛋白Cx32在肝细胞癌(hepatocellular carcinoma, HCC)及正常肝组织中的表达、定位及其在HCC发生中的意义和机制.
方法: 应用SP免疫组化方法检测Cx32蛋白在34例HCC组织和10例正常肝组织中的表达和定位.
结果: Cx32蛋白在HCC及正常肝组织中的阳性率分别为38.2%和90%, 经x2检验, Cx32蛋白在HCC中的表达低于正常肝组织(P<0.01). HCC各级(Ⅰ、Ⅱ、Ⅲ)的阳性率分别为57.1%、40%和29.4%, 其中HCCⅡ和HCCⅢ与正常肝组织相比在统计学上有显著性差异(P<0.05). 并且随着HCC分化程度的降低, 其阳性率也随之下降, 但HCC各级之间在统计学上无显著性差异. Cx32蛋白在正常肝细胞中定位于相邻细胞间相互接触的细胞膜上; 而在HCC中既定位于细胞质, 又定位于细胞膜不与邻近细胞接触的游离缘上.
结论: 间隙连接蛋白Cx32在HCC中的表达下调及定位异常可能是HCC发生的重要环节.
引文著录: 王芹, 霍继荣, 刘德良, 王学红. 肝细胞癌组织中细胞间隙连接蛋白Cx32的表达改变. 世界华人消化杂志 2004; 12(8): 1796-1799
Revised: February 21, 2004
Accepted: March 24, 2004
Published online: August 15, 2004
AIM: To investigate the significance and mechanism of expression and localization of gap junction protein Cx32 in hepatocarcinogenesis.
METHODS: The quantity and localization of Cx32 in 34 cases of HCC and 10 cases of normal liver tissue were analyzed by streptavidin-peroxidase immunohistochemical method.
RESULTS: In HCC and normal liver tissues, the positive rates of Cx32 protein were 38.2% and 90% respectively, with a significant difference between them (P < 0.01).In HCC (gradesⅠ,Ⅱ and Ⅲ), the positive rates of Cx32 protein were 57.1%,40.0% and 29.4% respectively, with a significant difference between HCCⅡ, Ⅲ and normal liver tissue (P < 0.05), and the lower the histological degree, the lower the Cx32 protein positive rate, but the detection rates of Cx32 protein had no significant difference among each histological grade.In normal liver tissue, Cx32 was detected in cytoplasmic membrane at intercellular contacts.But in HCC, Cx32 was detected mainly either intracytoplas-mically or in plasma membrane free from contact with other cells.
CONCLUSION: The decrease of Cx32 protein expression level and aberrant localization of Cx32 may play an important role in hepatocarcinogenesis.
- Citation: Wang Q, Huo JR, Liu DL, Wang XH. Expression of gap junction protein Cx32 in human hepatocellular carcinoma tissue. Shijie Huaren Xiaohua Zazhi 2004; 12(8): 1796-1799
- URL: https://www.wjgnet.com/1009-3079/full/v12/i8/1796.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i8.1796
肝癌是最常见的恶性肿瘤之一, 其死亡率在消化系统恶性肿瘤中列第三位, 仅次于胃癌和食管癌. 在肝癌中约有90%为肝细胞癌(HCC). 我国是HCC的高发国, 每年全世界有超过25万的新发病例, 而其中11万(44.7%) 就发生在中国[1]. HCC的发病机制尚不明确. 间隙连接是相邻细胞间的膜通道, 由胞膜上的连接蛋白(connexin Cx)亚单位构成. 细胞通过间隙连接所介导的细胞间通讯(gap junction intercellular communication, GJIC)进行细胞间信息和能量的传递, 调控细胞的生长、分化, 保持内环境的稳定[2-3]. Cx32是肝脏中的主要表达的连接蛋白[4]. 在肿瘤组织中Cx32的表达下调, 并可观察到其定位存在异常[5-10]. Cx32蛋白的表达的下调及定位的异常和由此产生的信号传导通路的紊乱将导致相邻细胞间的GJIC的异常[11], 人们认为这可能是HCC发生的重要机制之一. 为探索Cx32蛋白在人HCC和正常人肝组织中的表达和定位, 了解Cx32的表达和定位与HCC发生之间的关系, 我们应用SP免疫组化方法检测了34例HCC和10例正常肝组织中Cx32的表达和定位.
收集标本44例. 2001-2003年中南大学湘雅二医院外科手术切除病理学证实HCC标本34例. 男 31例, 女 3例, 年龄 27-73(45+13)岁. 并按Edmondson[12]分类标准分为Ⅰ, Ⅱ, Ⅲ 级. 所有病例术前均未经过放疗和化疗. 正常肝组织标本10例, 男8例, 女2 例, 年龄17-40(277)岁. 小鼠抗人connexin-32mAb(美国CHEMICON公司).
标本均经40 g/L甲醛固定, 石蜡包埋, 3 μm连续切片, 分别进行HE染色和免疫组化染色, 然后光镜下进行细胞形态观察, 做出病理诊断及分型. SP免疫组化染色步骤严格按照说明书步骤进行, 光镜下观察, 计数. 用已知标准的Cx32表达阳性的正常肝组织标本作阳性对照, 用PBS代替一抗作阴性对照. 细胞内出现棕黄色颗粒为阳性细胞. 每张切片在高倍镜视野下计数500个肿瘤或正常肝细胞. 阴性(-): 阳性细胞 <5%; 阳性(+): 5-50%细胞阳性染色; 强阳性(++): 阳性细胞数>50%[13].
统计学处理 实验数据采用SPSS10. 0软件进行处理. 所有结果均经x2检验. 以 = 0. 05为显著性检验水准.
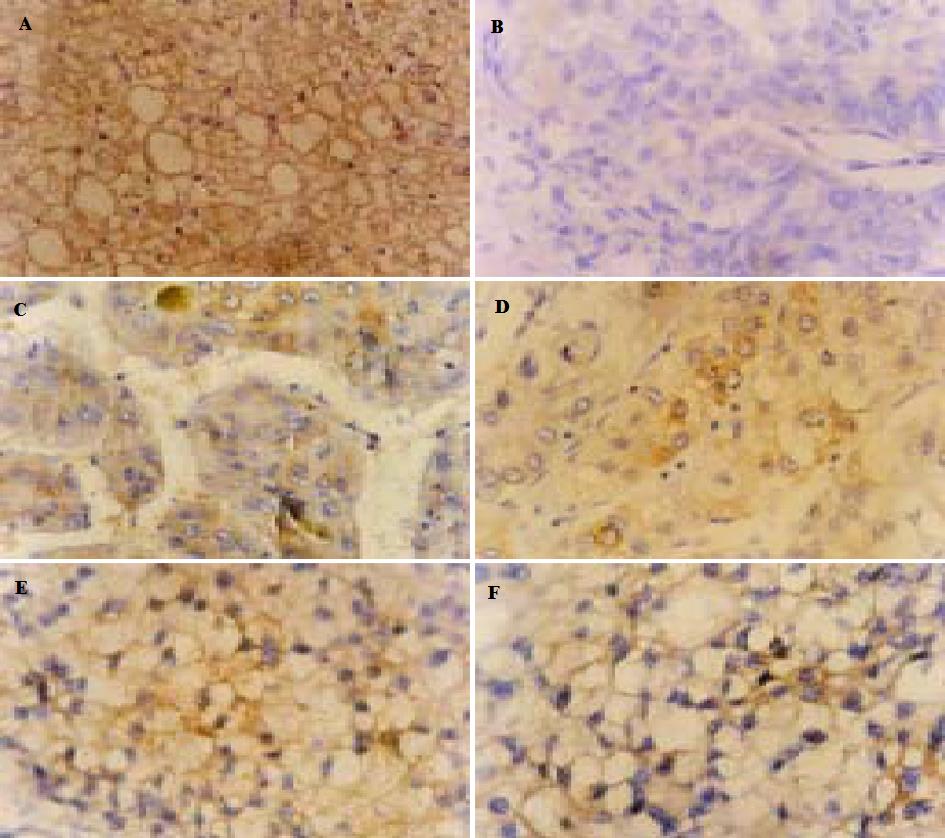
用Cx32mAb检测Cx32蛋白的免疫反应阳性显色为棕黄色颗粒.正常肝组织强阳性, 阳性颗粒呈点状分布于胞膜上(图1A); 在HCC组织中, 阳性染色弱, 阳性染色颗粒则大多分布于细胞膜上不与邻近细胞相接触的游离缘上, 或者分布于细胞质内(图1B-F).
经x2检验表明, Cx32在HCC的阳性率低于正常肝脏组织(P<0. 01)(表1). HCC组织学类型以索状/梁状型和实体型为主27例, 索状假腺型和硬化型4例, 低分化型3例. 其中1例索状/梁状型和1例索状假腺型中可见部分透明细胞. HCC 13例Cx32蛋白表达阳性, 其中在组织学类型上6例属于分化较好的索状/梁状型, 2例为索状假腺型, 4例实体型, 1例为低分化型. 在这13例阳性标本中有6例为强阳性表达, 含有部分透明细胞的2例标本均为强阳性表达, 2例索状/梁状型和1例实体型也为强阳性, 1例低分化型呈强阳性(表2). Cx32蛋白在HCCⅠ, Ⅱ, Ⅲ级中的阳性率逐渐下降, 但各级相互之间无显著性(P>0. 05). 其中HCCⅡ, Ⅲ与正常肝组织阳性率相比有显著性差异(P<0. 05)(表1).
| 组织学类型 | 索状/梁状型 | 索状假腺型 | 实体型 | 硬化型 | 低分化型 |
| 例数 | 13 | 2 | 14 | 2 | 3 |
| 阳性数 | 6 | 2 | 4 | 0 | 1 |
| 阳性率 | 46.2% | 100% | 28.6% | 0 | 33.3% |
由间隙连接通道介导的GJIC被认为在保持组织内稳态, 胚胎发育, 细胞分化, 生长调控和肿瘤发生中起来重要作用. 肿瘤被认为是生长及发育的异常, 而GJIC与细胞的分化和生长调控有关; 同时也因为GJIC对内环境的稳态的维持至关重要, 而肿瘤的形成毫无疑问存在内环境稳态的紊乱或丧失, 故人们认为GJIC的紊乱在肿瘤发生中起重要作用. 据报道已经在许多肿瘤细胞, 包括HCC细胞中发现了GJIC, 特别是异源性GJIC (heterologous GJIC)的减少, 而这种GJIC的减少使得肿瘤细胞得以逃脱系统或局部的生长控制机制, 是肿瘤的发生机制之一[7,14-16]. 导致GJIC异常的分子机制包括[17]: 连接蛋白的基因突变; 连接蛋白的表达异常; 连接蛋白的定位异常; 和受其他因子调节. 在肝脏组织中主要表达的连接蛋白是Cx32, Cx32基因在肝癌组织中的突变情况很少见[7,18]. 因此认为Cx32的基因突变未在HCC的发生中起作用, 而在HCC发生机制中起重要作用的可能是连接蛋白的表达及定位异常及其他一些因素.
本实验结果显示Cx32在正常肝脏组织较HCC阳性率高, 二者有显著性差异(P<0. 01). 这一点与马向东et al的研究结果相似[13,18]. 另外, 本实验分析了各组织学类型的HCC的Cx32蛋白的表达情况, 由于各组织学类型的样本例数较少, 无法从统计学上判定HCC的各组织学类型与Cx32蛋白表达的关系, 但我们发现在13例Cx32蛋白表达阳性的HCC样本中多以分化较好的索状/梁状型为主, 二例含有部分分化较好的透明细胞的样本表达均为强阳性. 并且按Edmondson分类标准分为HCCⅠ, Ⅱ, Ⅲ级后, 可发现随着HCC分化程度的降低, Cx32的阳性率也逐渐下降, 提示Cx32蛋白的表达与分化程度可能有关, 分化较好的组织因与正常肝组织在组织学上较接近, 故而Cx32蛋白的表达率也相对较高. 然而HCC各级间比较在统计学上无差异, 这可能也与样本例数较少相关.
此外, 我们观察到Cx32蛋白在HCC的定位存在异常: 在HCC中Cx32多定位于胞质内, 或细胞膜上不与其他细胞接触的游离缘上, 而在正常的细胞均定位于细胞间相互接触的细胞膜上. 这与Krutovskikh et al[7]的研究结果是一致的. 据报道至少有3种机制可能解释肿瘤细胞中的这种定位异常[7]. 第一, 肿瘤细胞中的Cx32蛋白可能是一种突变形式, 因此他不能插入胞膜上的正常位点. 但是至今尚未在人类肝脏肿瘤中发现Cx32编码序列的任何基因突变的证据; 第二, Cx32蛋白的转录后过程(如磷酸化)存在缺陷, 而正常的磷酸化过程对于组装好的蛋白转运到细胞膜上是至关重要的. 人们发现这种机制可以解释Cx43的定位异常, 然而却似乎不能解释Cx32的定位异常[19-21]. 第三, 一些调节Cx32蛋白在细胞内转运的因子在人类肿瘤组织中可能缺陷, 其中比较引人注目的是E-钙粘连素(E-cadherin), 有实验表明E-钙粘连素是形成有功能间隙连接所必须的[22]. 大多数研究者认为Cx32从胞质到胞膜的转运的确与E-钙粘连素有关, E-粘连素的异常可以引起Cx32的定位异常[23-26].
本实验结果显示HCC中存在Cx32蛋白的表达下调和定位异常, Cx32的表达下调可能直接影响了GJIC, 导致GJIC的异常; 而Cx32的定位异常使得Cx32不在能够形成功能性间隙连接的位点上, 从而产生Cx32蛋白的功能异常, 这种定位异常还可能干扰了旁观者效应(bystander effect)[27-30], 最终导致肝细胞生长失控, 去分化而恶性增生, 致肿瘤产生.Cx32蛋白的表达下调和定位异常可能参与了HCC的发生, 是HCC发生的机制之一.
编辑: N/A
| 1. | Xu HY, Yang YL, Guan XL, Song G, Jiang AM, Shi LJ. Expression of regulating apoptosis gene and apoptosis index in primary liver cancer. World J Gastroenterol. 2000;6:721-724. [PubMed] [DOI] |
| 2. | Yamasaki H, Naus CC. Role of connexin genes in growth control. Carcinogenesis. 1996;17:1199-1213. [PubMed] [DOI] |
| 3. | Bruzzone R, White TW, Paul DL. Connections with connexins: the molecular basis of direct intercellular signaling. Eur J Biochem. 1996;238:1-27. [PubMed] [DOI] |
| 4. | Holder JW, Elmore E, Barrett JC. Gap junction function and cancer. Cancer Res. 1993;53:3475-3485. [PubMed] |
| 5. | Janssen-Timmen U, Traub O, Dermietzel R, Rabes HM, Willecke K. Reduced number of gap junctions in rat hepatocarcinomas detected by monoclonal antibody. Carcinogenesis. 1986;7:1475-1482. [PubMed] [DOI] |
| 6. | Beer DG, Neveu MJ, Paul DL, Rapp UR, Pitot HC. Expression of the c-raf protooncogene, gamma-glutamyltranspeptidase, and gap junction protein in rat liver neoplasms. Cancer Res. 1988;48:1610-1617. [PubMed] |
| 7. | Krutovskikh V, Mazzoleni G, Mironov N, Omori Y, Aguelon AM, Mesnil M, Berger F, Partensky C, Yamasaki H. Altered homologous and heterologous gap-junctional intercellular communication in primary human liver tumors associated with aberrant protein localization but not gene mutation of connexin 32. Int J Cancer. 1994;56:87-94. [PubMed] [DOI] |
| 8. | Neveu MJ, Sattler CA, Sattler GL, Hully JR, Hertzberg EL, Paul DL, Nicholson BJ, Pitot HC. Differences in the expression of connexin genes in rat hepatomas in vivo and in vitro. Mol Carcinog. 1994;11:145-154. [PubMed] [DOI] |
| 9. | Tsuda H, Asamoto M, Baba H, Iwahori Y, Matsumoto K, Iwase T, Nishida Y, Nagao S, Hakoi K, Yamaguchi S. Cell proliferation and advancement of hepatocarcinogenesis in the rat are associated with a decrease in connexin 32 expression. Carcinogenesis. 1995;16:101-105. [PubMed] [DOI] |
| 10. | Yano T, Hernandez-Blazquez FJ, Omori Y, Yamasaki H. Reduction of malignant phenotype of HEPG2 cell is associated with the expression of connexin 26 but not connexin 32. Carcinogenesis. 2001;22:1593-1600. [PubMed] [DOI] |
| 11. | Hahn AF, Ainsworth PJ, Naus CC, Mao J, Bolton CF. Clinical and pathological observations in men lacking the gap junction protein connexin 32. Muscle Nerve Suppl. 2000;9:S39-S48. [PubMed] [DOI] |
| 12. | EDMONDSON HA, STEINER PE. Primary carcinoma of the liver: a study of 100 cases among 48,900 necropsies. Cancer. 1954;7:462-503. [PubMed] [DOI] |
| 14. | Trosko JE, Chang CC. Mechanism of up-regulated gap junctional intercellular communication during chemoprevention and chemotherapy of cancer. Mutat Res. 2001;480-481:219-229. [DOI] |
| 15. | Christ GJ. Gap junctions and ion channels: relevance to erectile dysfunction. Int J Impot Res. 2000;12 Suppl 4:S15-S25. [PubMed] [DOI] |
| 16. | Piechocki MP, Burk RD, Ruch RJ. Regulation of connexin32 and connexin43 gene expression by DNA methylation in rat liver cells. Carcinogenesis. 1999;20:401-406. [PubMed] [DOI] |
| 17. | Yamasaki H, Mesnil M, Omori Y, Mironov N, Krutovskikh V. Intercellular communication and carcinogenesis. Mutat Res. 1995;333:181-188. [PubMed] [DOI] |
| 18. | Omori Y, Krutovskikh V, Mironov N, Tsuda H, Yamasaki H. Cx32 gene mutation in a chemically induced rat liver tumour. Carcinogenesis. 1996;17:2077-2080. [PubMed] [DOI] |
| 19. | 马 向东, 马 兴, 隋 延仿, 王 文亮. 肝细胞肝癌和正常肝细胞间隙连接蛋白connexin32, Connexin43蛋白质酪氨酸磷酸化分析. 中华肝胆外科杂志. 2002;8:491-493. |
| 20. | Mesnil M, Asamoto M, Piccoli C, Yamasaki H. Possible molecular mechanism of loss of homologous and heterologous gap junctional intercellular communication in rat liver epithelial cell lines. Cell Adhes Commun. 1994;2:377-384. [PubMed] [DOI] |
| 21. | Elcock FJ, Deag E, Roberts RA, Chipman JK. Nafenopin causes protein kinase C-mediated serine phosphorylation and loss of function of connexin 32 protein in rat hepatocytes without aberrant expression or localization. Toxicol Sci. 2000;56:86-94. [PubMed] [DOI] |
| 22. | Jongen WM, Fitzgerald DJ, Asamoto M, Piccoli C, Slaga TJ, Gros D, Takeichi M, Yamasaki H. Regulation of connexin 43-mediated gap junctional intercellular communication by Ca2+ in mouse epidermal cells is controlled by E-cadherin. J Cell Biol. 1991;114:545-555. [PubMed] [DOI] |
| 23. | Hernandez-Blazquez FJ, Joazeiro PP, Omori Y, Yamasaki H. Control of intracellular movement of connexins by E-cadherin in murine skin papilloma cells. Exp Cell Res. 2001;270:235-247. [PubMed] [DOI] |
| 24. | Masuda T, Saito H, Kaneko F, Atsukawa K, Morita M, Inagaki H, Kumagai N, Tsuchimoto K, Ishii AH. Up-regulation of E-cadherin and I-catenin in human hepatocellular carcinoma cell lines by sodium butyrate and interferon-alpha. In Vitro Cell Dev Biol Anim. 2000;36:387-394. [PubMed] [DOI] |
| 25. | Nuruki K, Toyoyama H, Ueno S, Hamanoue M, Tanabe G, Aikou T, Ozawa M. E-cadherin but not N-cadherin expression is correlated with the intracellular distribution of catenins in human hepatocellular carcinomas. Oncol Rep. 1998;5:1109-1114. [PubMed] [DOI] |
| 26. | Wei Y, Van Nhieu JT, Prigent S, Srivatanakul P, Tiollais P, Buendia MA. Altered expression of E-cadherin in hepatocellular carcinoma: correlations with genetic alterations, beta-catenin expression, and clinical features. Hepatology. 2002;36:692-701. [PubMed] [DOI] |
| 27. | Tanaka T, Yamasaki H, Mesnil M. Induction of a bystander effect in HeLa cells by using a bigenic vector carrying viral thymidine kinase and connexin32 genes. Mol Carcinog. 2001;30:176-180. [PubMed] [DOI] |
| 28. | 邢 毅飞, 肖 亚军, 鲁 功成. 连接蛋白介导的GJIC与肿瘤自杀基因治疗时旁观者效应的关系. 国外医学. 生理、病理科学与临床分册. 2001;21:246-248. |
| 29. | 张 阿丽, 卢 运萍, 王 世宣, 何 福仙, 李 明刚, 李 静, 杨 晓葵, 胡 芳, 王 常玉, 马 丁. 卵巢癌自杀基因治疗的旁观者效应及其与间隙连接蛋白43表达的关系. 中华妇产科杂志. 2001;36:542-547. |
| 30. | McMasters RA, Saylors RL, Jones KE, Hendrix ME, Moyer MP, Drake RR. Lack of bystander killing in herpes simplex virus thymidine kinase-transduced colon cell lines due to deficient connexin43 gap junction formation. Hum Gene Ther. 1998;9:2253-2261. [PubMed] [DOI] |