修回日期: 2004-04-20
接受日期: 2004-04-27
在线出版日期: 2004-07-15
目的: 对比体外人外周血淋巴细胞对于异种小鼠细胞和同种异体细胞混合淋巴细胞反应.
方法: 建立异种-同种混合淋巴细胞反应模型, 进行分类细胞反应试验.
结果: 人外周血淋巴细胞对于异种小鼠细胞的反应明显低于对于同种异体细胞的反应(P<0.05). 细胞分类研究显示: 在异种混合淋巴细胞反应中, 主要是CD4+ T细胞通过间接途径受小鼠抗原刺激而增生; 在同种混合淋巴细胞反应中, 主要是CD4+ T细胞通过直接途径受同种异体抗原刺激而增生. 在两种混合淋巴细胞反应中, CD8+ T细胞也参与.
结论: 异种混合淋巴细胞反应弱于同种混合淋巴细胞反应, 异种细胞只通过间接途径刺激T细胞. 同种和异种混合淋巴细胞反应均需要抗原提呈细胞参与, CD4+T淋巴细胞是反应的主要细胞.
引文著录: 王英禹, 王云杰, 张瑞. 同种和异种混合淋巴细胞反应及分类混合淋巴细胞反应的比较. 世界华人消化杂志 2004; 12(7): 1612-1615
Revised: April 20, 2004
Accepted: April 27, 2004
Published online: July 15, 2004
AIM: To compare the mixed lymphocyte reactions (MLR) of human lymphocytes response to xenogenic murine lymphocytes and the allogenic human lymphocytes in vitro.
METHODS: Xeno-and allo- MLRs were set up and cellular classification study of xeno- and allo- MLRs were performed.
RESULTS: Human T cells response to xeno-cells was weaker than to allo-cells (P<0.05). Cellular classification study indicted that it was mainly CD4+ T cell involved in both allo- and xeno-MLRs, the former through direct and indirect pathways and the latter through indirect pathway. In addition, CD8+ T cell was involved in the reaction as well.
CONCLUSION: Xeno-MLR is weaker than allo-MLR. Xenogenic cells can only stimulate T cells through indirect pathway. Both MLRs share similar requirements for APCs, and human CD4 T cells are the major response cells.
- Citation: Wang YY, Wang YJ, Zhang R. Comparison of mixed lymphocytic reactions to both xenogenic murine and allogenic human lymphocytes. Shijie Huaren Xiaohua Zazhi 2004; 12(7): 1612-1615
- URL: https://www.wjgnet.com/1009-3079/full/v12/i7/1612.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i7.1612
移植排斥与组织相容性抗原密切相关, T细胞能直接识别同种移植物的组织相容性抗原. 移植时, 供体抗原可以通过多种途径激活受体的免疫应答系统, 产生免疫应答, 激活淋巴细胞, 发生移植排斥. 其中包括: CD4+细胞与MHC II抗原反应; CD8+细胞与MHC I抗原反应. 细胞间的反应被两种不同但是相关的途径介导: 直接途径和间接途径. 直接途径是T细胞直接作用于完整的同种异源供体细胞的MHC分子, 引起免疫应答的途径; 间接途径是供体的抗原通过受体的抗原提呈细胞上的MHC分子作用于T细胞, 引起免疫应答的途径. 在异种移植排斥反应中, T细胞激活途径尚不完全清楚, 本试验对此进行了深入的研究.
10个无关自愿者的血(JR医院, 牛津, 英国)用来准备人外周血单个核细胞(PBMC). Harlan-Olac试验用小鼠, 6周龄. (1)外周血单个核细胞/淋巴细胞(PBMC)的置备 将甘素化的新鲜去红细胞混悬液室温下加入等量PBS混匀, 每10 mL去红细胞/PBS 混悬液中加入Ficoll-Hypaque液3 mL. 18 ℃, 2 000 r/min, 离心30 min. 移除上层的血浆和血小板, 3倍体积的HBSS冲洗细胞, 18 ℃, 1 300 r/min, 离心10 min. 去除上清液. HBSS重新混匀细胞、冲洗并离心1次, 去除上清液. 混悬细胞于RPMI-10. 用胎盘蓝计量细胞的活性. (2)小鼠脾细胞混悬液的置备 处死小鼠, 摘取脾置于60×15-mm petri皿中剪碎, 加入RPMI-10 3 mL; 碾磨组织碎块至仅有结蒂组织存留; 用6 mL注射器和19G针头反复抽吸数次, 进一步离散组织; 200 m尼龙网过滤组织; 加入RPMI-10 5 mL; 18 ℃, 1 000 r/min, 离心10 min, 去除上清液, 混悬细胞沉淀于RPMI-10 20 mL, 重复离心1次, 混悬细胞沉淀于RPMI-10 5 mL; 加入红细胞溶解缓冲液5 mL; 室温下孵育5 min; 加入PBS冲洗细胞, 室温下, 1 000 r/min, 离心10 min, 去除上清液. 重复此步骤. 混悬细胞沉淀于适量RPMI-10备用. (3)刺激细胞的制备: 将准备用作刺激用细胞置入60Co 罐中15 s, 接受约20Gy的放射线照射灭活.
基础混合淋巴细胞反应(MLR) 的建立: 计数人外周血淋巴细胞(PBMC)和小鼠的脾单细胞混悬液, 用RPMI-10 AB调整他们的细胞密度至2.5×109/L; 调整刺激用细胞密度至2.5×109 /L; 分装反应细胞至96孔微滴度板: 每个反应小孔中分装100 L人外周血单核细胞(每个实验条件准备3个小孔); 加入100 L照射后的刺激细胞之相应的小孔中 (人外周血单核细胞和小鼠的脾单细胞混悬液), 使用RPMI-10AB 100 L 和PMA 100 L分别作为阴性和阳性对照; 放入潮湿的 37 ℃, 50 mL/L CO2孵箱中孵育; 分别在2、4和6 d进行[3H]掺入, 3、5和7 d收获细胞. 在终止细胞培养前18 h每个培养孔中加入1.85GBq/L [3H]胸腺嘧啶(总量37MBq) 20 L; 使用多孔细胞收获仪吸取、溶解细胞并转移DNA至滤纸, 洗掉未结合的[3H]胸腺嘧啶; 将滤纸放入样品袋, 加入scintillation 混合液5 mL并密封; 在scintillation 计数仪中计数样品直至标准误2% . 计数背景和不同试验条件下平均cpm. 相同条件下不同培养孔间差异应小于20% . 人和小鼠淋巴细胞的筛选, CD4 和CD8细胞的分离 使用Miltenyi Biotec公司(USA)提供的试剂盒及磁性分离仪和方法.
统计学处理 使用SPSS 11.0软件分析, 所用统计方法为Kruskal-Wallis检验. 采用EXCEL软件作图.
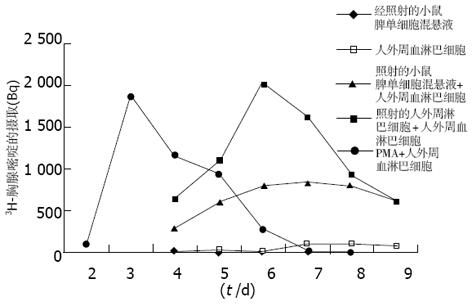
对细胞活性、各种细胞之间的反应及反应持续时间进行试验(图1). 醋酸豆蔻酸佛波醇(PMA)刺激细胞分裂增生明显, 在第3 d达到最高, 以后逐步下降, 说明细胞有分裂增生的能力. 异种刺激细胞(XS)不增生, 说明照射后小鼠脾细胞丧失了分裂增生的能力. 未加入刺激的人外周血淋巴细胞(R)增生很弱; 加入经照射的同种刺激细胞(AS)、异种刺激细胞(XS)的人外周血淋巴细胞均分裂增生活跃, 前者刺激细胞分裂增生的能力更强, 他们均使细胞分裂增生在5-7 d达到最高, 因此我们选择该时间点建立基础混合淋巴细胞反应.
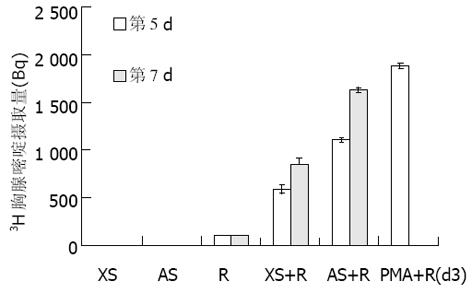
照射的人外周血淋巴细胞(AS)和小鼠的脾单细胞混悬液(XS)作为阴性对照, PMA刺激作为阳性对照. 人外周血淋巴细胞(R)作为反应细胞. 对比原发异种-同种混合淋巴细胞反应. 第5 d, 未加入刺激的人外周血淋巴细胞分裂增生很低, 反应了细胞在培养液中自然分裂增生的能力, 与加入刺激物组对比有显著差异, (P<0.01, 图2), 说明这种自然的分裂增生对于对比加入同种和异种刺激物的混合淋巴细胞反应干扰很小; 同种混合淋巴细胞反应(AS+R)组明显高于异种混合淋巴细胞反应(XS+R)组, 说明经照射的人外周血淋巴细胞的刺激作用明显强于经照射的小鼠的脾单细胞混悬液, 他们之间存在显著差异(P<0.05). 第7 d, 同种混合淋巴细胞反应(AS+R)组和异种混合淋巴细胞反应(XS+R)组反应均升高. AS+R组明显高于XS+R组, 他们之间存在显著差异(P<0.05). 第7 d与第5 d的反应结果相似, 证实了原发异种-同种混合淋巴细胞反应模型中各个细胞间相互反应的能力. 通过这组试验说明同种混合淋巴细胞反应明显高于异种混合淋巴细胞反应.
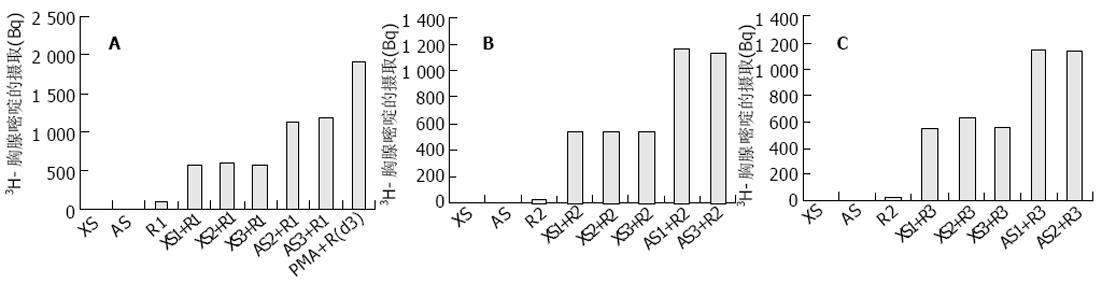
用不同的刺激细胞进行刺激, 以了解原发异种-同种混合淋巴细胞反应在不同个体之间的差异. 3只小鼠的脾单细胞混悬液(XS1-3)分别刺激3个不同个体的外周血淋巴细胞(R1-3)和3个不同个体的外周血淋巴细胞(AS1-3和R1-3)相互刺激之间的比较(图3A-C). 不同的小鼠脾单细胞混悬液(XS)刺激同一人血样中的淋巴细胞(R), 反应结果相似, 说明对于人淋巴细胞而言, 不同小鼠个体的刺激作用间个体差异不明显; 不同的人外周血淋巴细胞(AS)刺激同一人血样中的淋巴细胞(R), 反应结果相似, 说明对于人细胞而言, 不同人个体的刺激作用间个体差异不明显; 同种混合淋巴细胞反应(AS+R)组反应结果明显高于异种混合淋巴细胞反应(XS+R)组, 说明人外周血淋巴细胞的刺激作用强于小鼠的脾单细胞混悬液.
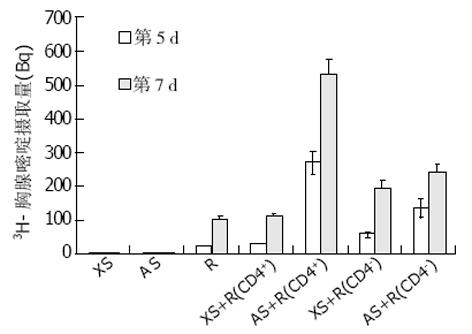
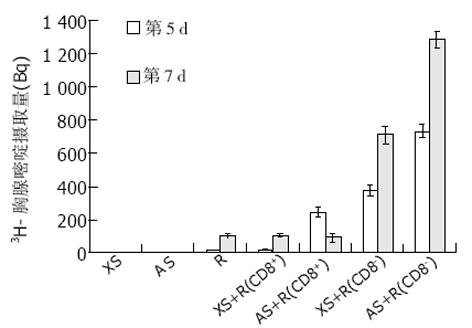
分别用CD4+和CD4-细胞作为反应细胞(图4). 我们发现XS+R(CD4+)与R组细胞分裂增生相似, 无差异显著(P>0.05), 说明CD4+T细胞不能被异种细胞直接激活, 证实在异种混合淋巴细胞反应中CD4+T细胞不能通过直接途径激活; XS+ R(CD4-)组细胞分裂增生高于R组(P<0.05), 说明异种细胞能刺激CD4-细胞(含APC的CD8+T细胞)分裂增生; XS不能刺激CD4+T细胞但是可以刺激CD4-细胞分裂增生, 因为前者不含APC而后者内有APC和CD8+细胞; AS+R(CD4+)组高于R 组(P<0.05), 说明同种细胞可以直接刺激CD4+T细胞分裂增生; AS+R(CD4-)组高于R组(P<0.05), 说明同种细胞能刺激CD4-细胞(含APC的CD8+T细胞)分裂增生; AS+R(CD4+)组远远高于AS+ R(CD4-)组(P<0.05), 说明CD4+T细胞是同种混合淋巴细胞反应中的主要反应细胞, 对CD4+和CD4-细胞, AS均可刺激分裂增生, 前者明显强于后者, AS本身含有APC, 而发生分裂增生的主要是CD4+T细胞. 同种混合淋巴细胞反应中淋巴细胞激活存在直接和间接两种途径, 直接途径在同种混合淋巴细胞反应中发挥了重大作用.
分别用CD8+和CD8-细胞作为反应细胞(图5). 我们发现XS+R(CD8+)组与R组细胞分裂增生相似, 无差异显著(P>0.05), 说明CD8+T细胞不能被异种细胞直接激活, 证实在异种混合淋巴细胞反应中CD8+T细胞不能通过直接途径激活; XS+R(CD8-)组远远高于R组(P<0.05), 说明异种细胞能刺激CD8-细胞(含APC的CD4+细胞)分裂增生; XS不能刺激CD8+T细胞但是可以刺激CD8-细胞, 因为前者不含APC而后者内有APC及CD4+T细胞; AS+R(CD8+)组高于R组 (P<0.05), 说明同种细胞可以直接刺激CD8+T细胞分裂增生; AS+R(CD8-)组高于R组, 说明同种细胞能刺激CD8-细胞(含APC的CD4+细胞)分裂增生; AS+R(CD8-)组远远高于AS+R(CD8+)组(P<0.05), 说明CD4+T细胞是同种混合淋巴细胞反应中的主要反应细胞, CD8+T细胞为次要反应细胞, 对CD8+和CD8-细胞, AS均可刺激分裂增生, 后者明显强于前者, AS本身含有APC, 而发生分裂增生的主要是CD4+T细胞. 同种混合淋巴细胞反应中淋巴细胞激活存在直接和间接两种途径, 直接途径在同种MLR中发挥了重大作用.
我们检测了体外人外周血淋巴细胞及其中不同亚群细胞在同种和异种细胞刺激下分裂增生的情况. 目的在于了解移植排斥反应中免疫细胞的反应, 对比免疫细胞在同种和异种细胞刺激下分裂增生的异同与不同亚群细胞反应的异同, 借以了解人细胞免疫系统在移植排斥中识别外来抗原进而排斥抗原的途径. 了解这一途径有助于在进行同种/异种移植时, 通过干扰这一途径减少移植排斥反应. 我们检测了人外周血淋巴细胞对异种刺激源(小鼠)和同种异体刺激源体外混合淋巴细胞反应的情况. 发现同种/异种混合淋巴细胞反应均在第5-7 d达到高峰; 同种混合淋巴细胞反应反应明显高于异种混合淋巴细胞反应; CD4+/CD4-细胞分别作为反应细胞, 结果显示: 异种细胞不能刺激CD4+ T细胞但是可以刺激CD4-细胞, 对CD4+/CD4-细胞, 同种异体细胞均可刺激分裂增生, CD4+ T细胞分裂增生明显强于CD4-细胞; 分别用CD8+/CD8-细胞作为反应细胞, 结果显示: 异种细胞不能刺激CD8+ T细胞但是可以刺激CD8-细胞, 对CD8+/CD8-细胞, 同种异体细胞均可刺激分裂增生, CD8-细胞分裂增生明显强于CD8+ T细胞.
鼠-人之间的异种混合淋巴细胞反应是T细胞依赖型的, 尤其是CD4反应细胞[1]. 我们的实验证实了这一点, 同时发现CD8细胞也在其中发挥了作用. 对于识别小鼠反应细胞的那种目标抗原, 大多数报道为MHCII, 少数为MHCI, 不论识别那种抗原, 均说明T细胞在鼠-人之间的异种MLR中的重要性[2]. 也有为数不多的试验说明了, 在鼠-人之间的异种MLR中抗原提呈细胞的依赖性[3]. 我们发现, 人主要是CD4+ T细胞通过识别经过APC的提呈鼠抗原引发免疫应答, CD8T细胞起次要作用. 还有试验用小鼠细胞作为反应细胞, 发现用MHCII特异性抗体阻断时, 鼠-人之间的异种MLR受到抑制[4]. 总之, 在鼠-人之间的异种MLR中CD4+T细胞、APC和MHCII为反应的主要途径, CD8+ 细胞、APC和MHC I为反应的次要途径.
过去的体外混合淋巴细胞反应实验结果差异很大. 以不同的反应细胞, 其中包括: 人、绵羊、山羊豚鼠、鸭、鹅、大鼠、小鼠等[5-9], 试验结果显示异种混合淋巴细胞基础反应缺失或很低. 与之相反, 也有许多研究显示: 异种混合淋巴细胞反应与同种混合淋巴细胞反应相似或更高. 我们的试验结果表明: 以人外周血淋巴细胞作为反应细胞, 异种混合淋巴细胞反应明显低于同种混合淋巴细胞反应. 这种试验结果不一致与许多因素有关. 在豚鼠-小鼠之间的异种混合淋巴细胞反应中, 以豚鼠作为反应细胞, 辅助性T细胞也不能直接被小鼠MHC激活, 在反应时加入豚鼠的有丝分裂刺激血清时, 这种反应被激活, 而加入小鼠的有丝分裂刺激血清无效, 说明小鼠的淋巴因子不能对豚鼠的Th/Tc的激活产生影响. 另外, 鼠-人之间的异种混合淋巴细胞反应中, 以人为反应细胞, 加入异体人的IL-1这种反应被激活. 这些报道均说明了淋巴因子在跨种反应中的重要性, 对CD4分子的研究显示人CD4分子与小鼠的MHC II分子之间有完全作用或削弱了的作用. 结合其他在异种混合淋巴细胞反应中Tc细胞反应缺失的研究[10-11], 我们倾向于认为对于T细胞不能识别异种MHC这一缺陷, 不仅仅是淋巴因子产生了影响. 认为较高的异种MLR反应是由于识别异种抗原的T细胞水平较高, T细胞通过自身的MHC识别异种抗原所致.
在移植排斥反应中, 辅助性T细胞扮演了重要的脚色. 通过我们的试验可以得出这样的结论: 异种排斥体外引起的细胞反应明显低于同种排斥反应; 同种移植的细胞排斥反应有直接和间接两种途径, 而异种移植的细胞排斥反应只有间接途径. 在两种排斥反应中, CD4+和CD8+ T细胞亚群均发挥作用, CD4+ T细胞作用更为明显. 有试验表明去除CD4+细胞有助于延长异种移植物的存活时间. 但是对于同种异体移植物无效. 本试验可以部分解释其原因. 通过异种和同种MLR的对比, 我们看到了移植的新希望: 当有效的抑制了体液排斥反应后, 异种移植也许比同种异体移植排斥的免疫抑制更易于控制.
编辑: N/A
| 1. | Matsumoto M, Katoh Y, Nakamura Y, Shimakura Y, Hagihara M, Yabe H, Yabe M, Inokuchi S, Kato S, Shimamura K. Injection of CD4(+) and CD8(+) cells with donor or host accessory cells induces acute graft-vs-host disease in human skin in immunodeficient mice. Exp Hematol. 2001;29:720-727. [PubMed] [DOI] |
| 2. | Nguyen XD, Eichler H, Dugrillon A, Piechaczek C, Braun M, Klüter H. Flow cytometric analysis of T cell proliferation in a mixed lymphocyte reaction with dendritic cells. J Immunol Methods. 2003;275:57-68. [PubMed] [DOI] |
| 3. | Iida Y, Hirose H, Hirota T, Kanetake K, Umeda Y, Nitta T, Matsuno Y, Yoshikawa S, Takagi H, Mori Y. T-cell receptor vbeta usage of xeno-MHC-restricted CD4(+) T cells in concordant xenoantigen recognition. Transplant Proc. 2000;32:295-298. [PubMed] [DOI] |
| 4. | Triponez F, Oberholzer J, Morel P, Toso C, Yu D, Cretin N, Buhler L, Majno P, Mentha G, Lou J. Xenogeneic islet re-transplantation in mice triggers an accelerated, species-specific rejection. Immunology. 2000;101:548-554. [PubMed] [DOI] |
| 5. | Persson MO, Persson NH, Ranstam J, Hermerén G. Xenotransplantation public perceptions: rather cells than organs. Xenotransplantation. 2003;10:72-79. [PubMed] [DOI] |
| 6. | Hadidi S, Chen Z, Phillips J, Yu K, Gorczynski RM. Antisense deoxyoligonucleotides or antibodies to murine MD-1 inhibit rejection of allogeneic and xenogeneic skin grafts in C3H mice. Transplantation. 2002;73:1771-1779. [PubMed] [DOI] |
| 7. | McInnes EF, Jarrett RF, Langford G, Atkinson C, Horsley J, Goddard MJ, Cozzi E, Schuurman HJ. Posttransplant lymphoproliferative disorder associated with primate gamma-herpesvirus in cynomolgus monkeys used in pig-to-primate renal xenotransplantation and primate renal allotransplantation. Transplantation. 2002;73:44-52. [PubMed] [DOI] |
| 8. | Hunkeler D. Allo transplants xeno: as bioartificial organs move to the clinic. Introduction. Ann N Y Acad Sci. 2001;944:1-6. [PubMed] [DOI] |
| 9. | Deol HS, Tuch BE. Effect of interleukin-10 on human anti-porcine xenogeneic cellular response in vitro. Transplantation. 2000;69:112-119. [PubMed] [DOI] |
| 10. | Shimizu A, Colvin RB, Yamanaka N. Rejection of peritubular capillaries in renal allo- and xeno-graft. Clin Transplant. 2000;14 Suppl 3:6-14. [PubMed] [DOI] |
| 11. | Wu G, Korsgren O, van Rooijen N, Tibell A. Suppression of T cells results in long-term survival of mouse heart xenografts in C6-deficient rats. Xenotransplantation. 2001;8:303-309. [PubMed] [DOI] |