修回日期: 2004-03-10
接受日期: 2004-03-16
在线出版日期: 2004-07-15
目的: 通过研究Stat3反义寡核苷酸对人胃腺癌MKN45细胞增生活性的影响, 寻求胃癌治疗中相关信号传导途径的新靶点.
方法: Stat3反义寡核苷酸是一种混合骨架寡核苷酸(MBO), 采用脂质体介导的方式将其转染人胃腺癌细胞株MKN45; 通过MTT法观察转染前后对细胞增生状态的影响; 凝胶阻滞电泳(EMSA)和Western blot方法观察转染前后Stat3 DNA的结合活性和磷酸化Stat3蛋白表达的变化.
结果: Stat3反义寡核苷酸对MKN45细胞的增生有明显抑制作用; 转染反义寡核苷酸后MKN45细胞中Stat3信号的组成性激活水平和磷酸化Stat3蛋白的表达分别下降了50.65%及78.86%.
结论: Stat3反义寡核苷酸能显著抑制MKN45细胞中Stat3信号的传导, 胃癌细胞株中活化的Stat3信号可作为胃癌治疗新的分子靶点.
引文著录: 俞丽芬, 吴云林, 乔敏敏, 钟捷, 涂水平. Stat3反义寡核苷酸对人胃腺癌MKN45细胞相关信号传导影响的研究. 世界华人消化杂志 2004; 12(7): 1527-1530
Revised: March 10, 2004
Accepted: March 16, 2004
Published online: July 15, 2004
AIM: To investigate the effect of antisense oligonucleotide (as-ODN) of Stat3 on the cell proliferation of human stomach adenocarcinoma cell line MKN45 and to determine the novel molecular target for treatment of gastric cancer.
METHODS: Stat3 as-ODN, a mixed backbone oligonucleic acid (MBO), was transfected into MKN45 cells mediated by liposomal reagent. The effect on cell proliferation was examined by MTT method. After transfection of Stat3 as-ODN, electrophoretic mobility shift assay (EMSA) and Western blot were used to detect the Stat3 DNA-binding activity and the expression of phospho-Stat3 protein, respectively.
RESULTS: Stat3 as-ODN could significantly inhibit the proliferation of MKN45 cells. After transfection of Stat3 as-ODN, both the constitutive activation of Stat3 and the expression of phospho-Stat3 protein were decreased 50.65% and 78.86%, respectively.
CONCLUSION: Stat3 as-ODN could remarkably inhibit the signal transduction of Stat3 in MKN45 cells. Activated Stat3 signaling in human stomach adenocarcinoma cell line provides a novel molecular target for therapeutic intervention of gastric cancer.
- Citation: Yu LF, Wu YL, Qiao MM, Zhong J, Tu SP. Effect of Stat3 antisense oligonucleotide on signal transduction pathway related to human stomach adenocarcinoma MKN45 cell line. Shijie Huaren Xiaohua Zazhi 2004; 12(7): 1527-1530
- URL: https://www.wjgnet.com/1009-3079/full/v12/i7/1527.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i7.1527
信号传导及转录活化因子(signal transducers and activators of transcription, STAT)是细胞因子和生长因子受体信号的下游效应物. 目前在哺乳动物中已鉴定出STAT家族的7个成员, 即Stat1, Stat2, Stat3, Stat4, Stat5a, Stat5b和Stat6. 信号通常产生于细胞膜表面的受体, 然后传输至细胞核内, STAT在细胞核内与特异性的DNA启动子结合, 调节相关基因的表达[1]. Stat3蛋白是近年来研究异常活跃的转录因子, 目前已确认Stat3信号途径是多种人类肿瘤干预治疗有效的分子标靶之一[1-4], 但是国内外关于Stat3在消化系统疾病中的研究才刚刚起步, 发展前景广阔. 反义寡核苷酸(antisense oligodexynucleotide, as-ODN)是人工合成并经化学修饰的寡核苷酸片段, 能通过自身设计的特定序列与靶mRNA结合, 在基因水平干扰致病蛋白的产生. 由于其高度的选择性和较低的副作用, as-ODN类药物已成为近年来药物研究和开发的热点[5-7]. 国内文献报道的反义寡核苷酸几乎均为硫代修饰的寡核苷酸, 而我们所采用的反义寡核苷酸为混合骨架寡核苷酸(mixed backbone oligonucleic acid, MBO), 在安全性和有效性方面要优于第一代反义寡核苷酸. 作者拟通过探讨Stat3反义寡核苷酸对人胃腺癌MKN45细胞增生活性的影响, 寻求胃癌治疗中相关信号传导途径的新靶点.
脂质体转染试剂盒(Oligofectamine), Invitrogen 公司;转染细胞的寡核苷酸由上海博亚生物工程有限公司合成与纯化, 为全硫代修饰, 并在末端各5个碱基的2'-O位上进行了甲氧基修饰; Stat3反义寡核苷酸序列5' - GCT CCA GCA TCT GCT GCT TC -3', 错配寡核苷酸序列5'-GCT CCA ATA CCC GTT GCT TC-3'[8]. 四氮唑盐(MTT), 上海实生细胞生物技术有限公司. 二甲亚砜(DMSO), 德国Merck公司. 细胞核蛋白抽提试剂盒和BCA 蛋白浓度检测试剂盒, Pierce公司; [-32P] dATP, PerkinElmer公司; Stat3双链脱氧寡核苷酸探针由上海生工公司合成, PAGE纯化, 序列如下: 正义链 5'- TCG ACA TTT CCC GTA AAT C -3', 反义链 5'- GAT TTA CGG GAA ATG TCG A -3'; EMSA试剂盒, Promega 公司; MicroSpinTM G-25柱, Amersham Biosciences 公司. 兔抗人多克隆抗体Phospho-Tyr705-Stat3, Cell Signaling公司; β-actin单克隆抗体, Sigma公司; 碱性磷酸酶标记的羊抗兔IgG, Santa Cruze公司; MagicMarker, Invitrogen 公司; Hybond-C 膜, Amersham Biosciences 公司.
低分化人胃腺癌细胞株MKN45由本实验室传代培养, 细胞在含100 mL/L胎牛血清的RPMI 1640培养基中生长, 细胞培养条件为37 ℃, 50 mL/L CO2. 脂质体转染按照试剂盒说明的操作步骤进行, 分为反义寡核苷酸组、错配寡核苷酸组、空脂质体组和对照组, 以无血清培养基稀释至所需浓度, 37 ℃孵育4 h, 然后按比例加入等体积的300 mL/L胎牛血清, 使培养基的终浓度恢复为100 mL/L胎牛血清.
1.2.1 细胞生长曲线: 取对数生长期的MKN45细胞用RPMI 1640培养基稀释成为含细胞0.5×107/L的细胞悬液, 接种于96孔培养板中, 培养24 h使之贴壁; 弃旧培液后, 分别将Stat3反义寡核苷酸、错配寡核苷酸和脂质体以无血清培养基稀释至所需浓度加入反义寡核苷酸组、错配寡核苷酸组和空脂质体组内, 其余步骤按操作说明进行, 对照组加100 mL/L胎牛血清RPMI 1640培养基. 分别于转染后24 h, 48 h, 72 h弃培养液, 每孔加入1 g/L的MTT 100 L, 继续培养4 h, 每孔加入DMSO 200 L, 酶标仪于570 nm处测定各孔吸光度A值, 绘制生长曲线.
1.2.2 凝胶迟滞电泳: 细胞核蛋白的抽提和蛋白浓度测定步骤均按照Pierce公司的操作说明进行, 分为反义寡核苷酸组、错配寡核苷酸组、空脂质体组和对照组. 探针按照凝胶迟滞电泳(EMSA)试剂盒说明进行 -32P-dATP标记, 终浓度为1.75 fmoL/L. 根据蛋白浓度, 在同一实验中取等量的核蛋白样品. 结合反应体系包括核蛋白10 g, 5×结合缓冲液. 于室温中向上述反应体系加入同位素标记的寡核苷酸探针1 L, 总反应体系为20 L, 冰上孵育30 min后上样. 制备50 mL/L非还原聚丙烯酰胺凝胶, 电泳缓冲液为1×TBE, 电流20 mA, 预电泳1 h后加样;再电泳90 min后干胶仪干胶、压片、-80 ℃曝光24-72 h后显影. 运用美国Bio-Rad公司的Fluor-STM Multimager扫胶仪, 以Quantity one软件进行灰度分析比较.
1.2.3 Western blot法: 以100 g胞核蛋白为加样量进行SDS聚丙烯酰胺凝胶电泳, 然后转移至hybond-C膜; 以β-actin监测各泳道蛋白加样量是否均等; 以MagicMarker确定目标蛋白的分子质量; 以TBS对膜进行漂洗, 室温下封闭1 h(封闭液含50 g/L脱脂奶粉的TBS); 膜与磷酸化多克隆抗体Stat3(稀释度1: 200) 室温下共同孵育2 h; 膜与碱性磷酸酶标记的羊抗兔IgG室温下共同孵育1 h, 最后进行蛋白条带的显色. 运用美国Bio-Rad公司的Fluor-STM Multimager扫胶仪, 以Quantity one软件进行灰度分析比较.
MTT法显示转染不同浓度的Stat3反义寡核苷酸后, MKN45细胞的增生水平受到不同程度的抑制. 当反义寡核苷酸的浓度为300 nmoL/L时MKN45细胞的生长受到明显抑制(生长抑制率为54.72%, 表1), 而对照组、空脂质体组和转染错配寡核苷酸组细胞的生长情况未受显著影响, 抑制作用在转染后48 h最强.
| 浓度(nmoL/L) | 0 | 150 | 200 | 250 | 300 | 350 |
| 570 nm的吸光值 | 0.53±0.07 | 0.33±0.03 | 0.40±0.06 | 0.29±0.03 | 0.24±0.03 | 0.30±0.04 |
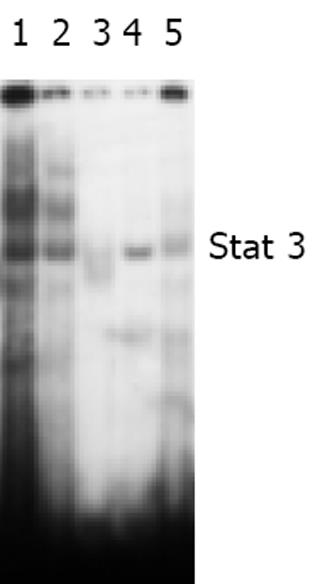
凝胶迟滞电泳(EMSA)结果显示转染Stat3反义寡核苷酸(浓度为300 nmoL/L)后, MKN45细胞中Stat3 DNA的结合活性水平较对照组下调了50.65%, 而相应的空脂质体组和转染错配寡核苷酸组的变化却不明显(图1).
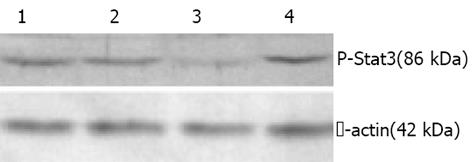
磷酸化Stat3抗体能与磷酸化的Stat3酪氨酸705位点反应, 提示检测的是Stat3的活性状态。对Western blot的电泳结果进行蛋白条带灰度分析后发现, 转染Stat3反义寡核苷酸(浓度为300 nmol/L)后, MKN45细胞中P-Stat3蛋白的表达较对照组减少了78.86%, 而空脂质体组和转染错配寡核苷酸组的P-Stat3蛋白表达变化不明显(图2).
相对正常的细胞和组织而言, 大多数人类原发癌灶及肿瘤细胞株中都有STAT的组成性激活. 目前国外有关STAT信号传导途径的研究正蓬勃发展, 但大部分多集中在恶性血液系统疾病(白血病, 淋巴瘤和多发性骨肉瘤)和头颈部肿瘤、乳癌和前列腺癌等方面[3-4,9-11] , 有关该信号途径与消化系统疾病的关系报道相对甚少[12-17]. Stat3在胃癌细胞株方面的研究仅有日本学者的一篇报道[18], 着重探讨了MEK-ERK途径. 许多研究表明, 作为STAT家族一员的Stat3能编码凋亡抑制剂和细胞周期调节剂, 通过上调Bcl-xL、 Mcl-1、 cyclins D1/D2 和 c-myc基因的作用参与肿瘤的形成[2-3], 提示通过抑制Stat3信号途径的组成性激活, 可抑制体内外肿瘤细胞的生长, 为人类肿瘤的干预治疗提供了一种新的方式.
我们采用的反义寡核苷酸是一种混合骨架寡核苷酸(MBO), 由DNA片段和RNA片段组合形成. 不仅对整个序列进行了全硫代修饰, 而且在序列两侧末端各5个碱基的2'-O位上进行了甲氧基修饰(RNA水平). 反义DNA和RNA通过和细胞内基因或mRNA结合后, 可封闭基因的转录或降解mRNA. 据文献报道, MBO在PS-ODN的基础上降低了硫代磷酸二酯键的数量, 减少了免疫反应, 降低了体内降解速度并改变了核酸降解物的种类, 从而减少了由硫代导致的副反应, 提高了和RNA的结合能力并提高了RNase降解mRNA的能力. 采用反义寡核苷酸或非显性Stat3蛋白Stat3 阻断Stat3 的DNA结合, 进一步确定了Stat3在肿瘤形成过程中的重要作用[4,11]. 马向涛et al[19]应用阳离子脂质体介导Stat3反义寡核苷酸转染人结肠癌SW480与HCT116细胞, 阻断其Stat3通路, 探讨了Stat3信号传导通路对结肠癌细胞G1-S期调控的可能机制. 结果发现, 转染Stat3反义寡核苷酸后结肠癌细胞增生受抑制, Stat3, p-Stat3, G1期cyclins, CDKS表达水平下降, p21与p27表达水平上升. 认为Stat3信号传导通路可能通过调节CDK/cyclin复合物与CKI成员之间的平衡而调节结肠癌细胞G1-S期的转换.
EMSA方法具有所需细胞核蛋白量少(5-20 g)、灵敏度和特异性高、能检测Stat3与DNA的结合活性等特点, 是研究核转录因子的首选方法. 此外以混合骨架寡核苷酸直接干预Stat3信号的活化, 当Stat3反义寡核苷酸的浓度为300 nmoL/L时MKN45细胞的生长受到明显抑制(细胞的生长抑制率>50%), 而对照组、空脂质体组和转染错配寡核苷酸组细胞的生长情况未受显著影响, 抑制作用在转染后48 h最强. 转染反义寡核苷酸后, MKN45细胞中Stat3信号的组成性激活水平和磷酸化Stat3蛋白的表达明显下降, 提示Stat3反义寡核苷酸能显著抑制MKN45细胞中Stat3信号的传导.
癌症患者可能会对任何一种单一的治疗如酪氨酸激酶抑制剂产生耐受, 因此需要更为有效的治疗措施. 在药物开发过程中, 通过对STAT结构和活性的关系研究, 需设计特异性的分子检测手段应用于药物的改进中, 评估Stat3 DNA的结合活性以及对相关基因的调控能力. 临床上, 通过对肿瘤患者的活检, 应用免疫组织化学方法观察Stat3 的酪氨酸磷酸化形式的表达情况, 为监测Stat3信号的有效抑制提供适宜的分子标志. 总之, 开发肿瘤治疗分子靶点Stat3的抑制剂, 有助于进一步探究该蛋白在人类肿瘤中所起的重要作用.
编辑: N/A
| 1. | Bromberg J, Darnell JE Jr. The role of STATs in transcriptional control and their impact on cellular function. Oncogene. 2000;19:2468-2473. [PubMed] [DOI] |
| 2. | Turkson J, Jove R. STAT proteins: novel molecular targets for cancer drug discovery. Oncogene. 2000;19:6613-6626. [PubMed] [DOI] |
| 3. | Bowman T, Garcia R, Turkson J, Jove R. STATs in oncogenesis. Oncogene. 2000;19:2474-2488. [PubMed] [DOI] |
| 4. | Song JI, Grandis JR. STAT signaling in head and neck cancer. Oncogene. 2000;19:2489-2495. [PubMed] [DOI] |
| 8. | Karras JG, McKay RA, Lu T, Pych J, Frank DA, Rothstein TL, Monia BP. STAT3 regulates the growth and immunoglobulin production of BCL(1) B cell lymphoma through control of cell cycle progression. Cell Immunol. 2000;202:124-135. [PubMed] [DOI] |
| 9. | Coffer PJ, Koenderman L, de Groot RP. The role of STATs in myeloid differentiation and leukemia. Oncogene. 2000;19:2511-2522. [PubMed] [DOI] |
| 10. | Lin TS, Mahajan S, Frank DA. STAT signaling in the pathogenesis and treatment of leukemias. Oncogene. 2000;19:2496-2504. [PubMed] [DOI] |
| 11. | Garcia R, Bowman TL, Niu G, Yu H, Minton S, Muro-Cacho CA, Cox CE, Falcone R, Fairclough R, Parsons S. Constitutive activation of Stat3 by the Src and JAK tyrosine kinases participates in growth regulation of human breast carcinoma cells. Oncogene. 2001;20:2499-2513. [PubMed] [DOI] |
| 12. | Miyazono K, Suzuki H, Imamura T. Regulation of TGF-beta signaling and its roles in progression of tumors. Cancer Sci. 2003;94:230-234. [PubMed] [DOI] |
| 13. | Katakura Y, Nakata E, Tabira Y, Miura T, Teruya K, Tsuchiya T, Shirahata S. Decreased tumorigenicity in vivo when transforming growth factor beta treatment causes cancer cell senescence. Biosci Biotechnol Biochem. 2003;67:815-821. [PubMed] [DOI] |
| 14. | Lovato P, Brender C, Agnholt J, Kelsen J, Kaltoft K, Svejgaard A, Eriksen KW, Woetmann A, Ødum N. Constitutive STAT3 activation in intestinal T cells from patients with Crohn's disease. J Biol Chem. 2003;278:16777-16781. [PubMed] [DOI] |
| 15. | Welte T, Zhang SS, Wang T, Zhang Z, Hesslein DG, Yin Z, Kano A, Iwamoto Y, Li E, Craft JE. STAT3 deletion during hematopoiesis causes Crohn's disease-like pathogenesis and lethality: a critical role of STAT3 in innate immunity. Proc Natl Acad Sci U S A. 2003;100:1879-1884. [PubMed] [DOI] |
| 16. | Matsui T, Kinoshita T, Hirano T, Yokota T, Miyajima A. STAT3 down-regulates the expression of cyclin D during liver development. J Biol Chem. 2002;277:36167-36173. [PubMed] [DOI] |
| 18. | Kanai M, Konda Y, Nakajima T, Izumi Y, Kanda N, Nanakin A, Kubohara Y, Chiba T. Differentiation-inducing factor-1 (DIF-1) inhibits STAT3 activity involved in gastric cancer cell proliferation via MEK-ERK-dependent pathway. Oncogene. 2003;22:548-554. [PubMed] [DOI] |
| 19. | 马 向涛, 王 杉, 杜 如昱, 叶 颖江, 王 殊, 严 飞飞, 崔 志荣. Stat3信号传导通路对结肠癌细胞G1-S期的调控. 北京大学学报(医学版). 2003;35:50-53. |