修回日期: 2004-03-10
接受日期: 2004-03-16
在线出版日期: 2004-06-15
目的: 通过实时荧光定量PCR(FQ-PCR)与逆转录PCR(RT-PCR)两种方法检测血清HCV-RNA的结果比较, 评价FQ-PCR法的临床应用价值.
方法: 样本为经ELISA法筛选抗HCV阳性血清401份, 其中221份采用实时荧光定量PCR法检测, 180份采用RT-PCR法检测.
结果: FQ-PCR法检测HCV-RNA, 阳性率(≥102拷贝/mL)68.3% (151/221), 定量范围在102-107拷贝/mL之间, 但≤106拷贝/ml占98.1%(148/151); RT-PCR法检测阳性率为30%(54/180).
结论: FQ-PCR检测HCV-RNA较RT-PCR是一种省时、简便、敏感、特异和防污染的体外基因扩增与定量检测方法, 其结果对临床诊断和疗效观察有重要的指导意义.
引文著录: 张淑云, 刘伟, 谷鸿喜, 杜博, 常曼丽. 实时荧光定量PCR检测血清中HCV-RNA. 世界华人消化杂志 2004; 12(6): 1464-1465
Revised: March 10, 2004
Accepted: March 16, 2004
Published online: June 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(6): 1464-1465
- URL: https://www.wjgnet.com/1009-3079/full/v12/i6/1464.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i6.1464
实时荧光定量PCR(FQ-PCR)技术是近几年发展起来的一种核酸定量检测技术. FQ-PCR以其快速简便、定量和防污染等优点很快被临床应用[1], 但其检测结果的临床应用价值尚需进一步认识. 为了探讨其在检测丙型肝炎病毒核酸(HCV-RNA)中的意义, 我们对180例采用逆转录PCR(RT-PCR)和221例采用FQ-PCR进行HCV-RNA检测的结果进行了分析和比较, 现报告如下.
1999-12/2003-05来我院门诊就诊, 并经ELISA法筛选抗-HCV阳性患者的血清401份; RT-PCR法是使用北京人民医院肝病研究所提供的HCV RNA检测试剂盒和美国PE公司基因扩增仪(PE480); FQ-PCR是采用深圳匹基生物工程股份有限公司HCV RNA荧光定量检测试剂盒(一步法)和罗氏公司荧光定量PCR仪.
按就诊时间分两组, 前180份标本采用了RT-PCR法检测, 后221份采用的是FQ-PCR法检测.实验操作和结果分析均严格按说明书进行.
统计学处理 采用SPSS10.0系统分析软件进行数据处理, 两组率的比较采用χ2检验.
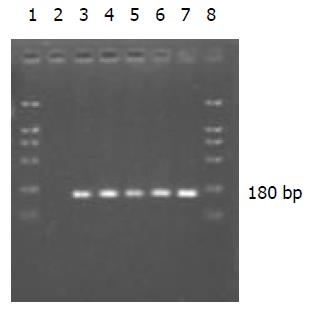
RT-PCR扩增产物经20 g/L琼脂糖 凝胶电泳, 于180 bp处出现特异性核酸条带为HCV RNA阳性(图1).
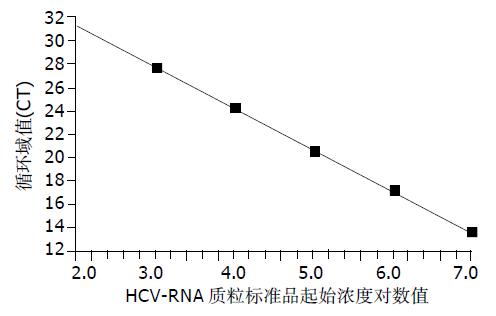
2.2.1 FQ-PCR阳性标准曲线: HCV定量阳性标准品(HCV-RNA质粒)经FQ-PCR测定, 以起始浓度的对数值为横坐标, 以PCR扩增的循环域值(CT)为纵坐标, 可以得到一条直线型标准曲线(图2), 相关系数r = -0.998, 斜率为-3.558.
2.2.2 HCV-RNA的定量及其范围: FQ-PCR法检测221份血清, HCV-RNA≥102拷贝/mL占68.3%(151/221), 定量范围在102-107拷贝/mL之间;阳性分布主要在106拷贝/mL及其以下,占98.1%(148/151)(表1).
| HCV-RNA的含量 | n | 百分率(%) |
| <102 | 70 | 31.7 |
| 102- | 21 | 9.5 |
| 103- | 37 | 16.7 |
| 104- | 26 | 11.8 |
| 105- | 40 | 18.1 |
| 106- | 24 | 10.8 |
| 107- | 3 | 1.4 |
| 合计 | 221 | 100 |
2.2.3 FQ-PCR与RT-PCR结果比较: FQ-PCR法检测血清中HCV-RNA阳性率为68.3%, 而常规RT-PCR法阳性率为30%, 二者差异显著(χ2 = 58.3, P<0.01, 表2); FQ-PCR法操作时间(3-4 h)短于RT-PCR法(5-6 h).
| 方法 | n | 阳性份数 | 阳性率(%) |
| FQ-PCR | 221 | 151 | 68.3 |
| RT-PCR | 180 | 54 | 30 |
目前抗HCV仍然是临床诊断HCV感染的主要手段, 但存在多方面的局限性[2-3]. 常规RT-PCR及其他许多PCR法虽能反映体内病毒存在, 也提高了HCV检测的灵敏度和特异性, 但不能准确定量及动态观察病毒水平的变化, 并有PCR产物污染的可能[4-6]. FQ-PCR技术是在PCR过程中引入了特异性荧光探针杂交和光学检测技术, 不仅提高了PCR扩增的特异性和检测的灵敏度, 而且通过荧光共振能量迁移(FRET)原理、循环域值(CT值)的设定和CT-浓度标准曲线, 实现了PCR起始模板的准确定量和在线监测PCR全过程. 本研究用FQ-PCR法检测了血清中HCV-RNA的含量, 定量可低至102和高达107拷贝/mL, 阳性率68.3%, 显著高于RT-PCR法(30%), 与文献[7-8]报道基本一致, 反映了该方法可定量和敏感的特点.测定的HCV-RNA水平98.1%在106拷贝/mL或以下, 与乙肝病毒(HBV)在体内的高含量(106-108拷贝/mL)相比相对较低[9], 进一步证实了文献报道的HCV在体内的复制水平相对较低的特点[10-11]. 本检测和程刚et al[3]的报道均显示FQ-PCR法检测HCV-RNA的定量范围较宽, HCV-RNA:102-107拷贝/mL, 因而在用药前后及用药过程中采集多份标本进行检测, 即动态观察HCV-RNA水平的变化, 可以很好地反映药物的疗效. 另外, 在FQ-PCR操作中, 只需一次加样即可完成HCV-RNA的逆转录、扩增和定量, 一次检测只需3-4 h, 与RT-PCR相比, 具有方便、省时、快捷, 有效解决PCR污染问题和自动化程度高等特点. 总之, FQ-PCR法检测HCV-RNA较RT-PCR法敏感, 且能定量, 能动态观察HCV-RNA水平的变化, 可为了解丙型肝炎病毒体内复制情况及诊断、选择治疗方案和评估药物疗效等提供较可靠的依据. 但FQ-PCR法也存在所需仪器昂贵、检测费用高等缺点, 有待进一步改进.
| 8. | 潘 宁, 张 建琼, 李 丽, 单 祥年. 应用荧光定量PCR检测血清中HCV RNA. 东南大学学报(医学版). 2003;22:16-18. |
| 10. | Mayerat C, Bürgisser P, Lavanchy D, Mantegani A, Frei PC. Comparison of a competitive combined reverse transcription-PCR assay with a branched-DNA assay for hepatitis C virus RNA quantitation. J Clin Microbiol. 1996;34:2702-2706. [PubMed] |
| 11. | Gerken G, Rothaar T, Rumi MG, Soffredini R, Trippler M, Blunk MJ, Butcher A, Soviero S, Colucci G. Performance of the COBAS AMPLICOR HCV MONITOR test, version 2.0, an automated reverse transcription-PCR quantitative system for hepatitis C virus load determination. J Clin Microbiol. 2000;38:2210-2214. [PubMed] |