修回日期: 2004-02-19
接受日期: 2004-03-02
在线出版日期: 2004-06-15
目的: 研究血管紧张素Ⅱ(AngⅡ)对肝星状细胞组织基质金属蛋白酶抑制因子-1(TIMP-1)表达的作用.
方法: 体外培养大鼠肝星状细胞株HSC-T6, 分别加入不同浓度的AngⅡ(10-6-10-9mol/L)和AngⅡ10 -6 moL/L+ Losartan10 -6mol/L, 作用48 h后收集细胞, RT-PCR检测各组TIMP-1 mRNA表达水平.
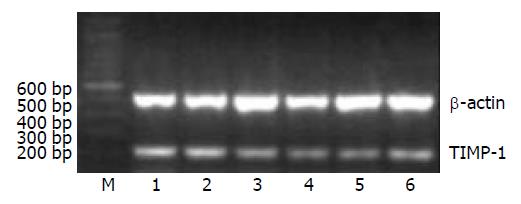
结果: 10-6moL/L AngⅡ和10-7moL/L AngⅡ作用的HSC-T6细胞TIMP-1 mRNA的表达分别为0.79±0.04和0.83±0.06, 显著高于空白对照组0.62±0.08 (P<0.05), 10-6 AngⅡ+10-6 Losartan 组TIMP-1 mRNA的表达为0.64±0.06, 显著抑制10-6 moL/L AngⅡ的作用(P<0.05).
结论: AngⅡ可通过AT1受体促进HSC-T6细胞TIMP-1的表达.
引文著录: 王磊, 刘海林. 血管紧张素Ⅱ对肝星状细胞TIMP-1表达的作用. 世界华人消化杂志 2004; 12(6): 1455-1456
Revised: February 19, 2004
Accepted: March 2, 2004
Published online: June 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(6): 1455-1456
- URL: https://www.wjgnet.com/1009-3079/full/v12/i6/1455.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i6.1455
最近的研究发现, 血管紧张素Ⅱ(AngⅡ)是一种重要的促肝纤维化因子, AngⅡ可通过1型受体(AT1受体)介导促进肝星状细胞(HSC)增生、Ca2+内流和胶原合成[1]. 但在肝纤维化形成过程中AngⅡ对细胞外基质(ECM)的代谢是否发挥作用尚不十分清楚. 组织基质金属蛋白酶抑制因子-1(TIMP-1)通过抑制ECM降解在肝纤维化过程中发挥重要作用. 本研究观察了不同浓度AngⅡ和AT1受体拮抗剂对肝星状细胞株HSC-T6的TIMP-1表达的作用.
大鼠肝星状细胞株(HSC-T6), 为美国加利福尼亚旧金山总医院肝病中心实验室Friedman教授建立, 上海中医药大学肝病研究所徐列明教授惠赠; AngⅡ购自Calbiochem公司; AT1受体拮抗剂Losartan为默沙东公司产品; DMEM培养基、胎牛血清购自Gibco公司; Trizol试剂盒, 购自Sigma公司; Takara RT-PCR试剂盒为Takara公司产品; TIMP-1、β-actin引物由上海生工公司合成.
HSC-T6细胞用含100 mL/L胎牛血清的DMEM培养液制备为1×106/mL的单细胞悬液, 接种于培养皿中, 置含50 mL/L CO2、37 ℃培养箱中培养24 h, 细胞贴壁后换含4 mL/L胎牛血清的DMEM培养液, 继续培养24 h后, 换含终浓度为10-6-10-9moL/L AngⅡ及AngⅡ10-6 moL/L+Losartan10-6 moL/L的培养液, 并设空白对照组, 每组3盘细胞. 作用48 h后, 每盘细胞加1 mL Trizol, 将细胞收集至经DEPC水处理的Eppendorf管中, -80 ℃保存. 按Trizol试剂盒说明书提取总RNA, 溶于20 mL 0.1 g/L DEPC水中, 取溶解的RNA 1 mL, 用DEPC水稀释100倍, 用紫外分光光度仪检测RNA纯度及浓度. 逆转录反应体系: RNA 标本2mg, 逆转录酶1 mL, dNTP混合物(10 mmoL/L) 2 mL, 10×PCR缓冲液2 mL, MgCl2 (25 mmoL/L) 4 mL, RNA酶抑制剂0.5 mL, oligo dt-Adaptor 引物1 mL, 其余为无RNA酶水, 反应总体积共20 mL. cDNA合成反应条件: 30 ℃, 10 min; 42 ℃, 60 min; 99 ℃, 5 min; 5 ℃, 5 min. PCR反应体系: 逆转录cDNA产物2 mL, TIMP-1或β-actin上下游引物(表1)各1 mL, Taq酶 (5 U/ mL) 0.25mL, dNTP混合物(10 mmoL/L) 0.5 mL、10×PCR缓冲液2 mL、MgCl2 (25 mmoL/L)1.2 mL、其余为无RNA酶水, 反应总体积共20 mL. PCR反应条件: 94 ℃预变性 2 min; 之后94 ℃, 30 s; 56 ℃, 30 s; 72 ℃, 1.5 min; 共35个循环; 最后72 ℃ 10 min, 终止反应. PCR扩增产物加2 mL DNA上样液混匀, 经15 g/L琼脂糖凝胶(含1 g/L溴化乙啶)电泳后, 经GIS-2800凝胶图像处理系统拍照, 分析各产物条带平均灰度值, 以β-actin产物条带灰度值为内参照计算mRNA相对表达量.
| 引物 | 序列 | 扩增长度(bp) | 位点 |
| TIMP-1 | 顺义 5'-GACCTGGTCATAAGGGCTAAA-3' | 219 | 118-138 |
| 反义 5'-GCCCGTGATGAGAAACTCTTCACT-3' | 313-336 | ||
| β-actin | 顺义 5'-GTGGGCCGCTCTAGGCACCAA-3' | 540 | 25-45 |
| 反义 5'-CTCTTTGATGTCACGCACGATTTC-3' | 541-564 |
统计学处理 SAS统计软件包进行配对t检验.
10-6 moL/L AngⅡ组和10-7moL/L AngⅡ组作用的HSC-T6细胞TIMP-1 mRNA的表达分别为0.79±0.04和0.83±0.06, 显著高于空白对照组0.62±0.08 (P<0.05), 10-6 AngⅡ+10-6Losartan 组TIMP-1 mRNA的表达为 0.64±0.06, 显著抑制10-6mol/L AngⅡ的作用(P<0.05)(表2、图1).
近来研究报道, 肝脏中也存在组织肾素-血管紧张素-醛固酮系统(RAAS)[2], 作为RAAS的重要活性成分, AngⅡ在肝纤维化形成中的作用正逐渐引起广泛关注. 动物实验表明大鼠分离培养的活化HSC和肝星状细胞株HSC-T6均可表达AT1受体, AT1受体拮抗剂和ACEI对实验性大鼠肝纤维化具有一定的治疗作用[3-4]. 人活化的HSC同样存在AT1受体表达, AngⅡ可以通过与其受体结合, 促进HSC增生、胶原合成和Ca2+内流[1]. TIMP-1是TIMP家族的重要成员, 在肝纤维化过程中主要来源于活化的HSC, 其通过抑制间质金属蛋白酶(MMP)的活性减少细胞外基质的降解, 在肝纤维化的形成和发展中发挥十分重要的作用[5]. 而目前关于AngⅡ是否可以影响HSC的TIMP-1表达尚鲜有报道.
HSC-T6是通过转导SV40 基因建立的SD大鼠HSC细胞株, 具有稳定的活化HSC的生物学特性[6]. 我们在体外观察了不同浓度(10-6-10-9moL/L)的AngⅡ对HSC-T6细胞的作用. 结果提示高浓度的AngⅡ可以促进HSC-T6细胞的TIMP-1 mRNA的表达, 而且该作用可以被AT1受体拮抗剂抑制, 提示AngⅡ可以通过AT1受体的介导直接上调TIMP-1 mRNA表达, 从而通过抑制ECM降解促进肝纤维化的形成. 同期国外亦有研究证明, 不同浓度AngⅡ作用于培养的大鼠HSC后, TIMP-1的表达呈浓度和时间依赖性增加. 而且此作用可被蛋白激酶C抑制剂所阻断, 提示AngⅡ刺激TIMP-1生成的机制可能与蛋白激酶C介导的RNA从头合成途径有关[7].
因此, AngⅡ可通过上调HSC的TIMP-1参与抑制细胞外基质的降解, 促进肝纤维化的形成, AngⅡ对其他肝纤维化相关MMP/TIMP的调节作用如何尚需要深入研究.
| 1. | Bataller R, Ginès P, Nicolás JM, Görbig MN, Garcia-Ramallo E, Gasull X, Bosch J, Arroyo V, Rodés J. Angiotensin II induces contraction and proliferation of human hepatic stellate cells. Gastroenterology. 2000;118:1149-1156. [PubMed] [DOI] |
| 2. | 张 晶, 宗 春华, 李 定国, 周 仁建, 杜 学亮, 周 馨, 徐 芹芳, 陆 汉明. 肝内肾素-血管紧张素-醛固酮系统与大鼠肝纤维化的关系. 世界华人消化杂志. 2002;10:397-400. [DOI] |
| 3. | Yoshiji H, Kuriyama S, Yoshii J, Ikenaka Y, Noguchi R, Nakatani T, Tsujinoue H, Fukui H. Angiotensin-II type 1 receptor interaction is a major regulator for liver fibrosis development in rats. Hepatology. 2001;34:745-750. [PubMed] [DOI] |
| 6. | Vogel S, Piantedosi R, Frank J, Lalazar A, Rockey DC, Friedman SL, Blaner WS. An immortalized rat liver stellate cell line (HSC-T6): a new cell model for the study of retinoid metabolism in vitro. J Lipid Res. 2000;41:882-893. [PubMed] |
| 7. | Yoshiji H, Kuriyama S, Yoshii J, Ikenaka Y, Noguchi R, Yanase K, Namisaki T, Yamazaki M, Tsujinoue H, Imazu H. Angiotensin-II induces the tissue inhibitor of metalloproteinases-1 through the protein kinase-C signaling pathway in rat liver fibrosis development. Hepatol Res. 2003;27:51-56. [PubMed] [DOI] |