修回日期: 2004-05-03
接受日期: 2004-05-13
在线出版日期: 2004-06-15
目的: 探讨CHB患儿外周血淋巴细胞各亚群的特点及与肝病病情的关系.
方法: 采用流式细胞术对CHB患儿29例、正常儿童15例的外周血纯真T细胞亚群、功能T细胞亚群、激活T细胞亚群及凋亡T细胞亚群进行检测, 并结合血清转氨酶(ALT)和病毒载量水平进行统计学分析.
结果: CHB患儿外周血CD4+CD45RA+T, CD4+CD45RO+T, CD4+CD28+ T, CD4+HLA-DR+ T, CD4+CD25+T, CD4+CD95+T, CD8+HLA-DR+T, CD3+, CD3+CD4+T, CD3+CD8+T, CD4+/ CD8+与正常儿童相应的细胞亚群比较, 无统计学差异(P>0.05), 但CD8+CD28+T(0.62±0.2 5×109/L), CD8+CD38+ T(0.74±0.3 1×109/L), CD8+CD95+T (0.16±0.1 3×109/L)细胞亚群的绝对数与正常对照组CD8+CD28+T (0.44±0.15×109/L), CD8+CD38+ T(0.57±0.1 6×109/L), CD8+CD95+T(0.03±0.01×109/L)比较, 有统计学差异(P<0.05), CD8+CD28+T, CD8+CD38+ T及CD8+CD95+T的构成比同样高于健康的儿童.
结论: CHB患儿外周血CD4+ T细胞亚群数量上改变不明显, 主要是CD8+ T淋巴细胞亚群的异常, 其中CD8+CD38+T, CD8+CD95+T, CD8+CD28+T细胞亚群细胞绝对数较正常儿童明显升高.
引文著录: 杨斌, 张鸿飞, 范振平, 王福生. HBV感染患儿外周血T淋巴细胞亚群的分析与临床意义. 世界华人消化杂志 2004; 12(6): 1295-1298
Revised: May 3, 2004
Accepted: May 13, 2004
Published online: June 15, 2004
AIM: To investigate the characteristics of T-lymphocytic subsets in HBV infected pediatric subjects for evaluation of their clinical implication.
METHODS: Fresh peripheral blood samples were obtained from 29 HBV-infected pediatric cases and 15 healthy counterparts. CD4+ and CD8+ T lymphocyte subsets including the naïve (CD45RA+), memory (CD45RO+), functional(CD28+), activated (HLA-DR+CD25+) and apoptosis (CD95+)T lymphocytes, respectively, were analyzed by flow cytometry. The clinical data such as serum ALT level, HBV viral load and the number of peripheral lymphocytes were simultaneously recorded from each HBV carrier.
RESULTS: HBV-infected children had an obviously increasing percentage of CD8+CD28+ T cells (72±11%) , CD8+CD38+(85±6%) and CD8+CD95+ (19±12%) T-lymphocytes, and there were significant differences between the children with chronic B hepatitis and the healthy children (P < 0.05). As compared to the absolute number of CD8+CD28+(0.62 ± 0.2 5×109/L), CD8+CD38+(0.74±0.3 1×109/L) and CD8+ CD95+ (0.16±0.13×109/L) T-lymphocytes, the patients had higher numbers than the healthy children (P < 0.05). The increase of numbers of circulating CD8+CD38+, CD8+ CD95+and CD8+CD28+ T-lymphocytes was significant. Furthermore, the association was not found between serum HBV viral load level and the T-lymphocyte subsets.
CONCLUSION: Our data may provide valuable information for evaluation of disease progression of HBV infected children
- Citation: Yang B, Zhang HF, Fang ZP, Wang FS. Peripheral T cell subsets in pediatric subjects with chronic HBV infection. Shijie Huaren Xiaohua Zazhi 2004; 12(6): 1295-1298
- URL: https://www.wjgnet.com/1009-3079/full/v12/i6/1295.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i6.1295
乙型肝炎是HBV感染引起的免疫病理损害, 肝细胞损害主要是由细胞介导的免疫损伤造成 [1]. 机体感染HBV后, 体内各淋巴细胞亚群间的正常平衡被打破, 表现为外周血淋巴细胞亚群构成比、绝对数和功能改变, 这些变化可反映机体细胞免疫的状况, 此外HBV可以通过活化诱导机制导致外周血淋巴细胞凋亡[2-4], 促使淋巴细胞亚群绝对数减少. 迄今, 已经报道的HBV感染引起T细胞亚群的改变主要是成人的结果[5], 而儿童方面的研究未见报道. 值得重视的是儿童感染HBV以后, 容易发生免疫耐受和慢性化, 是否与儿童外周血T淋巴细胞具有自身特点有关尚不清楚. 因此我们在对CHB成人外周血淋巴细胞亚群与病程相关性研究的基础上[5], 进一步对HBV感染的慢性患儿及健康儿童外周血T淋巴细胞亚群的构成比和绝对数进行观察, 以了解CHB患儿外周血T淋巴细胞的特点, 为CHB患儿的临床诊治及疗效评估提供一定的参考.
新入院CHB患儿 29例符合中华医学会传染病与寄生虫病学会(西安)2000年修订的标准. 男23例, 女6例, 年龄6-14(平均9.4±3.0)岁, 母婴垂直传播感染者11例, 密切接触感染者6例, 其他途径者12例, 其中HBsAg, HBeAg, 抗HBc阳性25例; HBsAg, 抗HBe, 抗HBc阳性4例, 病毒载量1.31×107-4.1×1012拷贝/L, ALT波动于167-677 nkat/L. 对照组为年龄、性别一致的健康儿童15例. 全部病例及健康儿童对照组均经ELISA法检测HBsAg, 抗HBs, HBeAg, 抗HBe和抗HBc, 并除外合并其他疾病, 同时进行血常规、肝功能和HBV-DNA定量检测. Simultest TM IMK-lymphocyte免疫荧光试剂盒购自美国Becton Dickison公司;单克隆抗体组合为PE-CD45RA/FITC-CD4(A液), PE-CD45RO/FITC-CD4(B液), PE-CD28/FITC-CD4(C液), PE-HLA-DR/FITC-CD4(D液), PE-CD25/FITC-CD4(E液), FITC-CD28/PE-CD8/ PerCP-CD3 (F液), FITC-CD95/PE-CD4(G液), PE-HLA-DR/FITC-CD8/PerCP-CD3(H液), FITC-CD8/PE-CD38/ PerCP-CD3(I液), FITC-CD95/PE-CD8/ PerCP-CD3(J液), FITC-CD4/PE-CD8/PerCP-CD3(K液). FACScalibur流式细胞仪(美国BD公司), HBV-DNA定量检测(美国GeneAM Psystem9600检测仪). 抽取抗凝血2.8 mL, 一部分通过全自动血液分析仪进行白细胞计数和白细胞分类计数; 另一部分通过流式细胞仪进行淋巴细胞亚群检测.
外周血淋巴细胞亚群的检测A, B, C, D, E, F, G, H, I, J, K样品测定管中各加入抗凝血标本50 mL, 然后每管中各相应加入A, B, C, D, E, F, G, H, I, J, K液10 mL, 振荡混匀, 室温避光孵育20 min, 加入溶血素1 mL, 振荡混匀, 室温避光放置10 min, 1 200 r/min离心5 min弃上清液, 加入PBS 1 mL, 1 200 r/min离心5 min弃上清液, 加入PBS 400 mL, 混匀后上机检测, 采用SimulSET软件获取分析. T4, T8细胞绝对数是通过全自动血液分析仪进行白细胞计数和白细胞分类所得的淋巴细胞数分别与T4, T8细胞构成比的乘积, T4, T8细胞中各亚群的绝对数为各自的构成比与T4, T8细胞绝对数的乘积.
统计学处理 采用SPSS10.0软件进行统计学分析, 淋巴细胞亚群的百分比和绝对数以mean±SD表示, 组间均数比较采用t检验.
患儿外周血CD4+CD45RA+T, CD4+CD45RO+T, CD4+CD28+ T, CD4+HLA-DR+T, CD4+CD25+ T, CD4+CD95+T, CD8+HLA-DR+T, CD3+, CD3+CD4+ T, CD3+CD8+T, CD4+/ CD8+比与正常儿童相比较, 无统计学显著性差异 P>0.05, 而CD8+CD28+ T (72±11%) , CD8+CD38+ T(85±6%), CD8+CD95+ T(19±12%)细胞亚群的构成比较正常对照组有所升高P<0.05 (表1). CHB患儿外周血白细胞及淋巴细胞绝对数与正常儿童比较无统计学差异, 同时CD3+、CD4 +, CD3+CD4+, CD3+CD8+绝对数也无统计学差异; 但患儿外周血CD8+ T有一定的改变, 如CD8+CD28+T (0.62±0.2 5×109/L), CD8+CD38+T(0.74±0.3 1×109/L), CD8+CD95+T(0.16±0.1 3×109/L)较健康儿童高P<0.05, 与CHB患儿外周血淋巴细胞亚群百分比变化特点相一致(表1).
| 淋巴细胞亚群 | 慢性肝炎(n = 29) | 正常儿童(n = 15) | P值 | |||
| 构成比 | 绝对数(109/L) | 构成比 | 绝对数(109/L) | 构成比 | 绝对数 | |
| CD3+ | 0.68±0.07 | 1.98±0.72 | 0.69±0.07 | 1.78±0.47 | 0.44 | 0.35 |
| CD3+CD4+ | 0.33±0.07 | 0.98±0.42 | 0.33±0.05 | 0.86±0.32 | 0.97 | 0.34 |
| CD3+CD8+ | 0.30±0.07 | 0.87±0.33 | 0.30±0.05 | 0.76±0.20 | 0.89 | 0.25 |
| CD4+CD45RA+ | 0.59±0.10 | 0.60±0.33 | 0.63±0.05 | 0.55±0.23 | 0.14 | 0.59 |
| CD4+CD45RO+ | 0.41±0.10 | 0.39±0.15 | 0.36±0.05 | 0.31±0.10 | 0.09 | 0.07 |
| CD4+CD28+ | 0.94±0.07 | 0.93±0.413 | 0.94±0.03 | 0.82±0.31 | 0.48 | 0.19 |
| CD4+HLA-DR+ | 0.16±0.07 | 0.15±0.06 | 0.15±0.05 | 0.13±0.06 | 0.54 | 0.37 |
| CD4+CD25+ | 0.23±0.07 | 0.09±0.23 | 0.23±0.04 | 0.19±0.08 | 0.73 | 0.40 |
| CD4+CD95+ | 0.39±0.12 | 0.36±0.15 | 0.35±0.08 | 0.29±0.10 | 0.22 | 0.12 |
| CD8+CD28+ | 0.72±0.11 | 0.62±0.25 | 0. 59±0.12 | 0.44±0.15 | 0.000 | 0.02 |
| CD8+HLA-DR+ | 0. 21±0.09 | 0.17±0.09 | 0.20±0.08 | 0.15±0.07 | 0.95 | 0.500 |
| CD8+CD38+ | 0.85±0.06 | 0.74±0.31 | 0.76±0.09 | 0.57±0.16 | 0.00 | 0.03 |
| CD8+CD95+ | 0.19±0.11 | 0.16±0.13 | 0.03±0.01 | 0.03±0.01 | 0.00 | 0.00 |
| CD4+/ CD8+ | 1.16±0.44 | 1.16±0.25 | 0.99 | |||
| 白细胞 | 6.57±1.653 | 6.633±1.81 | 0.90 | |||
| 淋巴细胞 | 2.90±0.962 | 2.581±0.69 | 0.26 | |||
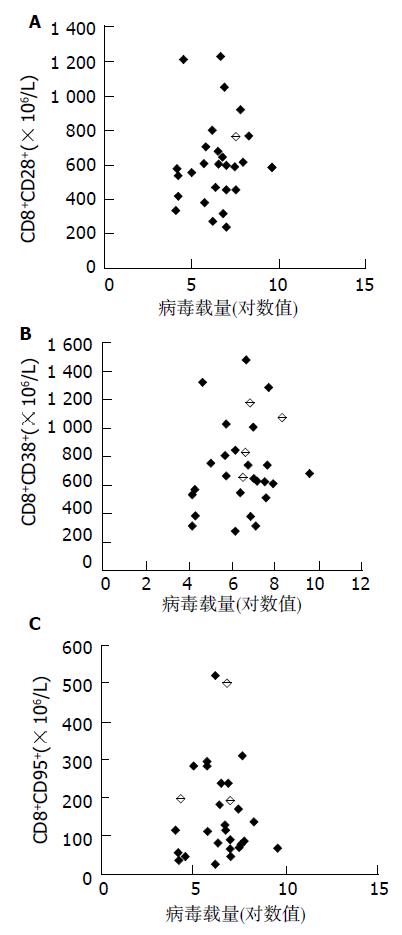
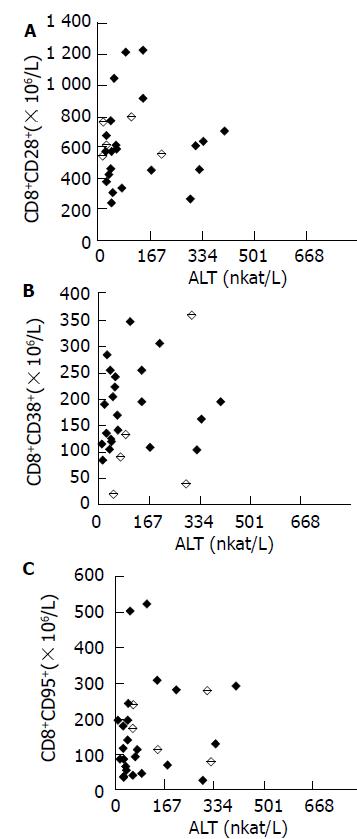
CHB患儿病毒载量1.31×107-4.1×1012拷贝/L. CD8+CD28+T细胞亚群绝对数与病毒载量对数值呈正相关倾向(r = 0.092, P = 0.635), 但无统计学意义, CD8+CD38+T细胞亚群绝对数与病毒载量对数值, 呈正相关倾向(r = 0.171, P = 0.375), 同样无统计学意义, CD8+CD95+T细胞亚群绝对数与病毒载量对数值, 呈负相关倾向(r = -0.011, P = 0.954), 也无统计学意义(图1A, 1B, 1C). CD8+CD28+T绝对数与ALT呈负相关倾向(r = -0.0011, P = 0.955 ), 无统计学意义, CD8+CD38+T细胞亚群绝对数与ALT呈正相关倾向(r = 0.073, P = 0.707), 同样无统计学意义, CD8+CD95+T绝对数与ALT呈正相关倾向(r = 0.121, P = 0.532), 也无统计学意义(图2A、2B、2C).
机体感染HBV后, 体内抗病毒的免疫反应主要是细胞免疫, 是由各种T淋巴细胞共同参与下进行的. T4细胞未接触其特异性抗原刺激之前, 以纯真细胞(CD4+CD 45RA+)的形式存在, 主要参与机体对未接触过的抗原起免疫应答, 是机体细胞免疫的后备力量. 受特异性抗原刺激后, T4纯真细胞(CD4+CD45RA+)转变为记忆性T4(CD4+CD45RO+), 并发生克隆扩增, 成为抗原特异性淋巴细胞, 主要参与对已接触过的抗原发生迅速而有效的免疫反应[6-7]. 本研究显示, CHB患儿外周血CD3+ 淋巴细胞、T4、T8、T4纯真细胞、T4记忆亚群构成比及绝对数与正常儿童相比较, 其差异无统计学意义(P>0.05), 提示在CHB患儿, HBV没有显著影响到其外周血中淋巴细胞数量, 也没有影响到T4纯真细胞亚群和T4记忆亚群的数量及其比例, 同时没有影响T4纯真细胞亚群和T4记忆亚群之间的动态平衡, 但是其功能如何有待进一步研究. CD28分子是T细胞正常激活所必须的第二信号, 他与抗原呈递细胞上相应的配体B7.1/2结合后, 诱导T淋巴细胞表达白介素-2(IL-2), 促进T淋巴细胞增生, 不表达CD28分子的T4或T8细胞接受抗原刺激后, 无法正常激活, 通常表现为无应答状态, 或者发生细胞凋亡[8]. 我们发现: T4功能亚群(CD4+CD28+)构成比及绝对数较正常儿童无明显变化(P>0.05), 但CD8+CD28+T却明显升高, 具有统计学意义(P<0.05), 这提示: CD8+CD28+T可能在CHB患儿T淋巴细胞增生中起重要作用, 但与CHB病程的关系, 则需动态观察. T淋巴细胞激活后, 其细胞表面通常表达相应的激活分子标志物, 如CD25分子是IL-2的a受体, 与细胞早期激活相关. HLA-DR分子和CD38分子则是通过对激活信号的转导, 诱导产生特定的细胞因子, 促进T细胞的激活[9-10]. CD4+CD25+T具有自身免疫防御作用, 在自然条件下处于无能状态, 同时CD4+CD25+T细胞亚群在外周耐受机制方面起着重要作用[1,11-15], 具有抑制其他CD4+T和CD8+T细胞的活性, 其抑制作用是抗原非特异性的. 他对于刺激表现为无能状态, 当发挥免疫调节功能时, 需要通过TCR的刺激; 当发挥抑制功能时, 不依赖于细胞因子而依赖于细胞间的接触[15-16]. CD4+CD25+T细胞可能通过抑制靶细胞IL-2的合成及下调抗原呈递细胞上CD80和CD86的表达而发挥作用, 也可能通过膜型TGF-B发挥抑制功能[17]. 我们发现CD4+CD25+及CD4+ HLA-DR+T构成比及绝对数与正常对照组比较无明显差异, 因此推测在CHB患儿外周血中, CD4+CD25+T很可能没有抑制T4和T8细胞对HBV的活性反应, 但未检测T淋巴细胞亚群功能, 故其在CHB中的作用应在检测其功能后才能下结论. 此外CHB患儿外周血中T8激活亚群以CD8+CD38+T淋巴细胞为主, 提示CD8+CD38+T在促进CHB患儿外周血T细胞的激活中可能起重要作用.
Schulze-Osthoff et al[18]研究证实: HBV+患者外周血淋巴细胞凋亡率均明显高于正常对照组, 刘征波et al[19]也发现 CHB患者外周血淋巴细胞在PHA活化后存在凋亡紊乱现象, 其TCR诱导的凋亡发生率在CHB患者明显增高. 本结果表明与健康儿童相比较, CHB患儿外周血CD4+CD95+T, CD3+T, CD3+CD4+ T, CD3+CD8+T细胞亚群的构成比、绝对数及CD4+/CD8+比无明显变化, 而CD8+CD95+ T淋巴细胞亚群百分比及绝对数则明显升高, 差异具有统计学意义, 提示HBV通过细胞毒性T淋巴细胞(CTL)的旁分泌或自分泌作用于细胞, 上调CD8+ T细胞亚群Fas及FasL基因的表达, 促进细胞凋亡, 并且通过Fas/FasL系统, 使表达FasL的CD8+T淋巴细胞杀死表达Fas的受感染肝细胞来达到清除HBV的目的[20], 由此导致肝组织的免疫病理损伤引发肝炎有待于进一步研究.
关于HBV病毒载量对淋巴细胞亚群的影响方面: Boni et al[21-22]研究发现, 在拉米夫定治疗后, 随着患者体内病毒载量下降, 人体的免疫功能包括辅助性T细胞和细胞毒性T的功能有所恢复, 说明病毒载量对人体免疫功能有抑制作用. 但是在此次试验中并未发现病毒载量与CD8+CD28+T, CD8+CD38+T, CD8+CD95+T细胞数量之间有明显的相互关系, 其原因可能与患儿遗传和免疫背景有关, 也可能与感染不同病毒基因型或者基因变异有关. 目前我们正在动态观察患儿HBV病毒载量和CD8+CD28+T, CD8+CD38+T, CD8+CD95+T细胞亚群同时进行T淋巴细胞的功能及病毒基因型的分析, 有可能希望对CHB患儿病程和发病机制有更全面和深刻的认识.
| 2. | Nakamura K, Yuh K, Sugyo S, Shijo H, Kimura N, Okumura M. Apoptosis observed in peripheral T lymphocytes from patients with chronic hepatitis B. Gastroenterology. 1996;111:156-164. [PubMed] [DOI] |
| 3. | Saha K, Yuen PH, Wong PK. Murine retrovirus-induced depletion of T cells is mediated through activation-induced death by apoptosis. J Virol. 1994;68:2735-2740. [PubMed] |
| 6. | Croft M, Bradley LM, Swain SL. Naive versus memory CD4 T cell response to antigen. Memory cells are less dependent on accessory cell costimulation and can respond to many antigen-presenting cell types including resting B cells. J Immunol. 1994;152:2675-2685. [PubMed] |
| 7. | Farber DL. Differential TCR signaling and the generation of memory T cells. J Immunol. 1998;160:535-539. [PubMed] |
| 8. | June CH, Bluestone JA, Nadler LM, Thompson CB. The B7 and CD28 receptor families. Immunol Today. 1994;15:321-331. [PubMed] [DOI] |
| 9. | Funaro A, Spagnoli GC, Ausiello CM, Alessio M, Roggero S, Delia D, Zaccolo M, Malavasi F. Involvement of the multilineage CD38 molecule in a unique pathway of cell activation and proliferation. J Immunol. 1990;145:2390-2396. [PubMed] |
| 10. | Shevach EM. Regulatory T cells in autoimmmunity*. Annu Rev Immunol. 2000;18:423-449. [PubMed] [DOI] |
| 11. | Seddon B, Mason D. The third function of the thymus. Immunol Today. 2000;21:95-99. [PubMed] [DOI] |
| 12. | Dieckmann D, Plottner H, Berchtold S, Berger T, Schuler G. Ex vivo isolation and characterization of CD4(+)CD25(+) T cells with regulatory properties from human blood. J Exp Med. 2001;193:1303-1310. [PubMed] [DOI] |
| 13. | Thornton AM, Shevach EM. CD4+CD25+ immunoregulatory T cells suppress polyclonal T cell activation in vitro by inhibiting interleukin 2 production. J Exp Med. 1998;188:287-296. [PubMed] [DOI] |
| 14. | Cederbom L, Hall H, Ivars F. CD4+CD25+ regulatory T cells down-regulate co-stimulatory molecules on antigen-presenting cells. Eur J Immunol. 2000;30:1538-1543. [PubMed] [DOI] |
| 15. | Thornton AM, Shevach EM. Suppressor effector function of CD4+CD25+ immunoregulatory T cells is antigen nonspecific. J Immunol. 2000;164:183-190. [PubMed] [DOI] |
| 16. | Suri-Payer E, Amar AZ, Thornton AM, Shevach EM. CD4+CD25+ T cells inhibit both the induction and effector function of autoreactive T cells and represent a unique lineage of immunoregulatory cells. J Immunol. 1998;160:1212-1218. [PubMed] |
| 17. | Nakamura K, Kitani A, Strober W. Cell contact-dependent immunosuppression by CD4(+)CD25(+) regulatory T cells is mediated by cell surface-bound transforming growth factor beta. J Exp Med. 2001;194:629-644. [PubMed] [DOI] |
| 18. | Schulze-Osthoff K, Ferrari D, Los M, Wesselborg S, Peter ME. Apoptosis signaling by death receptors. Eur J Biochem. 1998;254:439-459. [PubMed] [DOI] |
| 20. | Higaki K, Yano H, Kojiro M. Fas antigen expression and its relationship with apoptosis in human hepatocellular carcinoma and noncancerous tissues. Am J Pathol. 1996;149:429-437. [PubMed] |
| 21. | Boni C, Bertoletti A, Penna A, Cavalli A, Pilli M, Urbani S, Scognamiglio P, Boehme R, Panebianco R, Fiaccadori F. Lamivudine treatment can restore T cell responsiveness in chronic hepatitis B. J Clin Invest. 1998;102:968-975. [PubMed] [DOI] |