修回日期: 2003-12-09
接受日期: 2004-01-08
在线出版日期: 2004-06-15
目的: 研究胃腺癌组织学异质性与淋巴结转移程度的关系, 探讨胃腺癌组织学异质性的临床意义.
方法: 收集138例胃腺癌手术切除标本, 对全部肿块进行间断连续切片后, 在光镜下检查, 以出现两种和两种以上的组织学亚型为有组织学异质性. 对切除的淋巴结进行全数检查, 并按照UICC/AJCC的标准进行N分期, 比较不同的N分期中胃腺癌组织学异质性的分布.
结果: 138例胃腺癌中组织学异质性的出现率仅为58.7%. 组织学异质性以同时存在两种组织学亚型者居多(69/81,85%), 其中半数以上是管状型腺癌+低分化型腺癌(42/69,60%). 138例胃腺癌检查出淋巴结8 568个, 平均每例62.1个. N0: 33例, N1: 36例, N2: 29例, N3: 40例. N0组中有组织学异质性的胃腺癌仅占36%, N3组中占80%. 有无组织异质性在不同的N分期中分布不同, 差异有显著性(χ2值 = 14.86, P<0.001). 若按照占优势的组织学结构进行分型, 138例胃腺癌与有无淋巴结转移以及淋巴结转移的程度之间并无以上关系(χ2值 = 5.24, P>0.05).
结论: 胃腺癌的组织学异质性常见, 出现率为58%. 胃腺癌组织学异质性与淋巴结转移有明显的关系.
引文著录: 刘丽江, 舒细记, 镇鸿燕, 邱晓东, 邓昊, 周红艳, 张应天. 胃腺癌组织学异质性与淋巴结转移程度相关. 世界华人消化杂志 2004; 12(6): 1273-1276
Revised: December 9, 2003
Accepted: January 8, 2004
Published online: June 15, 2004
AIM: To study the possible correlation between the intratumor histological heterogeneity and degree of lymph node metastasis in gastric adenocarcinoma and to explore the clinical significance of histological heterogeneity in gastric adenocarcinoma.
METHODS: Tumor specimens were collected from 138 gastric adenocarcinoma cases in which lymph nodes were also checked. All tumor specimens were consecutively cut into serial sections and examined by microscope. The intratumor histological heterogeneity was defined by finding of at least two histological subtypes. Total number of metastatic lymph nodes was counted. And staging was conducted according to the classification of UICC/AJCC standard. The N stage distributions of intratumor histological heterogeneity were examined and compared.
RESULTS: The incidence of intratumor histological heterogeneity was 58.7% in 138 specimens of gastric adenocarcinoma. It was two-subtype histological heterogeneity that were found in most positive specimens (69/81, 85%). More than half of them were of glandular plus poorly differential types (42/69, 60.9%). A total of 8568 lymph nodes were found in 138 cases (average 62.1). 33 cases of N0, 36 N1, 29 N2 and 40 N3 were identified according to the N classification of UICC/ AJCC standard. Intratumor histological heterogeneity was found in 36% of the N0 group and 80% of N3 group. Distribution of intratumor histological heterogeneity displayed difference among the N stages, which was of high statistical significance (χ2 = 14.86, P < 0.001). When classified through the currently prevailing method, however, the 138 sample cases of gastric adenocarcinoma presented no significant pertinence to lymph nodes metastasis and its magnitude (χ2 = 5.24, P > 0.05).
CONCLUSION: The intratumor histological heterogeneity can be seen as a frequent event in gastric adenocarcinoma (58%). Intratumor histological heterogeneity is found evidently correlated with lymph node metastasis in gastric adenocarcinoma.
- Citation: Liu LJ, Shu XJ, Zhen HY, Qiu XD, Deng H, Zhou HY, Zhang YT. Correlation of histological heterogeneity and lymph node metastasis in gastric adenocarcinoma. Shijie Huaren Xiaohua Zazhi 2004; 12(6): 1273-1276
- URL: https://www.wjgnet.com/1009-3079/full/v12/i6/1273.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i6.1273
胃癌在我国常见[1-10], 转移尤其是淋巴结转移是临床治疗失败的重要原因之一[11-17]. 淋巴结转移是胃癌预后的最重要指标, 胃腺癌出现组织异质性与淋巴结转移之间是否存在一定的相关性, 少有研究报告. 我们收集138例胃腺癌的8 568个淋巴结(平均每例62.1个), 以全面详实的胃腺癌肿块与淋巴结检查资料为研究对象, 探讨胃腺癌组织异质性与淋巴结转移程度之间的关系如下.
我院外科1988/2003年胃腺癌手术切除标本138例. 男99例, 女39例. 年龄5712(中位年龄: 58岁). 96.4%的病例(133例)为胃腺癌根治性手术切除, 3.6%的病例(5例)为姑息性手术切除.
肿块与淋巴结检查: 每个肿块均按每1 cm 间距连续取材后全部进行显微镜下检查, 常规HE染色. 全组病例肿块最大为16 cm×13 cm, 最小为0.3 cm×0.3 cm, 取材镜检最多61块组织, 最少2块组织. 淋巴结经染色溶脂后获取全部切除淋巴结, 常规HE染色和免疫组织化学染色镜下判断有无淋巴结转移与微转移. 淋巴结微转移的标准参照乳腺癌等[18], 即转移灶 小于或等于0.2 mm或转移癌细胞数小于或等于50个. 淋巴结转移分期按UICC/AJCC标准[19], N0: 无淋巴结转移, N1: 1-6个淋巴结转移, N2: 7-15个淋巴结转移, N3: 大于15个淋巴结转移. 组织学分型: 本组胃癌病例全部是腺癌, 组织学分型按照WHO标准(1990)和日本胃癌学会标准(1995)分为: 管状型腺癌、乳头状型腺癌、低分化型腺癌、黏液型腺癌和印戒细胞癌(统计学处理时将乳头状型合并到管状型组). 每例胃腺癌标本组织学类型只要出现两种或两种以上者为有组织学异质性组, 仅有一种者为无组织学异质性组.
统计学处理 使用软件SAS (8.0)及Excel 2000计算机分析统计处理, 数据进行t检验和χ2检验, 以P<0.05为有统计学意义.
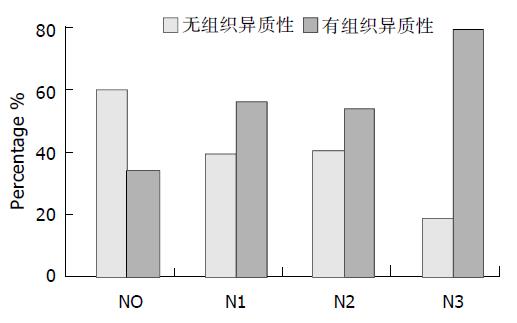
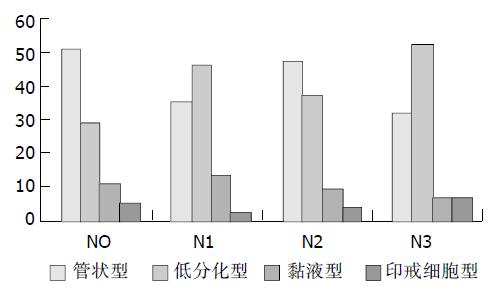
低分化腺癌59例, 黏液细胞型腺癌15例, 印戒细胞型腺癌7例(表1). 按照出现的组织学类型划分, 在138例胃腺癌中肿瘤内表现为一种组织学类型的57例, 2种组织学类型69例, 3种组织学类型10例, 4种组织学类型2例. 有组织异质性组81例, 无组织异质性组57例(图1, 2), 胃腺癌组织异质性的出现率为58.7%. 有组织异质性组中以出现两种组织类型者居多(69/81,85.2%, 图3, 4), 其中半数以上是管状型腺癌+低分化型腺癌(42/69,60.9%, 表2, 3).
| 管状型(%) | 低分化型(%) | 黏液细胞型(%) | 印戒细胞型(%) | 合计(n) | |
| 占优势组织学类型 | 57 (42.8) | 59 (40.6) | 15 (10.9) | 7 (5.7) | 138 |
| 单一组织学类型 | 20 (34.5) | 28 (48.3) | 6 (10.3) | 4 (6.9) | 57 |
| 组织学类型(A+B) | n(%) | 以A型为主 | 以B型为主 |
| n(%) | n(%) | ||
| 管状型+乳头状型 | 4 (5.8) | 3 (75.0) | 1 (25.0) |
| 管状型+低分化型 | 43 (62.3) | 23 (53.5) | 20 (46.5) |
| 管状型+黏液型 | 5 (7.3) | 5 (100.0) | 0 |
| 管状型+印戒细胞型 | 2 (2.9) | 1 (50.0) | 1 (50.0) |
| 低分化型+黏液型 | 4 (5.8) | 2 (50.0) | 2 (50.0) |
| 低分化型+印戒细胞型 | 6 (8.7) | 6 (100.0) | 0 |
| 黏液型+印戒细胞型 | 5 (7.3) | 3 (60.0) | 2 (40.0) |
| 合计 | 69 | 43 | 26 |
| 低/管/印 | 低/管/粘 | 低/粘/印 | 粘/印/管 | 低/粘/管/印 | 粘/印/低/管 | 合计 | |
| n | 2 | 4 | 2 | 2 | 1 | 1 | 12 |
2.2 138例胃腺癌共检查出淋巴结8 568个, 平均每例62.1±27.4(95% CI: 57.48, 66.70). 共检查出有转移淋巴结1847个, 平均每例13.4±17.8(95% CI: 13.38, 16.38). 共检查出淋巴结微转移256个, 平均每例1.9±3.3(95%CI: 1.34, 2.42). 全组淋巴结检出个数(18-157个)、淋巴结转移个数(0-96个)以及淋巴结微转移个数(0-21个)之间差幅巨大(图5). 淋巴结检出数最少18个, 最多157个; 淋巴结转移数最少1个, 最多96个; 淋巴结微转移数最少1个, 最多21个, 差距幅度巨大.
2.3 138例中N033例, N136例, N229例, N340例. 组织异质性的出现频率随淋巴结转移个数的增加而增大, 有组织异质性的胃腺癌在无淋巴结转移(N0)组中所占比例最低为36%, 在大于15个淋巴结转移组(N3)最高达80%(图6). 胃腺癌有无组织异质性在不同的N分期中分布不同, 差异有显著性(χ2值 = 14.86, P<0.001). 按占优势的组织学类型进行分组, 胃腺癌不同的组织学类型在各N分期中差别无统计学意义(χ2值 = 5.24, P>0.05). (图7).
2.4 胃腺癌组织有无异质性在淋巴结检出的个数之间并无差异(t = 0.37, P = 0.71). 但有组织异质性的胃腺癌淋巴结转移与微转移个数(平均个数)均高于无组织异质性的胃腺癌(P = 0.01, 0.003; 表4).
| 有组织异质性 | 无组织异质性 | t值 | P值 | |
| 检查总数 | 62.8±26.1 | 61.1±29.3 | 0.37 | 0.71 |
| 转移个数 | 16.4±18.6 | 9.0±15.7 | 2.45 | 0.01 |
| 微转移个数 | 2.5±3.8 | 0.9±1.7 | 3.00 | 0.003 |
胃癌95%是腺癌, 组织学类型复杂多样. 不同胃癌的组织学类型不一样, 同一癌肿内也会出现不同的组织学类型, 通常以占主要成分者命名, 已为多数临床病理学家所接受. 如果不同组织学类型在一个癌肿内所占比例相似时也可以混合型命名. 但是, 按照上述的组织学分类, 其结果并不能很好地反映胃癌的生物学行为, 使组织学分型在胃癌预后中不具有重要的价值. 进展期胃癌预后不好, 5年生存率低, 影响预后最重要的原因是肿瘤的浸润的深度和有无淋巴结转移及淋巴结转移的程度[20-27]. 组织学类型与淋巴结转移个数之间的关系, 尚未见报道.
我们对138例胃腺癌手术切除标本进行了系统地细致地观察, 采用对肿块进行间断连续取材镜下检查(肿块每间隔0.5-1 cm间距进行镜检)的方法, 并对该组病例的8 568个淋巴结进行了检查, 每例62.1±27.4个, 其结果发现(1)胃腺癌出现组织异质性的频率为58.7%, 虽然较为常见, 但非全部的病例. 组织异质性以出现两种组织学亚型居多(管状型与低分化型), 占85.2%(69/81); (2)胃腺癌组织异质性与淋巴结转移有明显的关系, 随淋巴结转移个数的增加, 胃腺癌组织异质性出现的频率增大, 即淋巴结转移程度越重的病例, 胃腺癌组织学异质性也越明显(P<0.001), 尤其是N3(15个以上淋巴结有癌转移)的病例中有80%出现组织异质性(32/40例); (3)胃腺癌组织异质性与淋巴结微转移个数(均数)之间有一定的关系, 即出现组织异质性的胃腺癌更容易找到淋巴结微转移. 结果提示, 胃腺癌并非全部出现组织异质性, 但出现组织异质性的胃腺癌更容易发生淋巴结转移. 因此, 胃腺癌组织异质性的确定比以占主导地位的组织学分型更具有应用价值, 尤其是对推测胃癌淋巴结转移的程度以及推测预后有一定的帮助. 因为, 当胃腺癌出现组织异质性时, 淋巴结转移的可能性大大增加了.
胃癌淋巴结转移的程度是最重要的预后指标之一, 近期UICC/AJCC对胃癌淋巴结转移的分期进行了修订, 以转移个数作为N分期的标准, 即N0: 无淋巴结转移, N1: 1-6个淋巴结转移, N2: 7-15个淋巴结转移, N3:大于15个淋巴结转移[19], 简化了以淋巴结的解剖部位或按照距肿瘤边缘的距离进行淋巴结转移分期的标准, 得到了包括日本在内的众多国家的赞同. 本项研究, 对根治性手术切除的胃癌病例的全数淋巴结(8 502个淋巴结/138例)进行检查, 在此基础之上进行了N分期, 其结果确认了胃腺癌组织学异质性与淋巴结转移程度之间的关系, 对胃腺癌的组织学分型具有重要的补充. 我们认为在胃癌的组织学分型上应该注明有否肿瘤内的组织学异质性.
胃癌手术切除标本淋巴结的检出数存在较大的差别, 本组资料中最少18个, 最多157个. 胃癌淋巴结转移个数也与之相似, 最少转移个数1个, 最多96个, 差距幅度巨大. 本项研究结果提示, 在评价胃癌淋巴结转移程度时, 均数不是很好的评价指标.
胃癌淋巴结微转移能否进入胃癌N分期, 尚无一致的意见. 我们确定的淋巴结微转移的标准为转移灶小于或等于0.2 mm或转移癌细胞数小于或等于50个(比AJCC/UICC确定的乳腺癌淋巴结微转移的标准尺度要严), 发现胃腺癌组织学异质性与淋巴结微转移也有一定的关系, 即有组织异质性的胃腺癌更容易出现淋巴结微转移, 但其临床价值还需要进一步积累病例才能做出评价.
| 1. | Jemal A, Murray T, Samuels A, Ghafoor A, Ward E, Thun MJ. Cancer statistics, 2003. CA Cancer J Clin. 2003;53:5-26. [PubMed] [DOI] |
| 2. | Jemal A, Thomas A, Murray T, Thun M. Cancer statistics, 2002. CA Cancer J Clin. 2002;52:23-47. [PubMed] [DOI] |
| 3. | Hansson LE, Sparén P, Nyrén O. Survival in stomach cancer is improving: results of a nationwide population-based Swedish study. Ann Surg. 1999;230:162-169. [PubMed] [DOI] |
| 5. | 袁 媛, 宫 伟, 徐 荣天, 王 选杰, 高 华, 董 明, 吴 烨秋, 王 兰, 王 梅先, 宋 新军. 中国胃癌高发区庄河16村镇5万自然人口胃癌普查报告. 世界华人消化杂志. 1998;6:478. [DOI] |
| 9. | 毛 伟征, 陈 峻青. 东西方胃癌预后差异及其原因分析. 中国现代普通外科进展. 2001;4:65-67. |
| 10. | Zhang Y, Zhang Z. Exploration on treatment of chronic superficial gastritis and gastric precancerosis with integrated Chinese and Western medicine. World J Gastroenterol. 1998;4:103. [DOI] |
| 11. | Wen CY, Nakayama T, Wang AP, Nakashima M, Ding YT, Ito M, Ishibashi H, Matsuu M, Shichijo K, Sekine I. Expression of pituitary tumor transforming gene in human gastric carcinoma. World J Gastroenterol. 2004;10:481-483. [PubMed] [DOI] |
| 12. | Doglietto GB, Pacelli F, Caprino P, Sgadari A, Crucitti F. Surgery: independent prognostic factor in curable and far advanced gastric cancer. World J Surg. 2000;24:459-463; discussion 464. [PubMed] [DOI] |
| 13. | Pan W, Ishii H, Ebihara Y, Gobe G. Prognostic use of growth characteristics of early gastric cancer and expression patterns of apoptotic, cell proliferation, and cell adhesion proteins. J Surg Oncol. 2003;82:104-110. [PubMed] [DOI] |
| 14. | Ding YB, Chen GY, Xia JG, Zang XW, Yang HY, Yang L, Liu YX. Correlation of tumor-positive ratio and number of perigastric lymph nodes with prognosis of patients with surgically-removed gastric carcinoma. World J Gastroenterol. 2004;10:182-185. [PubMed] |
| 15. | Msika S, Benhamiche AM, Jouve JL, Rat P, Faivre J. Prognostic factors after curative resection for gastric cancer. A population-based study. Eur J Cancer. 2000;36:390-396. [PubMed] [DOI] |
| 16. | Yokota T, Kunii Y, Saito T, Teshima S, Narushima Y, Yamada Y, Iwamoto K, Kagami M, Takahashi M, Kikuchi S. Clinicopathologic prognostic factors in patients with Borrmann type 4 gastric cancer: univariate and multivariate analyses. Ups J Med Sci. 2000;105:227-234. [PubMed] |
| 18. | Singletary SE, Allred C, Ashley P, Bassett LW, Berry D, Bland KI, Borgen PI, Clark GM, Edge SB, Hayes DF. Staging system for breast cancer: revisions for the 6th edition of the AJCC Cancer Staging Manual. Surg Clin North Am. 2003;83:803-819. [PubMed] |
| 19. | Hayashi H, Ochiai T, Suzuki T, Shimada H, Hori S, Takeda A, Miyazawa Y. Superiority of a new UICC-TNM staging system for gastric carcinoma. Surgery. 2000;127:129-135. [PubMed] [DOI] |
| 20. | Pacelli F, Papa V, Caprino P, Sgadari A, Bossola M, Doglietto GB. Proximal compared with distal gastric cancer: multivariate analysis of prognostic factors. Am Surg. 2001;67:697-703. [PubMed] |
| 21. | Adachi Y, Shiraishi N, Suematsu T, Shiromizu A, Yamaguchi K, Kitano S. Most important lymph node information in gastric cancer: multivariate prognostic study. Ann Surg Oncol. 2000;7:503-507. [PubMed] [DOI] |
| 22. | Xin Y, Li XL, Wang YP, Zhang SM, Zheng HC, Wu DY, Zhang YC. Relationship between phenotypes of cell-function differentiation and pathobiological behavior of gastric carcinomas. World J Gastroenterol. 2001;7:53-59. [PubMed] [DOI] |
| 23. | Shiraishi N, Adachi Y, Kitano S, Bandoh T, Inomata M, Yasuda K, Tsuchihashi J, Kinukawa N. Gastric cancer with extragastric lymph node metastasis: multivariate prognostic study. Gastric Cancer. 2000;3:211-218. [PubMed] [DOI] |
| 24. | Shimada S, Yagi Y, Honmyo U, Shiomori K, Yoshida N, Ogawa M. Involvement of three or more lymph nodes predicts poor prognosis in submucosal gastric carcinoma. Gastric Cancer. 2001;4:54-59. [PubMed] [DOI] |
| 25. | Adachi Y, Shiraishi N, Inomata M, Yasuda K, Hirabayashi Y, Kitano S. Location of tumor and distribution of lymph node metastasis in gastric cancer: lesser curve or greater curve. Int J Surg Investig. 2000;1:517-523. [PubMed] |
| 26. | Matsuzaki H, Kikuchi S, Kakita A. Evaluation of the morphology of submucosal tumor invasion and its volume in early gastric cancer. In Vivo. 2003;17:41-44. [PubMed] |
| 27. | Nitti D, Marchet A, Olivieri M, Ambrosi A, Mencarelli R, Belluco C, Lise M. Ratio between metastatic and examined lymph nodes is an independent prognostic factor after D2 resection for gastric cancer: analysis of a large European monoinstitutional experience. Ann Surg Oncol. 2003;10:1077-1085. [PubMed] [DOI] |