修回日期: 2004-02-09
接受日期: 2004-03-24
在线出版日期: 2004-06-15
目的: 探讨血小板衍化内皮细胞生长因子(platelet-derived endothelial cell growth factor, PD-ECGF)和环氧化酶2(Cox-2)在胃癌组织中的表达及与血管生成和细胞凋亡的关系.
方法: 应用免疫组化技术对67例胃癌组织进行PD-ECGF、Cox-2及肿瘤组织微血管密度(microvascular density, MVD)检测, 流式细胞术检测胃癌细胞凋亡指数(apoptosis index, AI).
结果: PD-ECGF的表达与胃癌淋巴结转移(P<0.05)、分化程度(P<0.05)及组织分型(P<0.05)显著相关, Cox-2的表达与胃癌淋巴结转移(P<0.01)显著相关; 二者与MVD (P<0.01)显著正相关, 与AI (P<0.01)显著负相关, 二者共同表达阳性者MVD显著高于共同表达阴性者(P<0.01), 二者共同表达阳性者AI显著低于共同表达阴性者(P<0.01).
结论: 胃癌组织中PD-ECGF和Cox-2可促进血管生成, 抑制胃癌细胞凋亡, 二者起协同作用, 促进胃癌的增生与转移.
引文著录: 潘峰, 任建国, 周传文, 张振玉, 赵君宁, 周锡荣. 胃癌组织血小板衍化内皮细胞生长因子、环氧化酶2的表达与血管生成和细胞凋亡的关系. 世界华人消化杂志 2004; 12(6): 1268-1272
Revised: February 9, 2004
Accepted: March 24, 2004
Published online: June 15, 2004
AIM: To investigate the relationship of the expression of platelet-derived endothelial cell growth factor/thymidine phosphorylase (PD-ECGF/TP) and Cox-2 to angiogenesis and apoptosis in gastric carcinoma.
METHODS: The expression of PD-ECGF and Cox-2 and the microvascular density (MVD) level were examined by immunohistochemical staining, and apoptotic index (AI) was examined by flow cytometry in 67 cases of gastric carcinoma.
RESULTS: There was a close correlation between PD-ECGF expression and several clinicopathological factors including lymph node metastasis (P < 0.05), histology (P < 0.05) and histological type (P < 0.05). The expression of Cox-2 was closely related to lymph node metastasis (P < 0.05); The expression of PD-ECGF or Cox-2 in gastric cancer tissues was positively correlated with MVD (P < 0.01) and negatively correlated with AI (P < 0.01). Combined analysis of PD-ECGF and Cox-2 showed that tumors with positive expression of both factors had a significantly lower AI and a significantly higher MVD than tumors with negative expression of both factors (P < 0.01).
CONCLUSION: Up-regulation of PD-ECGF and Cox-2 may facilitate tumor angiogenesis and inhibit apoptosis in gastric carcinoma, indicating cooperation between PD-ECGF and Cox-2 in gastric cancer, and therefore promote tumor growth and metastasis.
- Citation: Pan F, Ren JG, Zhou CW, Zhang ZY, Zhao JN, Zhou XR. Correlation of platelet-derived endothelial cell growth factor/ thymidine phosphorylase and Cox-2 expression to angiogenesis and apoptosis in gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2004; 12(6): 1268-1272
- URL: https://www.wjgnet.com/1009-3079/full/v12/i6/1268.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i6.1268
胃癌的发生、发展是多因素、多基因作用的过程. 而肿瘤的增生与凋亡是其基本过程. 胃癌在其增生及转移过程中, 肿瘤血管的形成起着重要作用, 为肿瘤的生长和播散提供了途径. Folkman et al[1]指出如果没有血管生成, 原发肿瘤的生长不会超过1-2 mm3. 血小板衍化内皮细胞生长因子(platelet-derived endothelial cell growth factor, PD-ECGF)是血管生成研究领域相对较新的一个血管生长因子; 环氧化酶-2(cyclooxygenase-2, COX-2)促进肿瘤增生, 抑制凋亡发生. 二者在胃癌组织中的关系目前国内外未见报道. 本文用免疫组化法和流式细胞术研究胃癌组织中PD-ECGF与COX-2的表达与二者相互之间的关系, 以及二者对胃癌血管密度(MVD)的影响和细胞凋亡指数(AI)的关系.
67份胃癌组织标本取自我院2001-03/2002-09手术切除者, 均经病理证实. 全部病例术前均未接受放疗和化疗. 67例患者中, 男性49例, 女性18例. 年龄31-78岁, 中位年龄61.0岁. 其中早期胃癌5例, 进展期胃癌62例, 进展期胃癌按Borrmann肉眼分型为Ⅰ、Ⅱ、Ⅲ、Ⅳ型. 按组织分化程度、Lauren分型及是否合并淋巴结转移分组. 免疫组化SP试剂盒购自福州迈新公司. 特异性一抗分别为即用型鼠抗人PD-ECGF单克隆抗体(P-GF.44C, Neomarker公司); 兔抗人COX-2单克隆抗体(武汉博士德公司), 按1:80稀释; 鼠抗人Ⅷ因子多克隆抗体(Z002, Neomarker公司), 按1:100稀释. 流式细胞DNA细胞周期分析试剂盒(Cycle Test DNA Reagent Kit)购自美国BD公司.
1.2.1 免疫组化法: 所有标本均经10%甲醛固定, 石蜡包埋, 5 mm厚连续切片. 免疫组化采用SP法, DAB染色. 加一抗前行微波抗原修复. 每次染色前均采用PBS缓冲液代替一抗作为阴性对照, 光镜下观察. 结果判断: PD-ECGF采用半定量积分法[2], 着色细胞比例1/3以下为1分, 1/3-2/3为2分, 2/3以上为3分.着色程度: 无着色为0分, 浅黄色1分, 棕黄色为2分.根据二者之和判断阳性等级, 0-3分为阴性, 4分以上为阳性. Ⅷ因子计数参照Weidner[3]法, 计算5个光镜视野最高微血管染色区域微血管密度(microvascular density, MVD)平均数.
1.2.2 流式细胞术: 癌灶部位多点取材, 剪碎、搓揉组织, 生理盐水冲洗, 300目尼龙滤网过滤成单细胞悬液, 离心, 取细胞沉淀, 离心, 用PBS液洗涤、离心两遍. 调整细胞数, 悬液在显微镜下细胞计数2×106/mL个, 加入DNA分析试剂(破膜剂、PI染料、RNA酶等), 避光, 4 ℃冰箱中孵育30 min, 上机检测, 观察细胞凋亡峰, 计算凋亡指数AI.
统计学处理 PD-ECGF、cox-2、MVD、AI和临床病理因素之间的关系采用χ2检验、t检验和Spearman相关检验, SPSS11.5统计软件分析.
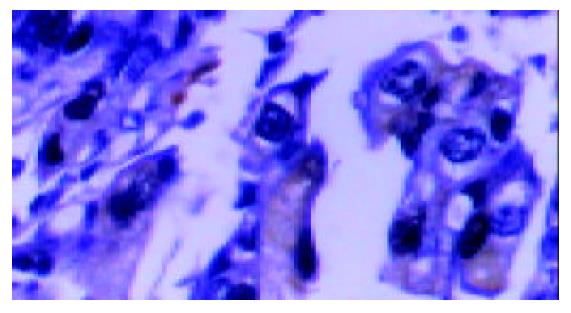
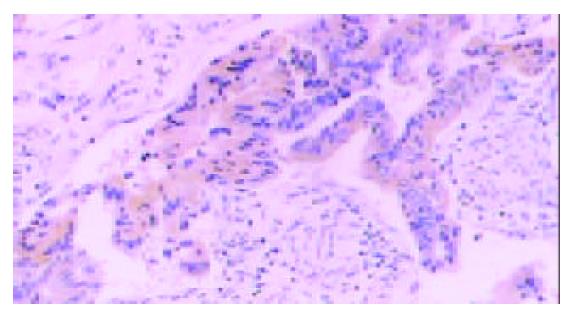
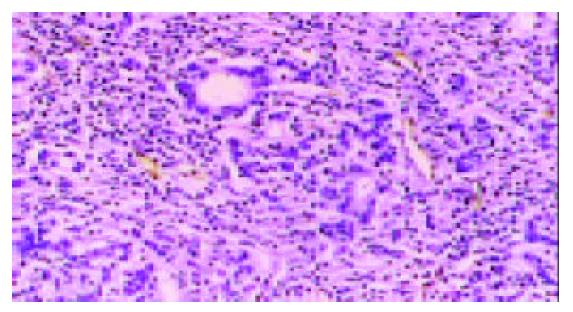
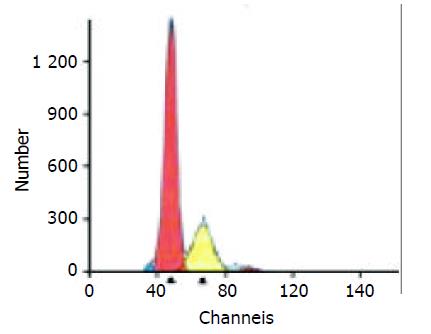
PD-ECGF阳性表达多位于肿瘤细胞的胞质内和间质细胞中, 为棕黄色颗粒(图1). COX-2主要在胃癌细胞胞质中表达(图2), Ⅷ因子染色显示MVD(图3). 胃癌细胞凋亡检测显示凋亡峰及凋亡百分率(图4), AI范围在本组中为0.16-6.10, 平均1.69±1.35.
PD-ECGF表达与胃癌的Lauren分型、组织分化程度和淋巴结转移均密切相关(P<0.05). Cox-2的表达与胃癌组织分型(P<0.01)显著相关. MVD与胃癌淋巴结转移显著正相关(P<0.01), AI值与胃癌淋巴结转移显著负相关(P<0.05). (表1).
| 临床病理因素 | PD-ECGF | P值 | COX-2 | P值 | MVD | P值 | AI | P值 | |||
| 阳性(n) | 阴性(n) | 阳性(n) | 阴性(n) | ||||||||
| Borrmann分型 | |||||||||||
| Ⅰ+Ⅱ | 18 | 10 | 0.092 | 20 | 8 | 0.484 | 40.82±7.97 | 0.982 | 1.95±1.44 | 0.07 | |
| Ⅲ+Ⅳ | 15 | 19 | 23 | 11 | 40.76±11.26 | 1.37±1.03 | |||||
| 组织分化程度 | |||||||||||
| 低分化+未分化 | 13 | 20 | 0.033a | 22 | 11 | 0.535 | 39.62±10.35 | 0.791 | 1.57±1.19 | 0.482 | |
| 中分化+高分化 | 22 | 12 | 22 | 12 | 40.27±9.77 | 1.80±1.51 | |||||
| Lauren分型 | |||||||||||
| 肠型 | 23 | 11 | 0.010b | 25 | 9 | 0.132 | 42.03±10.10 | 0.083 | 1.75±1.47 | 0.677 | |
| 弥漫型 | 12 | 21 | 19 | 14 | 37.79±9.56 | 1.62±1.22 | |||||
| 淋巴结转移 | |||||||||||
| 有 | 25 | 14 | 0.020a | 31 | 8 | 0.005c | 42.82±10.11 | 0.005d | 1.39±0.92 | 0.031e | |
| 无 | 10 | 18 | 13 | 15 | 35.93±8.48 | 2.10±1.72 | |||||
PD-ECGF、COX-2表达阳性的胃癌组织MVD显著高于阴性者(P<0.01); PD-ECGF、COX-2表达阳性的胃癌组织AI显著低于阴性者(P<0.05). PD-ECGF、COX-2共同表达阳性的胃癌组织MVD显著高于只有其中一种因子表达阳性者(P<0.05)和二者均阴性者(P<0.01), 其AI值显著低于只有其中一种因子表达阳性者(P<0.05)和二者均阴性者(P<0.01). 胃癌组织中PD-ECGF和COX-2表达呈显著相关(P<0.05), 提示PD-ECGF与COX-2可能起协同作用. 见(表2-4).
| PD-ECGF | P | COX-2 | P | |||
| 阳性 | 阴性 | 阳性 | 阴性 | |||
| MVD | 43.37±11.39 | 36.19±6.53 | 0.003 | 45.30±8.96 | 32.00±4.85 | 0.004 |
| AI | 1.23±0.83 | 2.18±1.6 | 0.003 | 1.55±1.1 | 1.89±1.63 | 0.017 |
| 分组 | PD-ECGF | |
| 阳性n(%) | 阴性n(%) | |
| COX-2 | ||
| 阳性(n) | 25(37.31%) | 15(22.39%) |
| 阴性(n) | 10(14.93%) | 17(25.37%) |
PD-ECGF是一类较新发现的促血管生长因子, 体外可趋化内皮细胞, 体内有诱导血管生成的作用[4]. 胸苷酶解产物胸腺嘧啶和2-脱氧核糖-1-磷酸本身也有趋化内皮细胞和促血管生成作用[5-6]. PD-ECGF在结肠癌、肺癌、肝癌、乳腺癌等肿瘤中的表达显著增高[7-11]. Yoshikawa et al[12]用ELISA法发现PD-ECGF与胃癌肉眼分型及组织分化程度显著相关, 与淋巴结转移无关. 而我们的研究发现PD-ECGF的表达与Lauren分型、组织分化程度及淋巴结转移密切相关, 而与肉眼分型的关系无显著性. 这种差异可能与选择病例的比例、测定方法、计数差异等不同有关. Matsushita et al将PD-ECGF转入大鼠KB细胞(即KB-TP)后发现其平均微血管密度显著增高[13], 我们的研究证实PD-ECGF可诱导血管生成, 促进胃癌的生长和转移.我们认为, PD-ECGF促进肿瘤微血管生成的机制一方面在于他的酶活性, 可降低抑制内皮细胞活性的胸苷水平而促进血管生成, 其反应产物胸腺嘧啶、2-脱氧核糖-1-磷酸和2-脱氧-D-核糖均有趋化内皮细胞和促血管生成作用; 另一方面可能与多种促血管因子起协同作用相关. 肿瘤的发生不仅依赖于细胞的增生, 也依赖于细胞凋亡的发生. 我们的研究同时证实凋亡减少与淋巴结转移呈正相关, 有助于进一步判断预后, 这与Osaki et al[14]的结论相似, 其机制可能为(1)胸苷产物的减少、细胞周期DNA的复制或修复障碍. (2)PD-ECGF产物2-脱氧-D-核糖抑制Caspase 3活性, 下调Bcl-2和Bcl-x(L)水平, 抑制凋亡发生[15-16]. (3)影响细胞内信号传导(4)高的肿瘤微血管环境和逃避凋亡机制等. 研究表明, PD-ECGF过度表达的胃癌细胞对5-FU和5'-DFUR敏感性显著增高[17], 提示PD-ECGF表达对于化疗药物的选择及疗效有重要意义.
近年来众多研究表明COX-2参与了癌症的发生、进展[18-20]. 一般认为COX-2高表达是癌症发生的早期事件[21]. COX-2表达与胃癌的类型、分级、分化和淋巴结转移的关系许多学者作了相关研究, 结论也有相当的差异. Yamagata et al[22]研究发现COX-2 在肠型胃癌中的表达显著高于弥漫型胃癌.Murata et al[23] 则发现COX-2表达促进胃癌淋巴管侵犯和淋巴结转移, 而与胃癌大小、组织病理类型、静脉侵犯等因素无关.我们的研究与前者有差异而与后者相似, 提示COX-2的过表达与胃癌的侵袭和转移能力密切相关, 其机制尚不明确.Fosslien et al[24]研究发现新生血管在COX-2表达的区域显著增生, 而COX-2抑制剂可显著抑制血管生成, 提示COX-2在血管生成中起重要作用. COX-2的过表达在肿瘤局部产生过多PGs, 可促进新生血管的生成, 可能是肿瘤组织生长、侵袭和转移的基础. 我们的研究同时显示胃癌组织中COX-2的表达与AI呈负相关, 这一结果与大多数研究相一致[25-28]. COX-2诱导细胞凋亡的机制可能为: (1)COX-2可增加细胞黏附于细胞外基质的能力, 抑制凋亡. (2)致肿瘤细胞CyclinD1表达下降, G1期延长而抑制凋亡. (3)COX-2催化产物与核内受体PPARs结合, 下调TNF-α, 抑制NF-κB的活性而抑制细胞凋亡. (4)促进bcl-2、bcl-xl、bax、survivin等基因的表达. (5)可能通过蛋白激酶C(PCK)依赖途径抑制凋亡发生. 为COX-2抑制剂防治肿瘤提供了依据[29-32].
PD-ECGF 与COX-2在肿瘤组织中的关系目前资料甚少. Fujiwaki et al[33]发现子宫内膜癌患者PD-ECGF与COX-2共同表达者微血管密度显著增高, 并认为低氧、多种细胞因子等因素可上调PD-ECGF与COX-2的表达[34-37], 促进肿瘤的增生和血管生成.我们进一步研究了PD-ECGF 与COX-2在胃癌组织中的关系以及与MVD和AI 的关系, 结果表明,PD-ECGF、COX-2表达阳性者MVD显著高于阴性者, AI显著低于阴性者, 且二者共同表达阳性的胃癌组织MVD显著高于只有其中一种因子表达阳性者(P<0.05)和二者均阴性者(P<0.01), AI显著低于只有其中一种因子表达阳性者(P<0.05)和二者均阴性者(P<0.01). 这一结果提示PD-ECGF、COX-2在胃癌血管生成和细胞凋亡过程中起协同作用. 研究表明, 表皮生长因子(EGF)主要通过酪氨酸蛋白激酶(PKC)途径激活COX-2基因[38]; 胰岛素样生长因子(IGF)通过磷脂酰肌醇-3激酶上调COX-2的表达[39], 各种激酶并不直接促进COX-2的转录, 而是通过激活其下游的转录因子而促进COX-2基因的转录的, 我们推测PD-ECGF与COX-2之间可能也存在某种中间途径, 最终相互激活、促进转录和翻译过程, 但究竟经过哪种中间途径, 尚需进一步研究. PD-ECGF具胸苷磷酸化酶活性, 可降低抑制内皮细胞的胸苷水平而促进血管生成, 其代谢产物也有趋化内皮细胞和促血管生成作用, COX-2可能通过PGs表达途径促血管生成, 二者对胃癌微血管生成有协同作用, 他们自身及其代谢产物之间有怎样的关系, 或是通过中间环节相互作用以及他们对胃癌细胞凋亡的相互作用机制, 还需要我们在以后的研究中进一步探讨.
| 1. | Folkman J, Cotran R. Relation of vascular proliferation to tumor growth. Int Rev Exp Pathol. 1976;16:207-248. [PubMed] |
| 2. | Krajewska M, Krajewski S, Epstein JI, Shabaik A, Sauvageot J, Song K, Kitada S, Reed JC. Immunohistochemical analysis of bcl-2, bax, bcl-X, and mcl-1 expression in prostate cancers. Am J Pathol. 1996;148:1567-1576. [PubMed] |
| 3. | Weidner N. Current pathologic methods for measuring intratumoral microvessel density within breast carcinoma and other solid tumors. Breast Cancer Res Treat. 1995;36:169-180. [PubMed] [DOI] |
| 4. | Akiyama S. [Thymidine phosphorylase and angiogenesis]. Gan To Kagaku Ryoho. 2000;27:1208-1211. [PubMed] |
| 5. | Haraguchi M, Miyadera K, Uemura K, Sumizawa T, Furukawa T, Yamada K, Akiyama S, Yamada Y. Angiogenic activity of enzymes. Nature. 1994;368:198. [PubMed] [DOI] |
| 6. | Sengupta S, Sellers LA, Matheson HB, Fan TP. Thymidine phosphorylase induces angiogenesis in vivo and in vitro: an evaluation of possible mechanisms. Br J Pharmacol. 2003;139:219-231. [PubMed] [DOI] |
| 7. | Morinaga S, Yamamoto Y, Noguchi Y, Imada T, Rino Y, Akaike M, Sugimasa Y, Takemiya S, Takanashi Y. Platelet-derived endothelial cell growth factor (PD-ECGF) is up-regulated in human hepatocellular carcinoma (HCC) and the corresponding hepatitis liver. Hepatogastroenterology. 2003;50:1521-1526. [PubMed] |
| 8. | Yang Q, Barbareschi M, Mori I, Mauri F, Muscarà M, Nakamura M, Nakamura Y, Yoshimura G, Sakurai T, Caffo O. Prognostic value of thymidine phosphorylase expression in breast carcinoma. Int J Cancer. 2002;97:512-517. [PubMed] [DOI] |
| 9. | Tominaga T, Toi M, Ohashi Y, Abe O; 5'-BC Study Group. Prognostic and predictive value of thymidine phosphorylase activity in early-stage breast cancer patients. Clin Breast Cancer. 2002;3:55-64. [PubMed] [DOI] |
| 10. | Ikeguchi M, Makino M, Kaibara N. Thymidine phosphorylase and dihydropyrimidine dehydrogenase activity in colorectal carcinoma and patients prognosis. Langenbecks Arch Surg. 2002;387:240-245. [PubMed] [DOI] |
| 11. | Sato J, Sata M, Nakamura H, Inoue S, Wada T, Takabatake N, Otake K, Tomoike H, Kubota I. Role of thymidine phosphorylase on invasiveness and metastasis in lung adenocarcinoma. Int J Cancer. 2003;106:863-870. [PubMed] [DOI] |
| 12. | Yoshikawa T, Suzuki K, Kobayashi O, Sairenji M, Motohashi H, Tsuburaya A, Nakamura Y, Shimizu A, Yanoma S, Noguchi Y. Thymidine phosphorylase/platelet-derived endothelial cell growth factor is upregulated in advanced solid types of gastric cancer. Br J Cancer. 1999;79:1145-1150. [PubMed] [DOI] |
| 13. | Matsushita S, Nitanda T, Furukawa T, Sumizawa T, Tani A, Nishimoto K, Akiba S, Miyadera K, Fukushima M, Yamada Y. The effect of a thymidine phosphorylase inhibitor on angiogenesis and apoptosis in tumors. Cancer Res. 1999;59:1911-1916. [PubMed] |
| 14. | Osaki M, Sakatani T, Okamoto E, Goto E, Adachi H, Ito H. Thymidine phosphorylase expression results in a decrease in apoptosis and increase in intratumoral microvessel density in human gastric carcinomas. Virchows Arch. 2000;437:31-36. [PubMed] [DOI] |
| 15. | Ikeda R, Furukawa T, Kitazono M, Ishitsuka K, Okumura H, Tani A, Sumizawa T, Haraguchi M, Komatsu M, Uchimiya H. Molecular basis for the inhibition of hypoxia-induced apoptosis by 2-deoxy-D-ribose. Biochem Biophys Res Commun. 2002;291:806-812. [PubMed] [DOI] |
| 16. | Mori S, Takao S, Ikeda R, Noma H, Mataki Y, Wang X, Akiyama S, Aiko T. Role of thymidine phosphorylase in Fas-induced apoptosis. Hum Cell. 2001;14:323-330. [PubMed] |
| 17. | Kubota T, Sasano N, Abe O, Nakao I, Kawamura E, Saito T, Endo M, Kimura K, Demura H, Sasano H. Potential of the histoculture drug-response assay to contribute to cancer patient survival. Clin Cancer Res. 1995;1:1537-1543. [PubMed] |
| 18. | Sung YK, Hwang SY, Kim JO, Bae HI, Kim JC, Kim MK. The correlation between cyclooxygenase-2 expression and hepatocellular carcinogenesis. Mol Cells. 2004;17:35-38. [PubMed] |
| 19. | Sinicrope FA, Gill S. Role of cyclooxygenase-2 in colorectal cancer. Cancer Metastasis Rev. 2004;23:63-75. [PubMed] [DOI] |
| 20. | Hashimoto Y, Kondo Y, Kimura G, Matsuzawa I, Sato S, Ishizaki M, Imura N, Akimoto M, Hara S. Cyclooxygenase-2 expression and relationship to tumour progression in human renal cell carcinoma. Histopathology. 2004;44:353-359. [PubMed] [DOI] |
| 21. | Shiotani H, Denda A, Yamamoto K, Kitayama W, Endoh T, Sasaki Y, Tsutsumi N, Sugimura M, Konishi Y. Increased expression of cyclooxygenase-2 protein in 4-nitroquinoline-1-oxide-induced rat tongue carcinomas and chemopreventive efficacy of a specific inhibitor, nimesulide. Cancer Res. 2001;61:1451-1456. [PubMed] |
| 22. | Yamagata R, Shimoyama T, Fukuda S, Yoshimura T, Tanaka M, Munakata A. Cyclooxygenase-2 expression is increased in early intestinal-type gastric cancer and gastric mucosa with intestinal metaplasia. Eur J Gastroenterol Hepatol. 2002;14:359-363. [PubMed] [DOI] |
| 23. | Murata H, Kawano S, Tsuji S, Tsuji M, Sawaoka H, Kimura Y, Shiozaki H, Hori M. Cyclooxygenase-2 overexpression enhances lymphatic invasion and metastasis in human gastric carcinoma. Am J Gastroenterol. 1999;94:451-455. [PubMed] [DOI] |
| 24. | Fosslien E. Review: molecular pathology of cyclooxygenase-2 in cancer-induced angiogenesis. Ann Clin Lab Sci. 2001;31:325-348. [PubMed] |
| 25. | Nagai N, Tian X, Mukai K, Hirata E, Kusuda T, Shiroyama Y, Shigemasa K, Ohama K. Overexpression of cyclooxygenase-2 protein and its relationship to apoptosis in cervical carcinoma treated with neoadjuvant chemotherapy. Int J Mol Med. 2003;12:709-714. [PubMed] [DOI] |
| 26. | Wang HX, Chen QK. [Expression and significance of cyclooxygenase-2 in human pancreatic carcinomas]. Ai Zheng. 2003;22:649-652. [PubMed] |
| 27. | Kawai N, Tsujii M, Tsuji S. Cyclooxygenases and colon cancer. Prostaglandins Other Lipid Mediat. 2002;68-69:187-196. [PubMed] [DOI] |
| 28. | Kirschenbaum A, Liu X, Yao S, Levine AC. The role of cyclooxygenase-2 in prostate cancer. Urology. 2001;58:127-131. [PubMed] [DOI] |
| 29. | Becerra C. Cox-2 inhibition for the treatment of colon cancer. Int J Cancer. 2004;110:310. [PubMed] [DOI] |
| 30. | Wang D, Dubois RN. Cyclooxygenase-2: a potential target in breast cancer. Semin Oncol. 2004;31:64-73. [PubMed] [DOI] |
| 31. | Lin DW, Nelson PS. The role of cyclooxygenase-2 inhibition for the prevention and treatment of prostate carcinoma. Clin Prostate Cancer. 2003;2:119-126. [PubMed] [DOI] |
| 32. | Altorki N. COX-2: a target for prevention and treatment of esophageal cancer. J Surg Res. 2004;117:114-120. [PubMed] [DOI] |
| 33. | Fujiwaki R, Iida K, Kanasaki H, Ozaki T, Hata K, Miyazaki K. Cyclooxygenase-2 expression in endometrial cancer: correlation with microvessel count and expression of vascular endothelial growth factor and thymidine phosphorylase. Hum Pathol. 2002;33:213-219. [PubMed] [DOI] |
| 34. | Herschman HR. Prostaglandin synthase 2. Biochim Biophys Acta. 1996;1299:125-140. [PubMed] [DOI] |
| 35. | Eda H, Fujimoto K, Watanabe S, Ura M, Hino A, Tanaka Y, Wada K, Ishitsuka H. Cytokines induce thymidine phosphorylase expression in tumor cells and make them more susceptible to 5'-deoxy-5-fluorouridine. Cancer Chemother Pharmacol. 1993;32:333-338. [PubMed] [DOI] |
| 36. | Griffiths L, Dachs GU, Bicknell R, Harris AL, Stratford IJ. The influence of oxygen tension and pH on the expression of platelet-derived endothelial cell growth factor/thymidine phosphorylase in human breast tumor cells grown in vitro and in vivo. Cancer Res. 1997;57:570-572. [PubMed] |
| 37. | Schmedtje JF Jr, Ji YS, Liu WL, DuBois RN, Runge MS. Hypoxia induces cyclooxygenase-2 via the NF-kappaB p65 transcription factor in human vascular endothelial cells. J Biol Chem. 1997;272:601-608. [PubMed] [DOI] |
| 38. | Slice LW, Hodikian R, Zhukova E. Gastrin and EGF synergistically induce cyclooxygenase-2 expression in Swiss 3T3 fibroblasts that express the CCK2 receptor. J Cell Physiol. 2003;196:454-463. [PubMed] [DOI] |