修回日期: 2004-01-09
接受日期: 2004-02-01
在线出版日期: 2004-05-15
目的: 检测大肠癌组织Survivin和环氧化酶(Cox-2)的表达情况, 并探讨二者之间的相关性.
方法: 应用免疫组织化学(S-P)方法分别检测Survivin和Cox-2在40例大肠癌及34例正常大肠黏膜中的表达情况.
结果: Survivin的阳性表达定位于细胞质, 在大肠癌组织中其阳性率为67.5%, 正常大肠黏膜组织中阳性率为0, 二者差异十分显著(P<0.01); Cox-2的阳性表达定位于细胞质, 在大肠癌组织中其阳性率为90%, 正常大肠黏膜组织中阳性率为11.8%, 二者差异十分显著(P<0.01). Survivin和Cox-2的表达具有一定的相关性(r = 0.39, P<0.05).
结论: 大肠癌组织中Survivin过表达可能是最终导致大肠癌发生的突破点, Survivin和Cox-2的协同表达表明大肠癌中的抑制凋亡是通过多种通路实现的.
引文著录: 金玉, 林连捷, 郑长青. 大肠癌组织中Survivin和Cox-2表达的相关性. 世界华人消化杂志 2004; 12(5): 1218-1220
Revised: January 9, 2004
Accepted: February 1, 2004
Published online: May 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(5): 1218-1220
- URL: https://www.wjgnet.com/1009-3079/full/v12/i5/1218.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i5.1218
凋亡的调节对人体组织保持内环境稳态及正常细胞形态至关重要, 这一过程受到干扰将使细胞的寿命无限延长或累积突变, 有利于肿瘤的发生. Survivin, 凋亡抑制蛋白家族(IAP)的新成员, 是一种最近才发现的抗凋亡基因, Survivin在胎盘和胚胎组织中高水平表达, 在正常组织中不表达, 已经证实Survivin在许多肿瘤中过表达[1-3], 但Survivin在大肠癌中的作用所知甚少. 大肠癌发生、发展过程中环氧化酶(Cox)-2表达增加 [4-5], 大量研究证实表达Cox-2的细胞株增加癌变潜能与抵抗凋亡有关, 但是关于Cox-2和Survivin的相关性还不清楚. 本实验通过检测Survivin在大肠癌中的表达说明 Survivin在大肠癌发生、发展过程中的作用, 另外探讨大肠癌中Survivin和Cox-2表达的相关性.
中国医科大学附属第二医院2002-06/2002-10手术切除和内窥镜活检后的大肠组织74例, 大肠癌组织40例, 其中男29例, 女11例, 33-74岁, 平均年龄61.4±10.7岁, 所有患者术前均未接受放疗和化疗. 选择34例正常大肠黏膜作为对照, 其中男20例, 女14例, 35-70岁, 平均年龄60.5±19.4岁. Survivin羊抗人多克隆抗体(sc-8806), Cox-2 单克隆抗体均为Santa Cruz公司产品, Survivin一抗工作浓度1:50, Cox-2一抗工作浓度1:75, SP试剂盒为北京中山生物技术有限公司产品.
采用链霉卵白素-生物素-辣根过氧化物酶复合法(S-P法)进行免疫组化染色. 在400倍放大的显微镜下记数至少5个随机视野, 取平均值, 阳性细胞数小于10%计为阴性, 余下为阳性, 采用盲法计数.
统计学处理 采用χ2检验, P<0.05有统计学意义. Survivin和Cox-2的相关性分析采用Spearman检验, P<0.05有统计学意义.
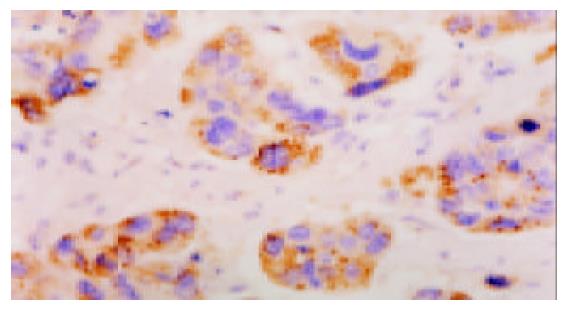
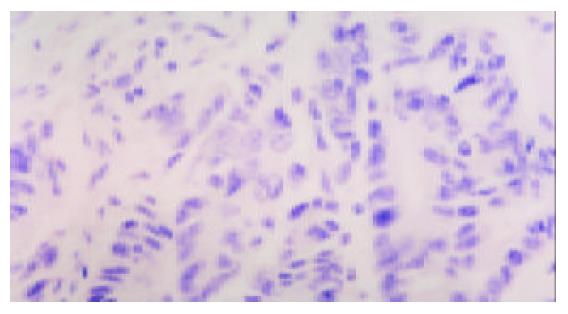
Survivin阳性染色主要在大肠癌细胞的细胞质中(图1), 大肠癌中其阳性率为67.5%, 而正常大肠黏膜中未见到阳性表达(图2), 二者差异十分显著(P<0.01)(表1).
| 研究对象 | n | Survivin | |
| 阳性 | 阴性 | ||
| 大肠癌组织 | 40 | 27 | 13 |
| 正常大肠黏膜 | 34 | 0 | 34 |
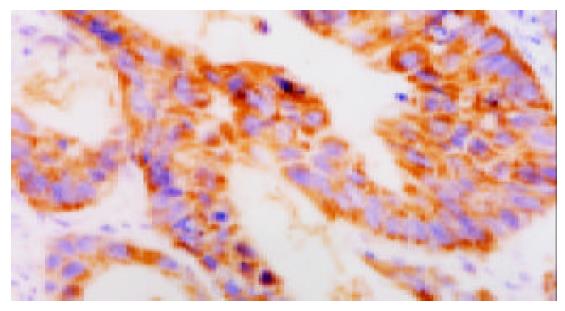
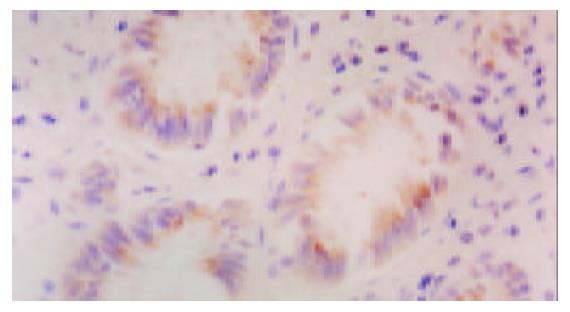
Cox-2的阳性表达定位于细胞质中, 大肠癌及正常大肠黏膜中均可见阳性表达, 阳性率分别为90%(图3)和11.8%(图4), 二者差异十分显著(P<0.01)(表2).
| 研究对象 | n | Cox-2 | |
| 阳性 | 阴性 | ||
| 大肠癌组织 | 40 | 36 | 4 |
| 正常大肠黏膜 | 34 | 4 | 30 |
采用Spearman检验结果表明存在正相关(r = 0.39, P<0.05).
大肠癌的发展分多个阶段, 受多基因调控, 包括累积突变和细胞周期调节失衡, 在大肠癌的早期阶段检测出这些改变可以解释大肠癌的发展过程. IAP家族是一种广泛表达的抑制凋亡的基因家族, Survivin是人们最近发现的凋亡抑制蛋白家族的新成员[6], Survivin基因定位于17q25, 分子量16.5 kD, Survivin有保护细胞、维持微管结构完整性的作用, 他的表达特点是在胎盘和胚胎组织中强烈表达, 在终末分化良好的正常组织中不表达, 在许多恶性肿瘤组织胞质中重新出现高水平表达, 这样可以使肿瘤细胞免于凋亡, 促进有丝分裂的畸变, 加速多倍体的形成. 外界某些凋亡刺激因子激活caspase[7-8], 通过线粒体释放细胞色素c激活胞质内的caspase级联反应, 形成了由procaspase-9, Apaf-1, 细胞色素c和dATP组成的凋亡小体, 最终激活caspase-3和caspase-9而导致凋亡, Survivin调节线粒体内膜通过电压依赖的离子通道释放细胞色素c, 比其他凋亡抑制基因如bcl-2的作用更强, 他可以直接与caspase-3和caspase-7结合, 使caspase的活性降低而抑制凋亡, 或者与caspase的启动子和效应子相互作用, 防止caspase蛋白水解酶活性成熟, 抑制细胞色素c的释放而保持线粒体的完整性; Survivin还可以调节G2/M细胞周期[9,25]. 本组实验得出这样的结果: Survivin阳性染色主要位于细胞质, 大肠癌中其阳性率为67.5%, 而正常大肠黏膜中未见到阳性表达, 二者差异十分显著(P<0.01), Lin et al[28]曾用免疫组化的方法检测Survivin蛋白在正常大肠黏膜、腺瘤及大肠癌中的表达情况时发现从正常大肠黏膜到腺瘤以及最终癌变的发展过程中Survivin表达逐渐增加[10], 而且Survivin表达强度与大肠癌分化程度无关, 由此证明Survivin重新表达的时机为肿瘤发生的早期.
有研究表明大肠癌中Survivin的表达阳性率较高, 且与肿瘤的分化程度及淋巴结转移无关[11], 在大肠癌的发生、发展过程中起重要作用, 这使得Survivin成为肿瘤特异性诊断指标, 并为大肠癌的治疗提供新的靶点. 实验[12]表明用磷酸化缺陷的Survivin Thr34→Ala突变体防止Survivin蛋白第34位苏氨酸(Thr34)磷酸化, Thr34磷酸化丢失导致Survivin-caspase-9复合体从有丝分裂结构中分离开, Survivin的表达下降, Survivin这种抗凋亡功能丢失使得依赖caspase-9的各种肿瘤细胞凋亡[25]. T34A的抗癌特性最近在严重联合免疫缺陷鼠黑素瘤异体移植动物模型中得到证实, SurvivinT34A的表达抑制肿瘤生长达60-70%. Yamamoto et al[13]将EPR-1导入结肠癌细胞株, 使Survivin表达下降, 降低细胞增生, 促进凋亡, 增加对抗癌药的敏感性.
研究表明Survivin干扰caspase-9的激活或直接与caspase-3和caspase-7结合而使凋亡的级联终止[25], 而生物体内的凋亡是多步骤过程, 是多种因子相互作用的级联反应. Cox-2是催化花生四烯酸转化为前列腺素的限速酶, 其过度表达与大肠癌的发生、发展密切相关, 大量研究已经证实在大肠癌的发生过程中Cox-2的表达增加[14], 本研究结果表明大肠癌中Cox-2的阳性率为90%, 而正常大肠黏膜中其阳性率为11.8%, 二者差异十分显著(χ2 = 45.29, P<0.01). 以往的研究发现肠上皮细胞内Cox-2过表达增加IAP水平, 而且前列腺素E2, Cox-2主要代谢产物, 可以增加人结肠癌细胞中另一种凋亡抑制蛋白Bcl-2的表达[15-17]; 另外, Cox-2抑制剂NSAIDs[18-20]阻断Cox-2通路, 使Bcl-2 表达下调, 肿瘤变小, 癌前和癌性病变细胞数减少[15,21-22], 使癌细胞对放化疗更敏感[23-24]; NSAIDs也可以通过诱导线粒体释放细胞色素c 、激活caspase-3和caspase-9而促进肿瘤细胞的凋亡[26-27]. Survivn和Cox-2在大肠癌中均呈高水平表达, 二者之间是否存在某种联系? 目前关于Survivin和Cox-2的相互作用所知甚少, Yu et al[29]研究Survivin在胃癌及其一级亲属中的表达时已证实Survivin和Cox-2有明显的相关性, Cox-2过表达的细胞株可以减少细胞色素c的释放, 并抑制caspase的活性[26], Cox-2表达的细胞株中内皮细胞生长因子受体(EGFR)呈高水平表达, Cox-2通过EGFR调节结肠癌细胞株的增生, 而Survivin也可以抑制caspase的活性, 调节血管内皮细胞的表达[30], 实验经统计学分析大肠癌中Survivin和Cox-2的表达具有正相关性(r = 0.39, P<0.05), 说明Survivin和Cox-2协同表达通过多种方式抑制凋亡.
Survivin作为凋亡抑制蛋白家族的新成员, 他的生物学特性及与多种生物因子的相互作用已得到共识, Survivin在大肠癌组织中表达, 而在正常大肠黏膜中不表达, Survivin和Cox-2的表达具有一定的正相关性, 这说明大肠癌中凋亡的抑制作用是通过多种通路实现的, 因此, 深入研究Survivin将对大肠癌的治疗、化疗药物的研制奠定理论基础.
| 1. | Kania J, Konturek SJ, Marlicz K, Hahn EG, Konturek PC. Expression of survivin and caspase-3 in gastric cancer. Dig Dis Sci. 2003;48:266-271. [PubMed] [DOI] |
| 2. | Grabowski P, Kühnel T, Mühr-Wilkenshoff F, Heine B, Stein H, Höpfner M, Germer CT, Scherübl H. Prognostic value of nuclear survivin expression in oesophageal squamous cell carcinoma. Br J Cancer. 2003;88:115-119. [PubMed] [DOI] |
| 3. | Ikeguchi M, Hirooka Y, Kaibara N. Quantitative analysis of apoptosis-related gene expression in hepatocellular carcinoma. Cancer. 2002;95:1938-1945. [PubMed] [DOI] |
| 4. | Zhang H, Sun XF. Overexpression of cyclooxygenase-2 correlates with advanced stages of colorectal cancer. Am J Gastroenterol. 2002;97:1037-1041. [PubMed] [DOI] |
| 5. | Wu AW, Gu J, Ji JF, Li ZF, Xu GW. Role of COX-2 in carcinogenesis of colorectal cancer and its relationship with tumor biological characteristics and patients' prognosis. World J Gastroenterol. 2003;9:1990-1994. [PubMed] [DOI] |
| 6. | Altieri DC. Survivin and apoptosis control. Adv Cancer Res. 2003;88:31-52. [PubMed] [DOI] |
| 7. | McKay TR, Bell S, Tenev T, Stoll V, Lopes R, Lemoine NR, McNeish IA. Procaspase 3 expression in ovarian carcinoma cells increases survivin transcription which can be countered with a dominant-negative mutant, survivin T34A; a combination gene therapy strategy. Oncogene. 2003;22:3539-3547. [PubMed] [DOI] |
| 8. | Chiou SK, Jones MK, Tarnawski AS. Survivin - an anti-apoptosis protein: its biological roles and implications for cancer and beyond. Med Sci Monit. 2003;9:PI25-PI29. [PubMed] |
| 9. | Altieri DC. Survivin, versatile modulation of cell division and apoptosis in cancer. Oncogene. 2003;22:8581-8589. [PubMed] [DOI] |
| 10. | Gianani R, Jarboe E, Orlicky D, Frost M, Bobak J, Lehner R, Shroyer KR. Expression of survivin in normal, hyperplastic, and neoplastic colonic mucosa. Hum Pathol. 2001;32:119-125. [PubMed] [DOI] |
| 11. | Kawasaki H, Toyoda M, Shinohara H, Okuda J, Watanabe I, Yamamoto T, Tanaka K, Tenjo T, Tanigawa N. Expression of survivin correlates with apoptosis, proliferation, and angiogenesis during human colorectal tumorigenesis. Cancer. 2001;91:2026-2032. [PubMed] [DOI] |
| 12. | Wall NR, O'Connor DS, Plescia J, Pommier Y, Altieri DC. Suppression of survivin phosphorylation on Thr34 by flavopiridol enhances tumor cell apoptosis. Cancer Res. 2003;63:230-235. [PubMed] |
| 13. | Yamamoto T, Tanigawa N. The role of survivin as a new target of diagnosis and treatment in human cancer. Med Electron Microsc. 2001;34:207-212. [PubMed] [DOI] |
| 14. | Einspahr JG, Krouse RS, Yochim JM, Danenberg PV, Danenberg KD, Bhattacharyya AK, Martínez ME, Alberts DS. Association between Cyclooxygenase expression and colorectal adenoma characteristics. Cancer Res. 2003;63:3891-3893. [PubMed] |
| 15. | Tang X, Sun YJ, Half E, Kuo MT, Sinicrope F. Cyclooxygenase-2 overexpression inhibits death receptor 5 expression and confers resistance to tumor necrosis factor-related apoptosis-inducing ligand-induced apoptosis in human colon cancer cells. Cancer Res. 2002;62:4903-4908. [PubMed] |
| 16. | Moran EM. Epidemiological and clinical aspects of nonsteroidal anti-inflammatory drugs and cancer risks. J Environ Pathol Toxicol Oncol. 2002;21:193-201. [PubMed] [DOI] |
| 17. | Cianchi F, Cortesini C, Bechi P, Fantappiè O, Messerini L, Vannacci A, Sardi I, Baroni G, Boddi V, Mazzanti R. Up-regulation of cyclooxygenase 2 gene expression correlates with tumor angiogenesis in human colorectal cancer. Gastroenterology. 2001;121:1339-1347. [PubMed] [DOI] |
| 18. | Stoehlmacher J, Lenz HJ. Cyclooxygenase-2 inhibitors in colorectal cancer. Semin Oncol. 2003;30:10-16. [PubMed] [DOI] |
| 19. | Howe LR, Dannenberg AJ. A role for cyclooxygenase-2 inhibitors in the prevention and treatment of cancer. Semin Oncol. 2002;29:111-119. [PubMed] [DOI] |
| 20. | Reddy BS, Rao CV. Novel approaches for colon cancer prevention by cyclooxygenase-2 inhibitors. J Environ Pathol Toxicol Oncol. 2002;21:155-164. [PubMed] [DOI] |
| 21. | Saha D, Roman C, Beauchamp RD. New strategies for colorectal cancer prevention and treatment. World J Surg. 2002;26:762-766. [PubMed] [DOI] |
| 22. | Patrignani P. Nonsteroidal anti-inflammatory drugs, COX-2 and colorectal cancer. Toxicol Lett. 2000;112-113:493-498. [PubMed] [DOI] |
| 23. | Crane CH, Janjan NA, Mason K, Milas L. Preoperative chemoradiation for locally advanced rectal cancer: emerging treatment strategies. Oncology (Williston Park). 2002;16:39-44. [PubMed] |
| 24. | Wall NR, O'Connor DS, Plescia J, Pommier Y, Altieri DC. Suppression of survivin phosphorylation on Thr34 by flavopiridol enhances tumor cell apoptosis. Cancer Res. 2003;63:230-235. [PubMed] |
| 25. | Tamm I, Wang Y, Sausville E, Scudiero DA, Vigna N, Oltersdorf T, Reed JC. IAP-family protein survivin inhibits caspase activity and apoptosis induced by Fas (CD95), Bax, caspases, and anticancer drugs. Cancer Res. 1998;58:5315-5320. [PubMed] |
| 26. | Sun Y, Tang XM, Half E, Kuo MT, Sinicrope FA. Cyclooxygenase-2 overexpression reduces apoptotic susceptibility by inhibiting the cytochrome c-dependent apoptotic pathway in human colon cancer cells. Cancer Res. 2002;62:6323-6328. [PubMed] |
| 27. | Li M, Wu X, Xu XC. Induction of apoptosis in colon cancer cells by cyclooxygenase-2 inhibitor NS398 through a cytochrome c-dependent pathway. Clin Cancer Res. 2001;7:1010-1016. [PubMed] |
| 28. | Lin LJ, Zheng CQ, Jin Y, Ma Y, Jiang WG, Ma T. Expression of survivin protein in human colorectal carcinogenesis. World J Gastroenterol. 2003;9:974-977. [PubMed] [DOI] |
| 29. | Yu J, Leung WK, Ebert MP, Ng EK, Go MY, Wang HB, Chung SC, Malfertheiner P, Sung JJ. Increased expression of survivin in gastric cancer patients and in first degree relatives. Br J Cancer. 2002;87:91-97. [PubMed] [DOI] |
| 30. | Yoshimoto T, Takahashi Y, Kinoshita T, Sakashita T, Inoue H, Tanabe T. Growth stimulation and epidermal growth factor receptor induction in cyclooxygenase-overexpressing human colon carcinoma cells. Adv Exp Med Biol. 2002;507:403-407. [PubMed] [DOI] |