修回日期: 2003-12-09
接受日期: 2004-01-08
在线出版日期: 2004-05-15
目的: 探讨硒蛋氨酸对食管癌细胞系EC9706增生的影响.
方法: 通过MTT比色法、细胞生长曲线描绘研究硒蛋氨酸对食管癌细胞系EC9706增生的影响, 采用流式细胞仪观察硒蛋氨酸诱导EC9706细胞凋亡的作用及对细胞周期的影响.
结果: 硒蛋氨酸呈时间、剂量依赖性方式抑制EC9706细胞增生, 改变细胞周期分布, 增加G0/G1期细胞比例, 诱导细胞凋亡.
结论: 硒蛋氨酸可能通过影响细胞周期分布和诱导细胞凋亡, 来抑制EC9706细胞增生.硒蛋氨酸可能是预防和治疗食管癌的一种新方法.
引文著录: 陈滋华, 吴清明, 谢国建, 王晓虎, 于皆平. 硒蛋氨酸对食管癌细胞株增生的影响. 世界华人消化杂志 2004; 12(5): 1215-1217
Revised: December 9, 2003
Accepted: January 8, 2004
Published online: May 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(5): 1215-1217
- URL: https://www.wjgnet.com/1009-3079/full/v12/i5/1215.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i5.1215
食管癌在我国是常见病, 严重威胁着人类的生命健康, 其发生、发展涉及多个基因及分子水平的变化, 目前无论是传统手术还是化疗及放疗都未能取得满意的疗效[1-13]. 因此, 有必要寻找新的防治方法. 大量流行病学和临床研究发现, 微量元素硒与肿瘤的发生呈负相关性.硒是人体所必需的微量元素, 在生命过程中发挥着重要作用, 本研究的目的在于观察硒蛋氨酸对体外培养食管癌细胞系EC9706生长的影响, 为探讨其对食管癌防治作用提供理论依据.
主要试剂: RPMI-1640培养基, 小牛血清, 胰蛋白酶、蛋氨酸为Gibco公司产品; MTT、DMSO、硒蛋氨酸(selenomethionine)为sigma公司产品. 仪器设备: 恒温CO2培养箱(SanyD日本), 倒置显微镜(OlympusIX-70)、酶联免疫检测仪(Σ960 美国), 流式细胞仪(Epics XL, Beckman coulter公司). 细胞系: 人食管癌细胞系EC9706由中国医学科学院王明荣教授惠赠.
1.2.1 细胞培养: 食管癌细胞EC9706常规培养于含10%小牛血清、100 U/mL青霉素及100 U/mL链霉素的RPMI-1640培养基中, 置于37 ℃ 5% CO2培养箱内培养.
1.2.2 硒蛋氨酸对食管癌细胞EC9706生长的影响: 取对数生长期的食管癌细胞EC9706按每孔1×104个细胞/mL接种于96孔培养板中, 24 h后换液, 加入不同浓度硒蛋氨酸100、200、300、400、500 mmoL/mL设不接种细胞的空白对照组和只加入等体积溶剂DMSO的对照组. 每组浓度每个时间点设8个复孔, 继续培养, 于第24、48、72、96 h每孔加入MTT溶液(5 mg/mL)10 mL, 37 ℃孵育4 h后弃去上清液, 每孔加入100 mL DMSO, 轻轻振荡10 min, 使结晶物充分溶解, 在490 nm波长酶联免疫检测仪上测定各孔光吸收值(A值), 求其平均值, 对照组细胞存活率记为100%, 实验组按下列公式计算细胞存活率: 细胞存活率 = 实验组A值/对照组A值×100%.
1.2.3 流式细胞仪检测细胞周期分布及凋亡情况: 根据MTT法测出的最佳药物浓度处理食管癌细胞EC9706, 取96 h后实验组、空白对照组及阴性对照组细胞用PBS洗涤后, 加入700 mL/L冷乙醇固定, 离心后PI染液(PI 5 mg、Rnase 2 mg、TritmX-100 1.0%, 生理盐水65 mL, 枸橼酸钠0.1 g, 加蒸馏水至100 mL) 4 ℃染色30 min, 用流式细胞仪检测.选用488 nm激发波长测定样品.
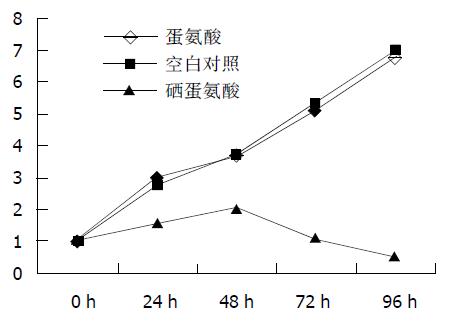
1.2.4 细胞生长曲线: 把细胞按1×104个/孔分别接种在24孔培养板中, 待细胞分别长到40-50%融合时, 按一定的MOI感染食管癌细胞EC9706, 定期消化收集细胞, 每个时间点设3个平行组, 计数取平均值及标准差, 连续计数4 d, 对照组包括加蛋氨酸阴性对照组和不加药物空白对照组.
统计学处理 所有数值均以mean±SD 表示, 采用SPSS10.0统计分析软件进行t检验.
各组浓度硒蛋氨酸对食管癌细胞EC9706的增生有较强的抑制作用, 与空白对照组比较差异显著(P<0.01), 且呈现一定的浓度、时间依赖性, 结果见(表1). 当硒蛋氨酸浓度为400 mmol/mL处理食管癌细胞96 h, 对癌细胞增生的抑制作用最明显, 所以以下实验均以此作用浓度进行.
| 组项 | 剂量 (mmoL/mL) | n | 24 h | 48 h | 72 h | 96 h |
| 空白对照组 | 8 | 0.812±0.124 | 0.843±0.154 | 0.855±0.186 | 0.886±0.135 | |
| 硒蛋氨酸组 | 100 | 8 | 0.725±0.173 | 0.662±0.165 | 0.605±0.132 | 0.585±0.118 |
| 200 | 8 | 0.683±0.112 | 0.627±0.101 | 0.558±0.148 | 0.455±0.113 | |
| 300 | 8 | 0.598±0.179 | 0.503±0.128 | 0.406±0.134 | 0.351±0.116 | |
| 400 | 8 | 0.467±0.148 | 0.382±0.136 | 0.302±0.111 | 0.157±0.100 | |
| 500 | 8 | 0.465±0.114 | 0.390±0.132 | 0.314±0.125 | 0.160±0.118 |
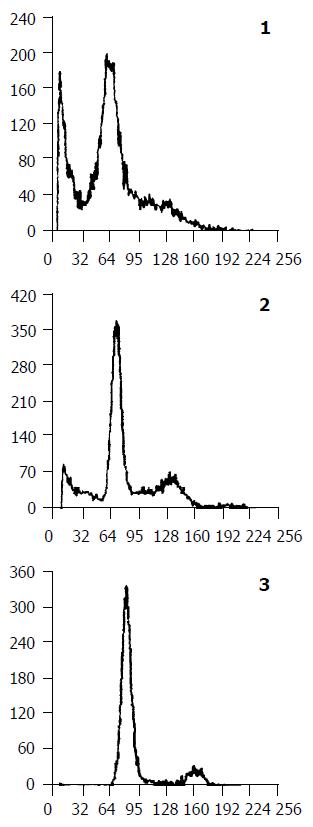
食管癌细胞EC9706经400 mmol/mL硒蛋氨酸处理96 h后行流式细胞仪分析, 在G1期前出现一个二倍体峰, G2/M期细胞减少.400 mmol/mL硒蛋氨酸致食管癌细胞凋亡百分率为52.3%, 与空白对照组及阴性对照组相比有非常显著差异(P<0.01)(见图1).
硒是人体所必需的微量元素, 在生命活动过程中发挥着重要作用. 大量流行病学和临床研究发现, 微量元素硒与肿瘤的发生呈负相关. 在中国河南林县, 对大量食管鳞状细胞癌和胃贲门腺癌患者做微量元素硒测定, 发现其血清硒水平明显低于正常人[14]. 在美国, 科学家在硒缺乏地区, 补充硒化干酵母酶, 经追踪观察, 整个硒缺乏地区恶性肿瘤发生率明显减低.有实验研究证实硒蛋氨酸对前列腺癌、肺癌、肝癌、乳腺癌、结肠癌等癌细胞均有生长抑制作用[15-23].
本实验研究证实, 硒蛋氨酸对食管癌细胞系EC9706的生长有明显抑制作用, 其有一定时间、浓度的依赖性, 随浓度的增加、时间的延长, EC9706的生长明显受到抑制. MTT法测定显示各组浓度硒蛋氨酸对食管癌细胞系EC9706增生均有较强的抑制作用, 最大抑制率可达82.3%, 与空白对照组有显著性差异(P<0.01), 与细胞生长曲线基本一致. 流式细胞仪检测发现, EC9706细胞经硒蛋氨酸400 mmol/mL处理96 h后在G1期前出现一个亚二倍体高峰, 硒蛋氨酸可诱导EC706细胞发生凋亡, 凋亡率为52.3%, 与对照组比有显著性差异.
总之, 我们认为硒蛋氨酸对食管癌EC9706细胞增生的抑制作用可能机制之一在于改变细胞周期分布, 增加G0/G1期细胞比例, 诱发细胞凋亡.由于细胞凋亡是一个多阶段、多系统参与极其复杂的过程, 本实验仅探讨了硒蛋氨酸对食管癌细胞系EC9706生长抑制及诱导凋亡的作用, 其具体作用机制还有待进一步研究. 本实验及国外大量研究证实硒蛋氨酸对恶性肿瘤的细胞生长有抑制作用; 在硒缺乏地区补充硒可减少整个恶性肿瘤的发生. 硒蛋氨酸作为硒的载体, 在许多动植物体内存在, 容易获取, 与其他硒化物相比, 毒性小, 相对安全[24]. 在硒缺乏地区补充硒预防肿瘤发生或把硒及其化合物用作治疗肿瘤的一种新手段, 其前景非常广阔.
| 1. | Zhang LJ, Chen KN, Xu GW, Xing HP, Shi XT. Congenital expression of mdr-1 gene in tissues of carcinoma and its relation with pathomorphology and prognosis. World J Gastroenterol. 1999;5:53-56. [PubMed] [DOI] |
| 2. | Wang LD, Zhou Q, Wei JP, Yang WC, Zhao X, Wang LX, Zou JX, Gao SS, Li YX, Yang C. Apoptosis and its relationship with cell proliferation, p53, Waf1p21, bcl-2 and c-myc in esophageal carcinogenesis studied with a high-risk population in northern China. World J Gastroenterol. 1998;4:287-293. [PubMed] [DOI] |
| 3. | Lin J, Deng CS, Sun J, Zhou Y, Xiong P, Wang YP. Study on the genetic susceptibility of HLA-DQB1 alleles in esopheal cancer of Hubei Chinese Hans. Shijie Huaren Xiaohua Zazhi. 2000;8:965-968. |
| 4. | Liu J, Chen SL, Zhang W, Su Q. P21WAF1 gene expression with p53 mutation in esopheal carcinoma. Shijie Huaren Xiaohua Zazhi. 2000;8:1350-1353. |
| 5. | Gu HP, Shang PZ, Su H, Li ZG. Association of CD15 antigenexpression with cathepsin D in esopheal carcinoma tissues. Shijie Huaren Xiaohua Zazhi. 2000;8:259-261. |
| 6. | Qin HY, Shu Q, Wang D, Ma QF. Study on genetic polymorphisms of DCC gene VNTR in esopheal cancer. Shijie Huaren Xiaohua Zazhi. 2000;8:782-785. |
| 7. | Wu QM, Li SB, Wang Q, Wang DH, Li XB, Liu CZ. The expression of COX-2 in esopheal carcinoma and its relation to clinicopathologic characteristics. Shijie Huaren Xiaohua Zazhi. 2001;9:11-14. |
| 8. | Tan LJ, Jiang W, Zhang N, Zhang XR, Qiu DH. Fas/FasL expression of esopheal squamous cell carcinoma, dysplasia tissues and normal mucosa. Shijie Huaren Xiaohua Zazhi. 2001;9:15-19. |
| 9. | Hao MW, Liang YR, Liu YF, Liu L, Wu MY, Yang HX. Transcription factor EGR-1 inhibits growth of hepatocellular carcinoma and esophageal carcinoma cell lines. World J Gastroenterol. 2002;8:203-207. [PubMed] |
| 10. | Xu M, Jin YL, Fu J, Huang H, Chen SZ, Qu P, Tian HM, Liu ZY, Zhang W. The abnormal expression of retinoic acid receptor-beta, p 53 and Ki67 protein in normal, premalignant and malignant esophageal tissues. World J Gastroenterol. 2002;8:200-202. [PubMed] |
| 11. | Wang AH, Sun CS, Li LS, Huang JY, Chen QS. Relationship of tobacco smoking CYP1A1 GSTM1 gene polymorphism and esophageal cancer in Xi'an. World J Gastroenterol. 2002;8:49-53. [PubMed] [DOI] |
| 13. | 李 胜保, 吴 清明, 王 强, 王 小虎, 谢 国建. 腺病毒介导的cox-2反义RNA对食管癌细胞株DNA和蛋白质合成的影响. 世界华人消化病杂志. 2003;11:517-521. [DOI] |
| 14. | Schrauzer GN. Nutritional selenium supplements: product types, quality, and safety. J Am Coll Nutr. 2001;20:1-4. [PubMed] [DOI] |
| 15. | Miki K, Xu M, Gupta A, Ba Y, Tan Y, Al-Refaie W, Bouvet M, Makuuchi M, Moossa AR, Hoffman RM. Methioninase cancer gene therapy with selenomethionine as suicide prodrug substrate. Cancer Res. 2001;61:6805-6810. [PubMed] |
| 16. | Seo YR, Kelley MR, Smith ML. Selenomethionine regulation of p53 by a ref1-dependent redox mechanism. Proc Natl Acad Sci USA. 2002;99:14548-14553. [PubMed] [DOI] |
| 17. | Menter DG, Sabichi AL, Lippman SM. Selenium effects on prostate cell growth. Cancer Epidemiol Biomarkers Prev. 2000;9:1171-1182. [PubMed] |
| 18. | Baines A, Taylor-Parker M, Goulet AC, Renaud C, Gerner EW, Nelson MA. Selenomethionine inhibits growth and suppresses cyclooxygenase-2 (COX-2) protein expression in human colon cancer cell lines. Cancer Biol Ther. 2002;1:370-374. [PubMed] [DOI] |
| 19. | Chigbrow M, Nelson M. Inhibition of mitotic cyclin B and cdc2 kinase activity by selenomethionine in synchronized colon cancer cells. Anticancer Drugs. 2001;12:43-50. [PubMed] [DOI] |
| 20. | Yamamoto N, Gupta A, Xu M, Miki K, Tsujimoto Y, Tsuchiya H, Tomita K, Moossa AR, Hoffman RM. Methioninase gene therapy with selenomethionine induces apoptosis in bcl-2-overproducing lung cancer cells. Cancer Gene Ther. 2003;10:445-450. [PubMed] [DOI] |
| 21. | Redman C, Scott JA, Baines AT, Basye JL, Clark LC, Calley C, Roe D, Payne CM, Nelson MA. Inhibitory effect of selenomethionine on the growth of three selected human tumor cell lines. Cancer Lett. 1998;125:103-110. [PubMed] [DOI] |
| 22. | Redman C, Xu MJ, Peng YM, Scott JA, Payne C, Clark LC, Nelson MA. Involvement of polyamines in selenomethionine induced apoptosis and mitotic alterations in human tumor cells. Carcinogenesis. 1997;18:1195-1202. [PubMed] [DOI] |
| 23. | Duffield-Lillico AJ, Slate EH, Reid ME, Turnbull BW, Wilkins PA, Combs GF Jr, Park HK, Gross EG, Graham GF, Stratton MS, Marshall JR, Clark LC; Nutritional Prevention of Cancer Study Group. Selenium supplementation and secondary prevention of nonmelanoma skin cancer in a randomized trial. J Natl Cancer Inst. 2003;95:1477-1481. [PubMed] [DOI] |
| 24. | Mark SD, Qiao YL, Dawsey SM, Wu YP, Katki H, Gunter EW, Fraumeni JF Jr, Blot WJ, Dong ZW, Taylor PR. Prospective study of serum selenium levels and incident esophageal and gastric cancers. J Natl Cancer Inst. 2000;92:1753-1763. [PubMed] [DOI] |