修回日期: 2004-01-01
接受日期: 2004-01-12
在线出版日期: 2004-05-15
目的: 观察上消化道黏膜下肿瘤(SMT)的动态变化.
方法: 对32例初次EUS诊断为SMT的患者进行EUS随访观察.
结果: 90.1% (29/32)复查EUS与初次诊断一致, 间质瘤95.5% (21/22)与初次诊断相吻合. 21例2次EUS均诊断为间质瘤的患者中, 33.3%第2次EUS显示的生长方式有变化; 47.6% 2次EUS显示的形态不同; 57.1% (12/21)2次EUS大小有差异, 其中第2次EUS较首次增大者占66.7%(8/12), 其直径在随访间期9 mo内平均增长3.5(2-7 mm).
结论: EUS诊断上消化道SMT的准确性很高, 定期随访复查EUS, 对尽早确诊SCT并判断其良恶性, 选择合理治疗策略是必要的.
引文著录: 程斌, 金震东, 邹晓平, 李兆申, 许国铭. 上消化道黏膜下肿瘤的内镜超声随访研究. 世界华人消化杂志 2004; 12(5): 1155-1158
Revised: January 1, 2004
Accepted: January 12, 2004
Published online: May 15, 2004
AIM: To observe the alteration of upper gastrointestinal submucosal tumor (SMT).
METHODS: The first diagnostic SMT patients (n = 32) were observed with endoscopic ultrasonography (EUS) and followed-up.
RESULTS: The second and the first EUS findings coincided in 90.1% of cases (29/32), 95.5% (21/22) of the SCT diagnoses were identical to the first EUS. In 21 SCT cases, which diagnosed with EUS in both times, 33.3% showed the alteration of growth type in the second time, and 47.6% showed difference between both EUS-examinations; 57.1% (12/21) of the double EUS showed different tumor size, 66.7% (8/12) of which ones were greater than the first EUS. The diameter was increased 3.5 (2-7) mm in a 9-month follow-up term.
CONCLUSION: EUS is very accurate for the diagnosis of upper gastrointestinal SMT, and long time follow-up with EUS is necessary to distinguish the benign from malignancy of SMT and to guide the therapeutic approach.
- Citation: Cheng B, Jin ZD, Zou XP, Li ZS, Xu GM. Endoscopic ultrasonography follow-up in patients with upper gastrointestinal submucosal tumours. Shijie Huaren Xiaohua Zazhi 2004; 12(5): 1155-1158
- URL: https://www.wjgnet.com/1009-3079/full/v12/i5/1155.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i5.1155
上消化道黏膜下肿瘤(submucosal tumor, SMT)并不少见, 常见的SMT包括间质瘤、脂肪瘤、息肉、异位胰腺和颗粒细胞瘤等[1-2]. 内镜超声检查术(endoscopic ultrasonography, EUS)的问世极大地提高了SMT的诊断水平[3-7]. 间质瘤(stromal cell tumor, SCT)是上消化道最常见的SMT, 其中一部分为恶性或具有潜在恶性[8-10]. 对上消化道SCT是行根治性手术治疗拟或内镜下摘除, 还是定期随访观察, 目前尚无定论[11-12]. 为此, 我们采用EUS对上消化道SMT患者, 尤其是SCT进行了随访观察, 以了解其自然特性的变化.
1998-11/2003-06, 我们对32例初次EUS诊断为SMT的患者进行了EUS随访观察, 中位数EUS随访间期为9.5 (3-32 mo).其中, 男14例, 女18例. 平均年龄54.5(30-76 岁). 32例SMT中位于食管9例(上段1例, 中段4例, 下段4例), 胃19例(贲门3例, 胃底5例, 胃体7例, 胃窦4例), 十二指肠4例(均于球部). 初次EUS显示最大直径达42 mm, 最小为4 mm. 其中, 仅1例行手术治疗, 2例行内镜活检.
我们共对32例初次EUS拟诊为SMT的患者在3-32 mo后进行了EUS随访观察, 包括间质瘤22例, 脂肪瘤5例, Brunner腺瘤1例和息肉4例. 第2次复查EUS的结果90.1% (29/32)与初次诊断一致. 其中, 22例间质瘤中21例(95. 5%)仍诊断为间质瘤, 仅1例诊断为脂肪瘤; 5例脂肪瘤中有3例(60%)仍诊断为脂肪瘤, 1例诊断为间质瘤, 1例诊断为壁外压迫(脾血管);而4例息肉和1例Brunner腺瘤均和初次诊断一致(表1). 2次EUS检查任意一次诊断为间质瘤的23例患者中, 判断起源有差异者3例, 其中1例胃间质瘤初次判断起源于第2层(黏膜肌层), 第2次则判断为第4层(固有肌层); 另2例2次分别判断为第3层(黏膜下层)和固有肌层. 2次判断回声不同的有2例, 1例初次判定为低回声者, 第2次判断为高回声; 1例相反, 初次判定为高回声者, 第2次却判断为低回声. 这2例起源和回声判断的差异直接导致了最后EUS诊断的颠倒. 2例内镜活检标本中1例病理证实为息肉, 1例EUS显示为SCT者病理未获阳性结果.
| 病变部位 | 首次 | 第2次 |
| 食管间质瘤 | 8 | 8 |
| 息肉 | 1 | 1 |
| 胃间质瘤 | 13 | 13 (1*) |
| 脂肪瘤 | 4 | 3 |
| 息肉 | 2 | 2 |
| 壁外压迫 | 0 | 1 |
| 十二指肠间质瘤 | 1 | 1 |
| 脂肪瘤 | 1 | 1 |
| 息肉 | 1 | 1 (1*) |
| Brunner腺瘤 | 1 | 1 |
| 合计 | 32 | 32 |
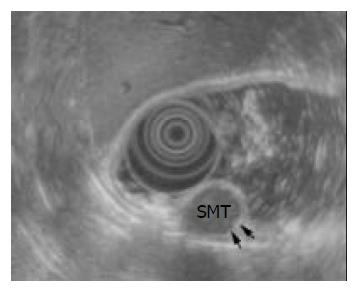
EUS可显示上消化道SMT的形态、大小和生长方式等生物学特征. 如间质瘤多呈椭圆形或梭形, 也可为圆形或亚铃形; 根据EUS显示的肿瘤与管壁的关系可将其生长方式分为腔内型、壁内型、腔外型和腔内外型(混合型). 本组21例2次EUS检查均诊断为间质瘤的患者中, EUS形态发生变化的有10例(47.6%); 生长方式不同的有7例(33.3%, 图1, 2); 以2次测量最大直径相差2mm以上算作大小有差异, 其大小有差异者占12例(57.1%), 其中第2次EUS检查较首次增大者占66.7%(8/12), 其直径在中位数随访间期为9(3-18 mo)内平均增加3.5(2-7 mm), 其中1例在6 mo内从42 mm增长到47 mm而行手术治疗, 病理证实为低度恶性间质瘤(图3, 4). 在任意一次EUS诊断为脂肪瘤的6例患者中, 3例起源判断有差异, 1例初次判断为起源于黏膜下层, 第2次判断为壁外压迫; 另2例则2次分别判断为黏膜下层和固有肌层. 2例回声判断不同者, 2次分别相反地判断为高回声和低回声. 此外, 其EUS形态判断有差异者为3例, 生长方式判断有差异者1例, 而6例病灶大小判断则基本相同. 4例息肉和1例Brunner腺瘤患者2次EUS检查其起源、回声、EUS形态、生长方式和大小的判断均无差异(表2).
| 诊断 | n | 起源差异 | 回声差异 | EUS形态差异 | 生长方式差异 | 大小差异 | EUS诊断差异 |
| 间质瘤 | 23(21)* | 3 | 2 | 11 | 8 | 12 | 2 |
| 脂肪瘤 | 6 (3)* | 3 | 2 | 3 | 1 | 0 | 3 |
| 息肉 | 4 | 0 | 0 | 0 | 0 | 0 | |
| Brunner腺瘤 | 1 0 | 0 | 0 | 0 | 0 | 0 | |
| 壁外压迫 | 1(0)* | 1 | 0 | 0 | 0 | 0 | 1 |
在4例2次EUS判断病变起源、回声及诊断有差异的患者中, 3例(75%) 2次EUS检查由2名不同的操作者完成. 2例(50%)2次分别采用超声内镜和超声微探头检查. 而在28例2次EUS检查相同的患者中, 35.7%(10/28)是由2名不同的操作者完成2次检查, 28.6%(8/28)2次分别采用超声内镜和超声微探头检查.
上消化道黏膜下肿瘤是源于黏膜下或肌层内组织的一类肿瘤, 以胃多见. 以往根据其病理特性分为良性或恶性非上皮性肿瘤(如平滑肌源性肿瘤和脂肪瘤等)、良性上皮性肿瘤以及炎症性肿瘤(如息肉)[16-18]. 近来随着免疫组织化学和电镜的研究应用, 临床和病理工作者逐渐加深了对胃肠道间叶源性肿瘤的认识, 发现间质瘤和平滑肌肿瘤的生物学特征和预后并不相同. 上消化道SCT是最常见的一种SMT, 与传统的"平滑肌瘤(leiomyomas, LM)"、"平滑肌肉瘤(leiomyosarcomas, LMS)"不同, 具有c-kit(CD117)基因突变与蛋白表达等特征性改变和一些特殊的形态学特征[19-20]. 很多研究显示, 在胃和十二指肠以SCTs为多见, 而真正的平滑肌肿瘤(LM与LMS)则相对少见[12,21], 在食管则仍以平滑肌瘤多见[22]. 而SCT中相当一部分为中、低度恶性或具有潜在恶性, 本组病例中1例手术标本经病理和免疫组化证实为低度恶性间质瘤, 故临床上必须与其他SMT进行鉴别.
无论是食管、胃还是十二指肠, EUS均能显示消化道管壁的层次结构及壁外情况, 根据其显示管壁层次结构的完整性、病灶的起源及大小、回声、形态和边缘等声像学特征, EUS对SMT和壁外压迫可作出相当准确的判断. 通常间质瘤为低回声病灶, 呈椭圆形或梭形, 起源于固有肌层, 偶而起源于黏膜肌层. 病灶一般边界清楚, 内部回声均匀; 脂肪瘤则为高回声病灶, 起源于黏膜下层; 息肉为起源于黏膜层的稍高回声病灶; 黏膜下囊肿的EUS表现为黏膜下层内境界清楚、边缘光滑的无回声区, 透声性好, 其后方可见增强效应; 十二指肠Brunner腺瘤的EUS特征为起源于第1-3层的囊实性病变, 囊壁厚而不规则; 而壁外病变的共同声像图特征为消化道管壁的层次结构完整[23-24]. 本组病例第二次复查EUS, 90.1%(29/32)与初次诊断一致, 而间质瘤更是95.5%(21/22)与初次诊断相吻合. 可见, EUS通过显示相应的EUS声像特征, 可很准确、相当恒定地判断上消化道SMT. 本组病例中4例息肉和1例十二指肠Brunner腺瘤患者从病灶起源、大小、回声、形态到EUS诊断前后两次结果完全一致, 一方面说明息肉和Brunner腺瘤的EUS声像学特征稳定, EUS诊断准确性极高, 另一方面也反映这两种良性SMT病变的生物学特征相对稳定. 当然还有待于扩大样本量, 延长随访时间进一步观察. 而23例2次EUS检查任意一次诊断为间质瘤的患者中, 2例因其起源和回声判断的不同直接导致了2次EUS诊断的差异, 还有1例2次EUS检查层次判断出现差异. 而2次EUS检查任意一次EUS诊断为脂肪瘤的6例患者中, 除2例2次EUS检查在病灶起源、回声及EUS诊断上与间质瘤出现混淆外, 还有1例第2次EUS诊断为壁外压迫. 这表明, 尽管理论上间质瘤与脂肪瘤在起源层次、EUS回声特征上存在明显差异, 但实际工作中, 由于EUS扫描成像的不稳定及判断EUS声像图特征的主观性, 导致在二者相互间甚至与息肉、壁内囊肿和壁外压迫等隆起性病变鉴别时仍可能出现误判. 本组2次EUS出现判断差异的4例患者中3例(75%)由两名不同的操作者所检查. 因此, 规范、正确EUS操作手法对准确的显示和判断病变至关重要, 如调整适当的探头位置及其与病灶间的距离、水囊的大小和调节合适的灰度、对比度等均有利于正确地显示病变, 以利正确判断. 此外, 引入EUS声像图纹理分析技术可望为经验性判断找到理论依据, 避免受操作者主观因素的影响[25]. 当然, 同一种SMT病变在不同患者间因病变大小、病理类型等不同其EUS回声也可能存在差异. 对这种不符合一般规律, 一次EUS检查难以作出肯定判断, 甚至2次EUS检查结果存在差异者进行EUS随访观察, 拟或行EUS引导的细针针吸活检(EUS guided fine needle aspiration, EUS-FNA)是必要的.
EUS诊断上消化道SCT是基于其在扫描图像上显示为起自固有肌层或黏膜肌层的低回声病灶. 本组21例2次EUS均诊断为间质瘤的患者中, 47.6% 2次EUS形态不同; 33.3% 2次EUS显示的生长方式不同; 尤其引人注意的是, 57.1% 2次EUS大小有差异, 其中第2次EUS检查较首次增大者占66.7% (8/12), 其直径在随访间期9 mo内平均增长3.5(2-7 mm). 而脂肪瘤、息肉和Brunner腺瘤两次EUS检查其形态、大小与生长方式均基本一致. 这提示上消化道SCT的生物学行为存在不稳定性, 其本身存在低度恶性, 或具有潜在恶性. 定期动态的EUS随访观察对发现具有恶性潜能的SCT及其变化极有帮助, 这与国内外有些通过一定的EUS声像学特征来判断SCT良恶性的报道是一致的. 如Okai et al[26]采用EUS对间质瘤的观察发现, 恶性GIST肿瘤的倍增时间为9.3 mo, 良性GIST的倍增时间则可达18.7 mo, 认为肿瘤分叶和较短的倍增时间是恶性SCT的特征. Chak et al[27]采用逐步回归分析法观察分析了35例经手术切除的上消化道SCT 的EUS声像学特征与其良恶性的相关关系, 发现肿瘤大于4 cm、边缘不规则、内部回声不均和液性暗区的存在与其恶性状况显著相关. 如以边缘不规则、内部回声不均和液性暗区这三项声像学特征中出现两项来判断恶性SCT, 其敏感性可达80-90%. 台湾Tsai et al[28]也对52例经组织学证实的胃SCT的EUS声像特征与其良恶性间的关系进行了观察. 结果表明, 病灶边缘不规则和内有液性暗区对恶性胃SCT的诊断具有更好的敏感性与特异性. 病灶小于5 cm且边缘规则、内部无液性暗区存在者则多为良性病变. 国内金震东et al[25] 也采用超声图像纹理分析技术观察研究了胃SMT的EUS声像图纹理特征, 发现纹理参数的测定也有助于提高EUS对SMT性质判断的准确性.
SCT组织分化复杂, 形态多样, 组织学诊断仍是金标准. 很多研究业已证明, 术前EUS-FNA活检标本的组织细胞学及特异的免疫组化检查可更精确地诊断SCT并判断其良恶性[29]. 不过, 上消化道SCT具有不稳定的生物学特征, 即使组织病理学诊断为良性SCT也可能只是暂时性的. 对其严格的随访追踪仍是最好的保证. 本组资料虽然样本量不大, 但EUS也已初步显示了上消化道SCT在随访中其大小、形态和生长方式等生物学特征的变化. 因此, 定期复查EUS并仔细观察其大小和形态变化、边缘规则性及内部有无液性暗区存在等声像学特征, 对尽早确诊SCT并判断其良恶性有极其重要的价值.
| 1. | Kojima T, Takahashi H, Parra-Blanco A, Kohsen K, Fujita R. Diagnosis of submucosal tumor of the upper GI tract by endoscopic resection. Gastrointest Endosc. 1999;50:516-522. [PubMed] [DOI] |
| 6. | Sun S, Wang M, Sun S. Use of endoscopic ultrasound-guided injection in endoscopic resection of solid submucosal tumors. Endoscopy. 2002;34:82-85. [PubMed] [DOI] |
| 7. | Xu GQ, Zhang BL, Li YM, Chen LH, Ji F, Chen WX, Cai SP. Diagnostic value of endoscopic ultrasonography for gastrointestinal leiomyoma. World J Gastroenterol. 2003;9:2088-2091. [PubMed] [DOI] |
| 8. | Emory TS, Sobin LH, Lukes L, Lee DH, O'Leary TJ. Prognosis of gastrointestinal smooth-muscle (stromal) tumors: dependence on anatomic site. Am J Surg Pathol. 1999;23:82-87. [PubMed] [DOI] |
| 9. | Ballarini C, Intra M, Ceretti AP, Prestipino F, Bianchi FM, Sparacio F, Berti E, Perrone S, Silva F. Gastrointestinal stromal tumors: a "benign" tumor with hepatic metastasis after 11 years. Tumori. 1998;84:78-81. [PubMed] |
| 10. | Yu CC, Fletcher CD, Newman PL, Goodlad JR, Burton JC, Levison DA. A comparison of proliferating cell nuclear antigen (PCNA) immunostaining, nucleolar organizer region (AgNOR) staining, and histological grading in gastrointestinal stromal tumours. J Pathol. 1992;166:147-152. [PubMed] [DOI] |
| 11. | Kim CJ, Day S, Yeh KA. Gastrointestinal stromal tumors: analysis of clinical and pathologic factors. Am Surg. 2001;67:135-137. [PubMed] |
| 12. | Trupiano JK, Stewart RE, Misick C, Appelman HD, Goldblum JR. Gastric stromal tumors: a clinicopathologic study of 77 cases with correlation of features with nonaggressive and aggressive clinical behaviors. Am J Surg Pathol. 2002;26:705-714. [PubMed] [DOI] |
| 13. | Buscarini E, Stasi MD, Rossi S, Silva M, Giangregorio F, Adriano Z, Buscarini L. Endosonographic diagnosis of submucosal upper gastrointestinal tract lesions and large fold gastropathies by catheter ultrasound probe. Gastrointest Endosc. 1999;49:184-191. [PubMed] [DOI] |
| 16. | Xu GM, Li ZS, Zou DW. Upper gastrointestinal submucosal tumors: EUS diagnostic and endoscopic therapy. J Med Coll PLA. 1995;10:79-82. |
| 18. | Gress F, Schmitt C, Savides T, Faigel DO, Catalano M, Wassef W, Roubein L, Nickl N, Ciaccia D, Bhutani M. Interobserver agreement for EUS in the evaluation and diagnosis of submucosal masses. Gastrointest Endosc. 2001;53:71-76. [PubMed] [DOI] |
| 19. | Hirota S, Isozaki K, Moriyama Y, Hashimoto K, Nishida T, Ishiguro S, Kawano K, Hanada M, Kurata A, Takeda M. Gain-of-function mutations of c-kit in human gastrointestinal stromal tumors. Science. 1998;279:577-580. [PubMed] [DOI] |
| 20. | Frost D, Lasota J, Miettinen M. Gastrointestinal stromal tumors and leiomyomas in the dog: a histopathologic, immunohistochemical, and molecular genetic study of 50 cases. Vet Pathol. 2003;40:42-54. [PubMed] [DOI] |
| 21. | Miettinen M, Kopczynski J, Makhlouf HR, Sarlomo-Rikala M, Gyorffy H, Burke A, Sobin LH, Lasota J. Gastrointestinal stromal tumors, intramural leiomyomas, and leiomyosarcomas in the duodenum: a clinicopathologic, immunohistochemical, and molecular genetic study of 167 cases. Am J Surg Pathol. 2003;27:625-641. [PubMed] [DOI] |
| 25. | 金 震东, 许 国铭, 李 平, 邹 多武, 周 康源. 胃黏膜下肿瘤超声内镜声像图的纹理分析价值. 中国医学影像技术杂志. 1998;14:483-485. |
| 26. | Okai T, Minamoto T, Ohtsubo K, Minato H, Kurumaya H, Oda Y, Mai M, Sawabu N. Endosonographic evaluation of c-kit-positive gastrointestinal stromal tumor. Abdom Imaging. 2003;28:301-307. [PubMed] [DOI] |
| 27. | Chak A, Canto MI, Rösch T, Dittler HJ, Hawes RH, Tio TL, Lightdale CJ, Boyce HW, Scheiman J, Carpenter SL. Endosonographic differentiation of benign and malignant stromal cell tumors. Gastrointest Endosc. 1997;45:468-473. [PubMed] [DOI] |
| 28. | Tsai TL, Changchien CS, Hu TH, Hsiaw CM, Hsieh KC. Differentiation of benign and malignant gastric stromal tumors using endoscopic ultrasonography. Chang Gung Med J. 2001;24:167-173. [PubMed] |
| 29. | Fu K, Eloubeidi MA, Jhala NC, Jhala D, Chhieng DC, Eltoum IE. Diagnosis of gastrointestinal stromal tumor by endoscopic ultrasound-guided fine needle aspiration biopsy--a potential pitfall. Ann Diagn Pathol. 2002;6:294-301. [PubMed] [DOI] |