修回日期: 2003-12-09
接受日期: 2003-12-22
在线出版日期: 2004-05-15
目的: 观察高胆固醇血症(hypercholesterolemia, HC)兔离体Oddi括约肌(sphincter of oddi, SO)张力的变化, 探讨其作用机制.
方法: 新西兰雌兔24只随机分成两组: 对照组和HC模型组各12只, 分别取两组SO制备成离体肌环, 观察SO的自主收缩运动及其对KCl和Ca2+的收缩反应, 以及对硝普钠(sodium nitroprusside, SNP)和硝苯吡啶(nifedipine, Nif)的舒张反应.
结果: HC组的自主收缩频率高于对照组(P<0.05, t = 2.86), 自主收缩波幅较对照组降低(P<0.05, t = 2.48). 以10 mmoL/L为浓度梯度累积加入KCl至90 mmoL/L, HC组对中低浓度KCl (10-40 mmoL/L)收缩反应高于对照组(P<0.01, t = 4.01); 两组最大收缩力无显著差异, 且均可被3 mmoL/L Nif完全缓解. 用60 mmoL/L KCl预收缩SO肌环后加入SNP (0.1 nmoL/L-1 mmoL/L), 在各个浓度点HC组的舒张反应均明显低于对照组(P<0.01, t = 5.12). SO肌环在无钙 Krebs液中温育5 min后复钙引起两组明显收缩反应所需的Ca2+浓度分别为0.1和1. 0 mmoL/L, HC组显著低于对照组(P<0.01, t = 4.91); 复钙2.5 mmoL/L诱发两组肌环的收缩反应均可被3 mmoL/L Nif完全缓解. 用60 mmoL/L KCl预收缩SO肌环后加入Nif, 两组对Nif(0.1 nmoL/L-3 mmoL/L)的舒张反应在各个浓度点均无明显差别. 在Krebs液中先加入3 mmoL/L Nif, 再加入KCl, CaCl2, 两组肌环均未发生收缩反应.
结论: 在离体条件下, HC可导致SO张力异常, SO处于易激惹状态, 其机制与SO细胞内钙离子浓度([Ca2+]i)过载有关, 而该过载状态与L型电压依赖性钙通道(L-type Voltage-dependent calcium channels, L-VDCs )无关.
引文著录: 张孝勇, 魏经国, 马进, 王莎, 马孝武, 马克军, 王亚蓉. 高胆固醇血症兔Oddi括约肌张力的变化机制. 世界华人消化杂志 2004; 12(5): 1114-1118
Revised: December 9, 2003
Accepted: December 22, 2003
Published online: May 15, 2004
AIM: To observe the effects of hypercholesterolemia (HC) on tension of sphincter of Oddi (SO) in rabbits and to study the mechanisms of the sphincter of Oddi dysfunction (SOD).
METHODS: Twenty-four New Zealand female rabbits were divided randomly into control group and HC group (12 rabbits each). Sphincter of Oddi muscle rings were dissociated from both groups in vitro. Automatic contractility was observed firstly. Then the contraction responses evoked by KCl and CaCl2 and relaxation responses caused by sodium nitroprusside (SNP) and nifedipine (Nif) were measured.
RESULTS: Compared with control group, the automatic contractile frequency of HC group was increased (P < 0.05), and the automatic contractile amplitude of HC group was decreased (P < 0.05). The tension of SO rings evoked by KCl at low and moderate concentrations (10-40 mmol/L) was significantly higher in HC group than in control group (P < 0.01). The maximum tension was not found difference between two groups, and both could be completely relaxed by Nif (3 mmol/L). Compared with the control group, relaxation responses of SO rings in HC group to SNP (0.1 nmoL/L-1 mmoL/L) were markedly decreased after the administration of KCl (60 mmoL/L) in HC group (P < 0.01). The minimum solution value (0.1 mmoL/L) of Ca2+ evoking contraction in HC group was evidently lower than that of the control group (1.0 mmoL/L) (P < 0.001). Tensions of SO rings evoked by Ca2+ (2.5 mmoL/L) were entirely relaxed by Nif (3 mmoL/L) both in HC group and control group. After the administration of KCl (60 mmoL/L) relaxation responses of rabbit SO rings to Nif (0.1 nmoL/L-3 mmoL/L) were not found difference between in the two groups. Nif (3 mmoL/L) could completely inhibit the contraction responses evoked by KCl or CaCl2in both groups.
CONCLUSION: Hypercholesterolemia can lead to SO dysfunction and increase the sensitivity of SO to KCl at low and moderate concentrations in vitro. The overloading of intracellular Ca2+ is an important reason for these phenomena, which has no direct relation with L-type voltage-dependent calcium channels of smooth muscle cells.
- Citation: Zhang XY, Wei JG, Ma J, Wang S, Ma XW, Ma KJ, Wang YR. Mechanisms of tension changes of the sphincter of Oddi from hypercholesterolemic rabbits. Shijie Huaren Xiaohua Zazhi 2004; 12(5): 1114-1118
- URL: https://www.wjgnet.com/1009-3079/full/v12/i5/1114.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i5.1114
胆系疾病近年来不断增多[1-5], 已成为研究热点[6-10]. 然而高胆固醇血症(HC)对胆管系统影响的研究少见. Wei et al[11]在研究HC对SO运动功能的影响中发现, 经胆固醇(cholesterol, Ch)饲养4 wk后, HC兔SO压力增高且收缩幅度下降, 舒张功能受损, 提示HC可引起SO舒缩功能异常. Wang et al[12]通过SO细胞原代培养证实, HC可致细胞内钙离子浓度([Ca2+]i)呈过载状态, 但机制尚不明确. 我们通过制备SO肌环, 用灌流法在离体条件下观察HC对兔SO肌环张力的影响, 初步探讨其发生机制.
新西兰雌兔由第四军医大学实验动物中心提供; 胆固醇(Ch)分析纯, 购自上海化学试剂公司; NaCl, KCl, NaHCO3, MgCl2, NaH2PO4, 葡萄糖, 二甲基亚砜(DMSO) 分析纯, 购自西安化学试剂厂; 硝普钠(sodium nitroprusside, SNP), 硝苯吡啶(nifidipine, Nif), EGTA, CaCl2 购自美国Sigma 公司; 张力换能器JZ-BK型, 购自中国贝科公司;台式自动平衡记录仪XWTD464型, 购自上海大华仪表厂; 电子天平ACA-100型, 购自美国Denver 公司; 解剖显微镜PM-6型, 购自日本Olympus公司. ♀新西兰兔24只, 2-3 mo, 体质量1.8-2.2 kg, 随机分为2组, 每组12只. 对照组(Control)饲以标准饲料, 实验组(HC)饲以标准饲料+Ch. 1 g/d, 每周6 d, 停喂1 d, 共8 wk. 高Ch血症模型判定标准[人类疾病的动物模型 1982: 120-129]: 兔血清总Ch浓度小于3.0 mmoL/L为正常, 大于10 mmoL/L为达到高Ch血症标准. 实验开始前将血清总Ch大于3.0 mmoL/L兔剔除.
经耳缘静脉注入约10 mL空气处死兔, 迅速分离SO段, 在解剖显微镜下小心去除SO周围脂肪与结缔组织, 取其近心段并修剪成横径为4 mm的肌环. 肌环一端藉不锈钢丝挂钩固定于肌槽底部的挂钩上, 另一端通过挂钩与肌肉张力换能器相连. 肌槽内盛37 ℃ Krebs液, 并持续充以50 mL/L CO2+ 950 mL/L O2混合气. Krebs液组成(mmoL/L): NaCl 115.0, KCl 5.9, NaHCO322.8, MgCl2 1.2, NaH2PO4 1.2, CaCl2 2.5, 葡萄糖 10.0, pH = 7.4. 另每组随机选取2例沿横轴切取宽约4 mm肌环进行光镜观察, 标本用40 g/L甲醛固定, HE染色组织学检查.
1.2.1 SO肌环反应性测定: 将肌环置于Krebs液中温育, 首先给予0.6 g初始前负荷, 在平衡的过程中, 通过旋钮不断调节张力, 使其稳定在初始前负荷水平, 每隔20 min 换1次Krebs液. 平衡60 min后以60 mmoL/L KCl为激动剂, 以0.2 g为步幅逐步提高前负荷值至其产生最大收缩反应, 此时的静息张力即为最适静息张力, 随后实验均在各肌环最适静息张力下进行. 首先记录两组的自主收缩波幅和频率, 绘制波形曲线. 收缩反应通过加入累积浓度的KCl (10-90 mmoL/L)测得, 记录不同浓度肌环的收缩反应. 舒张反应测定是先用60 mmoL/L的KCl预收缩肌环, 等收缩力平稳后, 加入累积浓度 (0.1 nmoL/L-1 mmoL/L)的SNP同时记录不同浓度下肌环的舒张反应, 用同样的方法纪录累积浓度 (0.1 nmoL/L-3 mmol/L)的Nif的舒张反应. 其舒张作用以所引起的舒张幅度占KCl预收缩幅度的百分比表示. 肌张力变化经张力换能器转换为电信号后由台式自动平衡记录仪记录. 由所得数据绘制累积浓度-效应曲线.
1.2.2 复钙对肌环收缩反应的观察: 肌环在无钙Krebs(含EGTA, 50 mmol/L)液温育的方式有2种[中国病理学与毒理学杂志1996;10(1):34-38]: (1)5 min, 完全去除细胞外Ca2+而不影响细胞内Ca2+释放; (2)1 h, 导致细胞内钙耗竭. 按第1种方式温育5 min, 换上不含EGTA的无钙Krebs液, 然后加累积浓度CaCl2(0.01-2. 5 mmoL/L), 记录两组肌环的收缩反应. 然后按第2种方式温育1 h, 按相同方法记录肌环对CaCl2的收缩反应. 实验结束后, 用滤纸吸干肌环表面水分, 用电子天平称重.
统计学处理 采用统计软件SPSS10.0进行数据的统计学分析. 实验数据以mean±SD表示, 两组间数据比较采用t检验, P<0.05为差异显著.
两组SO肌环的外径、长度、质量均无显著差异(表1). 光镜下观察各组SO平滑肌均排列规整, 未见明显的炎细胞浸润和纤维组织增生.
| 分组 | 外径 (mm) | 长度 (mm) | 重量 (mg) |
| 对照组(Control) | 1.52±0.03 | 4.23±0.07 | 2.12±0.09 |
| 实验组 (HC) | 1.48±0.04 | 4.21±0.07 | 2.13±0.08 |
将肌环置于Krebs液中平衡30 min, 待SO肌环自主收缩平稳后, HC组的SO肌环的自主收缩频率高于对照组(P<0.05), 而自主收缩波幅较对照组降低(P<0.05) (表2). 对照组自主收缩波形规则、频率稳定, 而HC组呈大小不一、宽窄不等的不规则波形(图1).
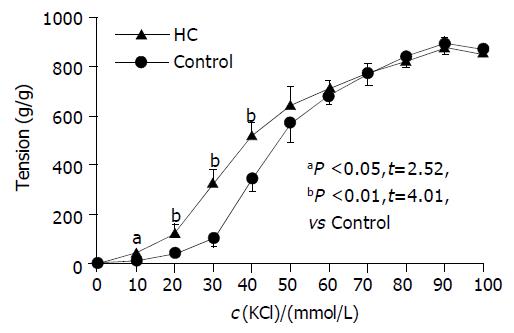
低浓度(10- 40 mmoL/L) KCl诱发HC组SO肌环的收缩力较对照组显著提高. 10 mmoL/L时HC组为40±10 g/g较对照组增加45% (P<0.05); 20 mmoL/L 时 HC组为120±30 g/g较对照组增加67% (P<0.01); 30 mmoL/L时HC组为340±60 g/g较对照组增加85% (P<0.01); 40 mmoL/L 时HC组为510±80 g/g较对照组增加57% (P<0.01); 50 mmoL/L, HC组为640±80 g/g, 与对照组无明显差异; 在60, 70, 80, 90 mmoL/L等浓度点, 两组亦无显著差异. 可见两组SO肌环对KCl最大收缩力无显著差异(图2).
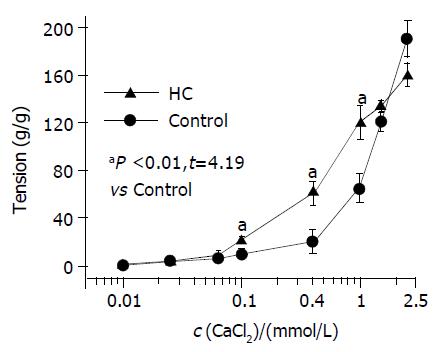
肌环在无钙Krebs液(含EGTA 50 mmol/L)温育5 min后换上不含EGTA的无钙Krebs, 从0.01 mmoL/L开始复钙, 当至0.1 mmoL/L时, 可引发HC组明显的收缩, 幅度为20.0 g/g, 而对照组未发生明显收缩反应; 复钙至0.4 mmoL/L, HC组收缩幅度为60.0±10.0 g/g, 对照组仍未见明确收缩反应; 复钙至1.0 mmoL/L, 可引发对照组幅度为65. 0±10.0 g/g的收缩反应, HC组为95. 0±20.0 g/g, HC组明显高于对照组(P<0.01); 继续复钙至2.5 mmoL/L, 两组的收缩反应差别不明显. 由此可见, 能引发HC组和对照组收缩反应对应的Ca2+浓度分别为0.1和1 mmoL/L, HC组显著低于对照组(P<0.001, 图3). 洗脱后, 两组肌环在无钙Krebs(含EGTA 50 mmoL/L)液温育1 h后换成不含EGTA的无钙Krebs, 重新复钙2.5 mmoL/L, 两组肌环均发生收缩反应, 上述收缩反应均可被3 mmoL/L Nif完全缓解.
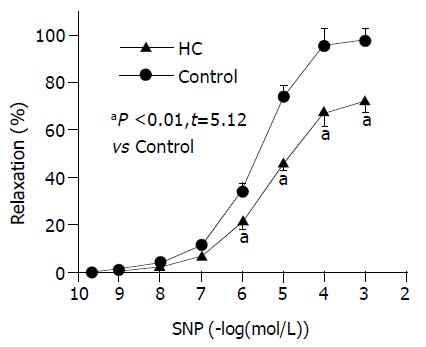
先用60 mmoL/L KCl预收缩肌环, 等收缩力平稳后, 加入累积浓度 (0.1 nmoL/L-1 mmoL/L)的SNP, 记录不同浓度下肌环舒张的百分率, 与对照组相比, HC组SO肌环对SNP的舒张反应在各浓度点明显降低. 在1mmoL/L, HC组舒张率为21.4%, 较对照组降低32.0% (P<0.01); 10 mmoL/L 时, HC组舒张率为45.9%, 较对照组降低46.0% (P<0.01); 0.1 mmoL/L 时, HC组舒张率为67.7%, 较对照组降低32.0%(P<0.01); 1 mmoL/L 时, HC组舒张率为75.2%, 较对照组降低35.0% (P<0.01, 图4). 上述结果表明HC组对SNP舒张反应在各个浓度点较对照组均下降.
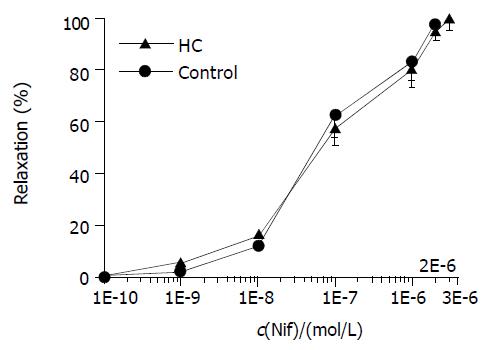
用60 mmoL/L KCl预收缩肌环, 等收缩力平稳后, 加入累积浓度 (0.1 nmoL/L-1, 2, 3 mmoL/L) 的Nif, 记录不同浓度下肌环舒张的百分率, 两组在各个浓度点对Nif的舒张反应均无明显差异, 3 mmoL/L Nif可100%舒张两组SO肌环. 反之, 在Krebs液中先加入3 mmol/L Nif, 然后分别加入60 mmoL/L KCl和2.5 mmoL/L CaCl2预刺激, 发现两组SO肌环均未发生收缩反应, 且节律性收缩运动消失. 洗脱后继续温育30 min, 待自主运动恢复正常, 加入60 mmoL/L KCl, 两组均可达到最大收缩幅度, 分别加入3 mmoL/L Nif, 两组均可完全舒张(图5).
Oddi括约肌包绕于胰胆管汇合进入十二指肠处, 是独立于十二指肠壁平滑肌、具有精细分工的肌性结构, 在神经与激素的共同作用下, 产生协调的舒缩运动, 对调节胆囊充盈、控制胆汁排出及维持胆道系统正常压力具有重要作用. 已经证实胆囊切除术后可诱发其功能紊乱, 进一步研究发现胆囊切除术前可能已经存在SO肌动力异常. 1997年Szilvassy et al[13]首次报道HC和高甘油三酯血症合并Oddi括约肌功能紊乱(sphincter of oddi dysfunction, SOD)的病例. SOD可诱发胆道疾病、胰腺疾病及胃肠道等疾病的发生[14]. HC可损害兔SO的舒张功能[15], 可能是原发性SOD的重要诱因之一. 相继的实验研究[16-18]表明HC可导致兔SO压力增高, 舒张功能受损, 提示HC可引起SO舒缩功能异常. Wei et al[19] 研究证实, HC所致的SOD的组织结构与单纯胆囊切除术后犬SOD组织结构具有惊人的一致性. 但到目前为止有关HC与SOD的关系仍有许多不明之处.
本组实验结果显示, HC组兔SO肌环自主收缩运动发生改变, 其特征为收缩波幅降低, 波形不规则, 呈大小不一、频率不等的杂乱波形, 但两组最大收缩幅度无明显差别. 进一步研究发现, 浓度为10-40 mmoL/L KCl诱发HC组SO肌环的收缩力较对照组显著提高. KCl的主要作用是破坏细胞内外电化学平衡, 使细胞膜去极化, 激活L-VDCs, 引发Ca2+内流, 提高[Ca2+]i, 触发平滑肌收缩. 在这一调节过程中, 细胞的极化状态是关键因素之一. 本组结果显示在低浓度KCl的刺激下HC组SO的反应性提高, 似可提示实验组SO细胞质膜更易发生去极化. 进一步研究表明, HC组SO肌环对平滑肌舒张剂SNP的舒张反应在各个浓度点较对照组均明显降低, 其最大舒张率也显著下降, 而组织学检查HC组SO未见纤维化改变. 上述结果证实HC可导致SO张力功能异常, 且SO肌环对激动剂的反应呈明显易激惹状态.
Theilmeier et al[20]发现HC损害了血管平滑肌的舒张功能. Fleischhacker et al[21]在观察血管平滑肌舒张功能时发现, HC确可提高血管平滑肌的反应性, 并提出其可能原因是细胞内Ca2+分布的改变所致. 由于平滑肌细胞 [Ca2+]i的动态平衡以及由此而激活钙调素(calmodulin, CaM)是调节平滑肌功能状态的重要机制之一. 已有报道[22-24]高Ch可影响[Ca2+]i的代谢, 刺激细胞内肌浆网内储钙释放, 使[Ca2+]i升高. 本组观察无钙Krebs液中复钙对SO肌环的影响, 结果证实复钙引起实验组SO肌环收缩所需加入的Ca2+浓度仅为0.1 mmoL/L, 而对照组所需Ca2+浓度为1.0 mmoL/L. 在L-VDCs功能正常的前提下, 细胞外Ca2+进入细胞内是启动及提高细胞内[Ca2+]i 升高的重要途径. 已经证实 [Ca2+]i升至1 mmoL/L是Ca2+与CaM结合激活信号转导途径使平滑肌收缩的阈浓度, 而当细胞[Ca2+]i升高到一定程度时通过膜电位改变又致L-VDCs暂时失活, [Ca2+]i 下降. 在这一调节过程中细胞外Ca2+内流是启动环节之一. 细胞外复钙可引发血管平滑肌的收缩运动, 其机制与细胞外Ca2+通过L-VDCs流入到细胞内, 引起细胞[Ca2+]i升高有关. 何令帅et al[25]也报道复钙可使细胞外Ca2+内流, 通过升高细胞[Ca2+]i直接引发平滑肌收缩. 本组实验显示, 低浓度的细胞外Ca2+即可引发HC组SO收缩, 说明HC组SO细胞[Ca2+]i基础值处于较高水平, 由此降低了Ca2+激活CaM的阈值, 这是低浓度Ca2+即可诱发HC组SO肌环收缩的原因之一. 杨向新et al[26]的研究结果证实在HC作用下, SO细胞[Ca2+]i呈过载状态, 与本实验结果完全相符.
L-VDCs是细胞外Ca2+进入细胞内的主要通道, 对[Ca2+]i的调节有着重要的作用. Craig et al[27] 发现Nif对离体条件下负鼠SO的动力功能有显著改善作用. Craig et al[28-29]还发现L-VDCs拮抗剂对SOD有改善功能. Clunn et al[30]研究发现在HC并未直接改变平滑肌细胞L-VDCs功能. 我们采用双氢嘧啶类(DHPs)钙拮抗剂Nif观察对SO的舒张效应. 结果发现两组SO肌环对Nif在各个浓度点的舒张反应无显著差异, CaCl2, KCl等所引发SO肌环的收缩反应也均可被Nif完全缓解. 提示HC作用下, SO细胞的L-VDCs调节[Ca2+]i的功能并未受到损害, 证实HC组SO细胞[Ca2+]i过载状态并非是L-VDCs功能改变所致.
总之, 我们通过复制HC兔模型, 制备SO肌环, 在离体条件下观察发现HC导致SO肌环张力状态异常, SO处于易激惹状态. 其机制与[Ca2+]i过载有关, 并且该过载状态并非由L-VDCs功能改变所致. 至于HC是如何引起SO细胞[Ca2+]i过载, 其原因尚需进一步研究阐明.
| 9. | 闫 庆国, 师 建国, 黄 高昇, 张 传山, 李 青, 胡 沛臻, 王 文亮. 肝外胆管癌组织BAG-1及BAD的表达与凋亡调控原位的定量研究. 世界华人消化杂志. 2003;11:1144-1147. [DOI] |
| 11. | Wei JG, Wang YC, Du F, Yu HJ. Dynamic and ultrastructural study of sphincter of Oddi in early-stage cholelithiasis in rabbits with hypercholesterolemia. World J Gastroenterol. 2000;6:102-106. [PubMed] [DOI] |
| 12. | Wang XJ, Wei JG, Wang CM, Wang YC, Wu QZ, Xu JK, Yang XX. Effect of cholesterol liposomes on calcium mobilization in muscle cells from the rabbit sphincter of Oddi. World J Gastroenterol. 2002;8:144-149. [PubMed] [DOI] |
| 13. | Szilvássy Z, Nagy I, Madácsy L, Hajnal F, Velösy B, Takács T, Lonovics J. Beneficial effect of lovastatin on sphincter of Oddi dyskinesia in hypercholesterolemia and hypertriglyceridemia. Am J Gastroenterol. 1997;92:900-902. [PubMed] |
| 14. | Coyle WJ, Pineau BC, Tarnasky PR, Knapple WL, Aabakken L, Hoffman BJ, Cunningham JT, Hawes RH, Cotton PB. Evaluation of unexplained acute and acute recurrent pancreatitis using endoscopic retrograde cholangiopancreatography, sphincter of Oddi manometry and endoscopic ultrasound. Endoscopy. 2002;34:617-623. [PubMed] [DOI] |
| 15. | Szilvassy Z, Sari R, Nemeth J, Nagy I, Csati S, Lonovics J. Improvement of nitrergic relaxation by farnesol of the sphincter of Oddi from hypercholesterolaemic rabbits. Eur J Pharmacol. 1998;353:75-78. [PubMed] [DOI] |
| 18. | Sari R, Nemeth J, Porszasz R, Horvath P, Blasig IE, Ferdinandy P, Nagy I, Lonovics J, Szilvassy Z. Impairment by lovastatin of neural relaxation of the rabbit sphincter of Oddi. Eur J Pharmacol. 2001;432:91-97. [PubMed] [DOI] |
| 19. | Wei JG, Wang YC, Liang GM, Wang W, Chen BY, Xu JK, Song LJ. The study between the dynamics and the X-ray anatomy and regularizing effect of gallbladder on bile duct sphincter of the dog. World J Gastroenterol. 2003;9:1014-1019. [PubMed] [DOI] |
| 20. | Theilmeier G, Quarck R, Verhamme P, Bochaton-Piallat ML, Lox M, Bernar H, Janssens S, Kockx M, Gabbiani G, Collen D. Hypercholesterolemia impairs vascular remodelling after porcine coronary angioplasty. Cardiovasc Res. 2002;55:385-395. [PubMed] [DOI] |
| 21. | Fleischhacker E, Esenabhalu VE, Holzmann S, Skrabal F, Koidl B, Kostner GM, Graier WF. In human hypercholesterolemia increased reactivity of vascular smooth muscle cells is due to altered subcellular Ca(2+) distribution. Atherosclerosis. 2000;149:33-42. [PubMed] [DOI] |
| 22. | Ares MP, Pörn-Ares MI, Moses S, Thyberg J, Juntti-Berggren L, Berggren P, Hultgårdh-Nilsson A, Kallin B, Nilsson J. 7beta-hydroxycholesterol induces Ca(2+) oscillations, MAP kinase activation and apoptosis in human aortic smooth muscle cells. Atherosclerosis. 2000;153:23-35. [PubMed] [DOI] |
| 24. | Mokelke EA, Hu Q, Song M, Toro L, Reddy HK, Sturek M. Altered functional coupling of coronary K+ channels in diabetic dyslipidemic pigs is prevented by exercise. J Appl Physiol (1985). 2003;95:1179-1193. [PubMed] [DOI] |
| 25. | 何 令帅, 戴 德哉, 陈 静, 黄 敏. 对氯苄基四氯小檗碱(CPU-86017)及L-甲状腺素对大鼠主动脉环a1A、a1B亚型的选择性. 中国药科大学学报. 2002;33:245-249. |
| 26. | 杨 向新, 魏 经国, 王 春梅, 陈 宝莹, 陈 丹, 王 耀程, 邬 秋珍. 高胆固醇血症对兔胆管括约肌细胞内Ca2+转运的影响. 第四军医 大学学报. 2002;23:1698-1701. |
| 27. | Craig AG, Tottrup A, Toouli J, Saccone GT. Relative effects of dihydropyridine L-type calcium channel antagonism on biliary, duodenal, and vascular tissues: an in vivo and in vitro analysis in Australian brush-tailed possum. Dig Dis Sci. 2002;47:2029-2036. [PubMed] [DOI] |
| 28. | Craig A, Toouli J. Sphincter of Oddi dysfunction: is there a role for medical therapy? Curr Gastroenterol Rep. 2002;4:172-176. [PubMed] [DOI] |
| 29. | Craig AG, Toouli J. Slow release nifedipine for patients with sphincter of Oddi dyskinesia: results of a pilot study. Intern Med J. 2002;32:119-120. [PubMed] [DOI] |
| 30. | Clunn GF, Wijetunge S, Hughes AD. Effect of hypercholesterolaemia on voltage-operated calcium channel currents in rabbit arterial smooth muscle cells. J Hum Hypertens. 1999;13:849-853. [PubMed] [DOI] |