Copyright
©The Author(s) 2004. Published by Baishideng Publishing Group Inc. All rights reserved.
慢性乙型肝炎患者表位特异性CTL定量检测的评价
张静波, 陈思源, 杨志清, 李廷荣, 陈安, 吴玉章
张静波, 陈安, 吴玉章, 中国人民解放军第三军医大学全军免疫研究所 重庆市 400038
陈思源, 李廷荣, 重庆市传染病医院 重庆市 400030
杨志清, 中国人民解放军第三军医大学西南医院肝胆科 重庆市 400038
张静波, 女, 1968-06-03生, 重庆市人, 第三军医大学全军免疫研究所博士生, 主治医师, 讲师, 主要从事临床免疫学的研究.
ORCID number: $[AuthorORCIDs]
基金项目: 国家重点基础研究发展规划项目(973计划), No. 2001CB510001; 国家自然科学基金重大项目, No. 11111111.
电话: 023-68752680 传真: 023-68752789
收稿日期: 2003-10-10
修回日期: 2004-01-09
接受日期: 2004-02-03
在线出版日期: 2004-05-15
目的: 评价慢性乙肝患者体内不同表位特异性细胞毒性T细胞 (cytotoxic T lymphocyte, CTL) 的功能状态.
方法: 采用MHC/肽四聚体复合物技术, 即tetramer技术, 定量外周血HLA-A2限制性表位即核心抗原core18-27、被膜抗原env 183-191、335-343、聚合酶抗原pol 575-583 4种表位特异性CTL, 通过多元回归分析进行综合评价.
结果: 慢性乙肝患者体内存在多克隆CTL反应, core 18-27为优势性表位. 4种表位特异性CTL 的频率与病毒载量无相关性(P>0.05); 表位特异性CTL与血清转氨酶水平均无显著相关性(P>0.05).
结论: 体内存在的CTL数量并不能代表机体的保护性免疫状态.
关键词: N/A
引文著录: 张静波, 陈思源, 杨志清, 李廷荣, 陈安, 吴玉章. 慢性乙型肝炎患者表位特异性CTL定量检测的评价. 世界华人消化杂志 2004; 12(5): 1069-1072
Comprehensive analysis of the quantity of epitope-specific cytotoxic T lymphocytes in chronic viral hepatitis B infection
Jing-Bo Zhang, Shi-Yuan Chen, Zhi-Qing Yang, Ting-Rong Li, An Chen, Yu-Zhang Wu
Jing-Bo Zhang, An Chen, Yu-Zhang Wu, Institute of Immunology of Chinese PLA, Third Military Medical University, Chongqing 400038, China
Shi-Yuan Chen, Ting-Rong Li, Hospital of Infectious Diseases of Chongqing, Chongqing 400030, China
Zhi-Qing Yang, Department of Hepatobiliary Diseases, Southwest Hospital, Third Military Medical University, Chongqing 400038, China
Supported by: the Major State Basic Research Development Program of China (973 Program), No. 2001CB510001; The Major Programs of the National Natural Science Foundation of China, No. 11111111.
Correspondence to: Yu-Zhang Wu, Institute of Immunology of Chinese PLA, Third Military Medical University, Chongqing 400038, China. wuyuzhang@yahoo.com
Received: October 10, 2003
Revised: January 9, 2004
Accepted: February 3, 2004
Published online: May 15, 2004
AIM: To investigate the function state of epitope-specific cytotoxic T lymphocytes (CTLs) in chronic hepatitis B infection
METHODS: The study was performed to quantify the HBV specific CTL directly in vitro by HLA-A2 tetrameric complexes for core 18-27 (Tc 18-27), envelope 183-191 (Te 183-191), envelope 335-343 (Te 335-343), and polymerase 575-583 (Tp 575-583) in active chronic hepatitis patients, and then the correlation of HBV epitope-specific CTL between serum HBV DNA loads or alanine aminotransmerase (ALT) levels were analyzed by multiple regression analysis.
RESULTS: It was found that there were multiple CTLs responses in active chronic hepatitis patients. The frequency of Tc18-27 response was higher than the other three epitope-specific CTLs. No significant correlation was found either between the frequency of HBV specific CD8+ T cells and the viral load, or the frequency of HBV specific CD8+ T cells and the levels of alanine transaminase.
CONCLUSION: The frequencies of HBV-specific T cells are not determinant of immune-mediated protection in HBV infection and the existence of epitope-specific HBV CTLs is not directly correlated to hepatocytic injury.
Key Words: N/A
0 引言
细胞毒性T细胞(cytotoxic T lymphocyte, CTL)在清除细胞内乙肝病毒(hepatitis B virus, HBV)的同时, 也不可避免地造成宿主肝细胞的损伤[1-2]. 随着生物学和免疫病理学的发展, 保护性免疫的观点也发生了深刻的变化. 近年来的研究表明, 不同表位特异性CTL在清除胞内病毒感染和对宿主细胞损害的贡献不同. 如何明确不同表位特异性CTL的功能状态, 对设计更为合理而有效的治疗性疫苗将是关键. 慢性HBV感染中CTL的数量十分微弱, 我们采用全新的MHC/肽四聚体复合物(tetramer)技术[3-5], 对慢性HBV感染患者外周血CTL进行准确定量, 通过与病毒载量及肝功能状态的综合分析, 达到对不同表位特异性CTL的功能评价, 为进一步分析表位特异性CTL的效应机制及设计更为合理的免疫性治疗方案奠定基础[6].
1 材料和方法
1.1 材料
重庆市传染病医院住院患者35例, 男18例, 女17例. 平均年龄26.5岁. 诊断符合第五次全国传染病寄生虫病学术会议讨论修订标准. 排除HCV, HDV, HIV病毒混合感染. 肝脏B超证实有慢性炎症. HLA-A2-慢性活动性乙肝患者及HLA-A2+健康献血员5名为对照组. 淋巴细胞分离液(Ficoll-Hypaque)为天津TDB生物技术发展中心产品, 比重1.077 g/L; RPMI1640培养基(Gibico); R-PE标记的rMHC tetramer HLA-A*0201/FLPSDFFPSV(Tc18-27), HLA-A*0201/FLLTRILTI (Te183-191), HLA-A*0201/ WLSLLVPFV (Te335-343), HLA-A*0201/FLLSLGIHL (Tp575-583) 购自英国Proimmune公司; R-PE标记的亲合素购自美国Sigma公司; Cy-ChromeTM标记的鼠抗人CD8mAb购自美国BD PharMingen公司; Cy-ChromeTM标记的鼠IgG1, kmAb同型对照购自美国BD PharMingen公司; 红细胞裂解液购自美国BD PharMingen公司; FACS洗涤液(含1 g/L BSA, 0.1 g/L叠氮钠的PBS); HLA-A2鼠抗人mAb(来源于BB7.2小鼠杂交瘤细胞株, ATCC); FITC-羊抗小鼠IgG购自北京中山生物技术有限公司. TDGC2J超净工作台(苏州); TGL-16B台式离心机(上海); FACstar Plus 流式细胞仪/FCM(Becton-Dickinson); 定量PCR仪; 7150全自动生化分析仪
1.2 方法
血清转氨酶水平测定采用7150 全自动生化分析仪. 血清HBV DNA 定量检测(定量PCR, Roche公司)按说明书进行. 采集肝素抗凝的外周静脉血2 mL, 淋巴细胞分离液密度梯度法分离外周血单个核细胞(peripheral blood monoeuclear cell, PBMC), 用HLA-A2鼠抗人mAb (BB7.2, ATCC)为一抗, FITC-羊抗小鼠IgG为二抗进行间接免疫荧光染色, 流式细胞仪检测HLA-A2表型. Tetramer染色参照Proimmune公司说明书. PBMCs 1109/L加入tetramer 1 mg, 20 mL PE-Cy5标记的CD8抗体, 混匀, 避光, 室温孵育30 min后PBA液(5 g/L牛血清白蛋白, 0.5 g/L叠氮钠, 0.01 moL/L PBS)洗涤2次; 10 g/L多聚甲醛固定后上机检测; 或肝素抗凝的全血0.25 mL加PBS 2 mL稀释后, 500 g离心5 min; 用吸管小心移弃上清; 加入tetramer 1 mg, PE-Cy5 20 mL标记的CD8抗体于全血细胞中, 混匀; 室温孵育30 min, 避光; PBA液洗涤1次; 加5 mL FACS裂解液, 室温10 min; 待细胞悬液变成真性溶液后PBA液洗涤2次; 10 g/L多聚甲醛固定, FACstar Plus 流式细胞仪检测, BD FACS 专用CELLQuestTM软件分析.
统计学处理 本研究计量资料以均数±标准差(mean±SD)表示. 分别以病毒载量(以病毒拷贝数表示)和血清转氨酶水平为因变量(depend), 以Tc18-27、Te183-191、Te335-343、Tp575-583为自变量(independ), 采用多元逐步回归分析(multiple stepwise regression analysis). 显著性检验用t检验, 单相关分析用线性相关. 整个统计过程用SPSS 8.0统计软件进行. P<0.05为有显著性意义.
2 结果
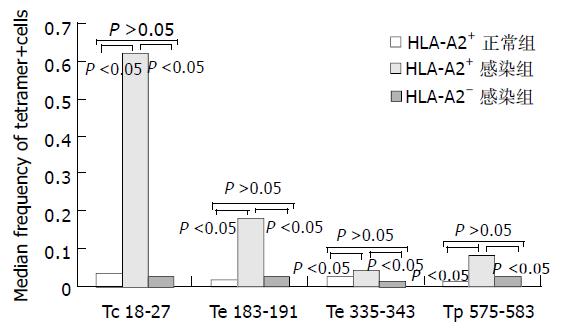
在35例慢性乙肝患者有16例为HLA-A2+, 经流式细胞仪检测HLA-A2+ 阳性的平均荧光强度大于90%. 通过对照HLA-A2+患者的Tc18-27染色发现, 以CD8阳性细胞设门, tetramer阳性细胞频率在两种方法的检测中无明显差异. 在慢性乙肝患者中, HLA-A2+组和HLA-A2- 组之间无明显差异(P>0.05), 但和正常健康HLA-A2+ 组有显著性差异(P<0.05).
2.1 不同表位特异性CTL的表达频率
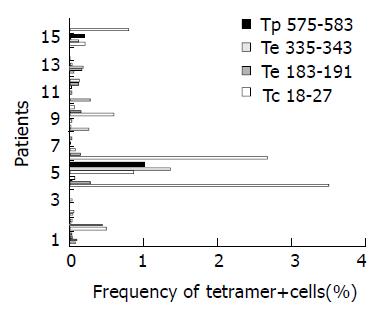
HLA-A2+ 正常健康组及HLA-A2- 慢性乙肝患者组tetramer+ 细胞未超过0.03%. 所有HLA-A2+患者的tetramer+细胞频率(图1). 16例HLA-A2+ 乙肝患者外周血中, Tc 18-27有12例有tetramer阳性细胞存在, 频率为0.01-3.52%, 其中在9例患者呈优势性表达. Te 183-191在8例患者的阳性频率为0.02-1.37%, 其中3例为优势性表达. Te 335-343在4例患者的阳性频率为0.02-0.79%, 无优势性表达. Tp 575-583在5例患者中阳性表达频率为0.01- 1.01%, 无优势性表达. HLA-A2+慢性乙肝感染组的tetramer阳性细胞频率与HLA-A2- 慢性乙肝感染组及HLA-A2+正常健康组的tetramer阳性细胞频率比较有显著性差异(P<0.05), HLA-A2-慢性乙肝患者组与HLA-A2+正常健康组的tetramer阳性细胞频率比较无显著性差异(P>0.05, 图2).
图1 HLA-A2+慢性乙肝感染患者外周血tetramer+/CD8+细胞的表达频率.
全血(0.25 mL)经PE标记的tetramer染色(Tc18-27、Te183-191、Te335-343、Tp575-583)和PE-Cy5标记的CD8单克隆抗体进行双标染色, 在流式细胞仪上进行分析, 以CD8阳性细胞设门, 记数50 000个细胞, 双阳性细胞为tetramer细胞频率(以%表示).
图2 tetramer+细胞频率和病毒载量之间的关系.
HLA-A2+ 感染组的tetramer阳性细胞频率与HLA-A2-感染组及HLA-A2+正常健康组的tetramer阳性细胞频率比较有显著性差异(P<0.05), HLA-A2-感染组与HLA-A2+正常健康组的tetramer阳性细胞频率比较无显著性差异(P>0.05).
2.2 特异性CTL表达频率与病毒感染的关系
以病毒载量为因变量; Tc18-27, Te183-1-91, Te335-343, Tp575-583为自变量, 进行逐步回归分析, 得出线性模型如下: 病毒载量 = -111.7+331.7 (Tc18-27)+4 929.1(Te183-191)+3 388.9 (Te335-343)-7 098.0 (Tp575-583). 回归方程的整体性检验: 决定系数(r square) = 0.928, F值为7.003, P = 0.005, 有统计学意义. 4个自变量对病毒载量的影响依次为Tc18-27> Tp575-583> Te183-191> Te335-343. 但4种表位特异性CTL和病毒载量相关性无显著意义(P>0.05). 以血清转氨酶水平为因变量; Tc18-27, Te183-1-91, Te335-343, Tp575-583为自变量, 进行逐步回归分析, 得出的回归方程无统计学意义(P>0.05), 转氨酶水平和四种表位特异性CTL均无显著相关性(P>0.05). 病毒载量和血清转氨酶水平无线性相关(P>0.05).
3 讨论
HBV作为嗜肝细胞病毒, 病毒本身及其在体内的复制并不引起宿主肝细胞的损伤. HBV感染通常被认为是宿主细胞免疫的结果[1,7-11]. 由于HBV不能在体外组织培养中生长, 而黑猩猩是惟一能被感染的动物, 这些缺陷一直阻碍了HBV感染免疫病理的研究[11-12]. 既往研究表明, 急性自限HBV感染患者体内出现强烈而多克隆的CTL反应, 同时伴随血清转氨酶升高等肝脏病理损害, 进而引起HBV的清除. 而在慢性乙肝患者体内CTL 反应非常微弱甚至检测不到[12]. MHC/肽四聚体复合物技术为检测表位特异性CTL提供了定量标准[3-5], 也为进一步了解表位特异性CTL 与病毒复制及肝脏损害之间的相关关系提供了可能性. 全血染色法因所需样本量少, 勿需进行淋巴细胞分离等烦琐的离心步骤, 并因更接近体内环境而日益受到重视[3-5,13]. 我们尝试了全血法对乙肝患者外周血的tetramer检测, 以CD8阳性细胞设门, 计算tetramer+/CD8+的双阳性细胞, 结果两种方法检测的tetramer+ 细胞频率无显著性差异. 表明全血法检测是一种简单可行的方法. 通过慢性活动性乙肝患者, 发现病毒载量与血清转氨酶水平无明显相关性, 支持既往关于病毒本身并不引起肝细胞损害的观点[12]. 在慢性活动性乙肝患者体内出现多克隆的CTL反应, 其中Tc18-27 为优势性表达. 但通过对4种不同表位特异性CTL与病毒载量的关系发现, 4种表位特异性CTL和病毒复制水平并不相关, 表明这些多克隆存在的CTL并不能代表机体的保护性反应. 这些反应状态的不同差异以及与病毒载量的相关性差异, 其可能的原因为: (1) HBV不同抗原可能具有不同的免疫原性和耐受原性[14]. Yang et al[15]在HBV质粒转染诱导的小鼠急性感染模型中, 并没有检测到针对核心抗原的CTL, 可能与小鼠的遗传背景有关; (2) Kakimi et al[14]发现, 被膜抗原(envelope, ENV)特异性CTL处于耐受状态, 而针对聚合酶(polymerase, POL)的CTL虽然存在, 但对乙肝病毒的复制和肝细胞的损伤均没有作用; 而Reignat et al[16]发现, 针对ENV的耐受并不是经典的耐受. 需结合如Elispot技术进行或统计分析的方法进行综合评价[17], 这可能是本实验中Te183-191、Te335-343 及Tp575-583与病毒载量之间无相关性的原因; (3) tetramer技术的定量检测并不能反应CTL在体内的功能状态[16,18-20]. 这些病毒特异性CTL能和体内高载量的病毒抗原共存而不具有杀伤靶细胞和分泌细胞因子的功能; (4) 我们仅选择了4个具有代表性针对HLA-A2限制性的优势性表位. 新近在HIV的研究表明, 单纯针对优势性表位的检测并不能反映机体的整个病毒感染的参数, 而应该由所有具有免疫潜能的表位特异性CTL来反映[21-24].
血清转氨酶水平升高是肝脏损害的标志[25]. 我们发现4种表位特异性CTL与血清转氨酶水平无显著性相关. 可能一些未选择的亚优势表位发挥了肝细胞损害的功能[16]; CTL可能通过非细胞毒机制发挥控制和清除HBV病毒的作用[26]. 如果HBV特异性效应CD8+T细胞应答不能控制病毒复制, 则会直接或通过吸引其他非病毒抗原特异性T细胞聚集而造成肝病理损害[19,26]. Sitia et al[27-30]研究表明, 通过阻滞趋化因子的作用可减少抗原非特异性细胞在肝细胞的浸润, 从而降低肝细胞的损害程度. 表位特异性CTL在慢性活动性乙肝患者体内的存在并不直接引起宿主肝细胞的损害, 而可能通过"募集"更多的抗原非特异性细胞间接地对肝细胞进行损伤. 这样可设计新型抗原分子, 诱导HLA-I类分子限制性的HBV特异性效应CD8+T细胞表达, 在无肝细胞病理性损害的基础上, 籍抗原特异性CTL作用而抑制HBV复制、清除胞内病毒.