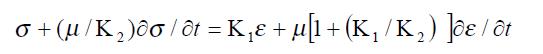修回日期: 2003-11-29
接受日期: 2003-12-08
在线出版日期: 2004-05-15
目的: 探讨肿瘤转移抑制基因KAI1对高转移潜能肝癌细胞MHCC97-H粘弹性的影响.
方法: 采用微管吸吮技术研究我们前已转染人类KAI1全长正或反义结构基因的人肝癌MHCC97-H细胞粘弹特性.
结果: MHCC97-H肝癌细胞的粘弹性系数K1, K2, m在转染KAI1正义基因后明显增加(P = 0.007), 在转染KAI1反义基因后明显降低(P = 0.000), 而转染空载体后则无明显变化(P = 0.444).
结论: KAI1基因对肝癌细胞的粘弹性有明显影响, 这为肝癌侵袭和转移机制的研究提供了重要线索.
引文著录: 彭志红, 杨建民, 司遂海, 房殿春, 陈文生, 罗元辉. 肿瘤转移抑制基因KAI1对MHCC97-H肝癌细胞粘弹性的影响. 世界华人消化杂志 2004; 12(5): 1040-1043
Revised: November 29, 2003
Accepted: December 8, 2003
Published online: May 15, 2004
AIM: To study the effects of metastasis-suppressor gene KAI1 on viscoelastic properties of hepatocellular carcinoma MHCC97-H cells with high metastatic potential.
METHODS: The viscoelastic properties of MHCC97-H cells with high metastatic potential transfected with sense or antisense KAI1 expression plasmid in our previous experiments were measured by means of micropipette aspiration technique.
RESULTS: The elastic coefficients K1, K2 and m of the MHCC97-H cells were significantly higher after transfected with sense KAI1 expression plasmid (P = 0.007), lower after transfected with antisense KAI1 expression plasmid (P = 0.000), and no significantly different after transfected with its control vector pCI-neo without KAI1 gene (P = 0.444), as compared with their paternal MHCC97-H cells.
CONCLUSION: The metastasis-suppressor gene KAI1 may significantly affect the viscoelastic properties of MHCC97-H cells with high metastatic potential. It offers an important clue to study the mechanisms of invasion and metastasis of the malignant tumor.
- Citation: Peng ZH, Yang JM, Si SH, Fang DC, Chen WS, Luo YH. Effects of metastasis-suppressor gene KAI1 on viscoelastic properties of hepatocellular carcinoma MHCC97-H cells with high metastatic potential. Shijie Huaren Xiaohua Zazhi 2004; 12(5): 1040-1043
- URL: https://www.wjgnet.com/1009-3079/full/v12/i5/1040.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i5.1040
肝癌是常见的恶性肿瘤之一[1-7], 严重威胁人类健康, 其侵袭转移和复发是患者死亡的主要原因[8-12], 因此, 探索肝癌转移、复发的发生机制, 寻求有效的抗转移治疗措施, 对改善肝癌患者的预后具有重要意义. 肿瘤的侵袭和转移是具有复杂细胞流变学机制的病理过程, 其浸润性生长和穿透内皮细胞的过程是以癌细胞的运动和变形为基础的, 而粘弹性则是与细胞运动和变形密切相关的生物物理特性. 我们从此角度入手, 试图通过探讨肿瘤转移抑制基因KAI1对高转移潜能肝癌细胞MHCC97-H粘弹性的影响, 进而揭示肝癌细胞侵袭、转移的可能分子生物力学机制.
MHCC97-H肝癌细胞系为上海复旦大学医学院附属中山医院肝癌研究所建立[13] 的高转移潜能细胞, 属贴壁生长型. 我们前已利用亚克隆技术构建了人类KAI1全长正、反义结构基因哺乳动物真核表达质粒, 通过DOTAP脂质体介导的转染系统分别将其转入该肝癌细胞中, 并进行了基因整合和表达的鉴定, 说明基因转染成功, 可获得预期KAI1蛋白表达[14]. 转染有KAI1正义基因的肝癌细胞重新为MHCC97-H-S, 转染有KAI1反义基因的肝癌细胞命名为MHCC97-H-AS, 转染有pCI-neo空载体的肝癌细胞命名为MHCC97-H-pCI. 细胞培养条件为: 高糖DMEM加100 mL/L胎牛血清和两种抗生素(青霉素100 mg/L, 链霉素100 mg/L), 37 ℃, 50 mL/L CO2, 饱和湿度培养. 在细胞处于对数生长期时均经2.5 g/L酶/0.4 g/L EDTA消化后悬浮于DMEM培养液中, 浓度约为5×109/L. 微管吸吮实验中细胞分为4组, 分别为MHCC97-H-S组、MHCC97-H-AS组、MHCC97-H-pCI组及MHCC97-H亲本细胞对照组, 每组各观察测量20个细胞. 整个微管吸吮实验在3 h内完成.
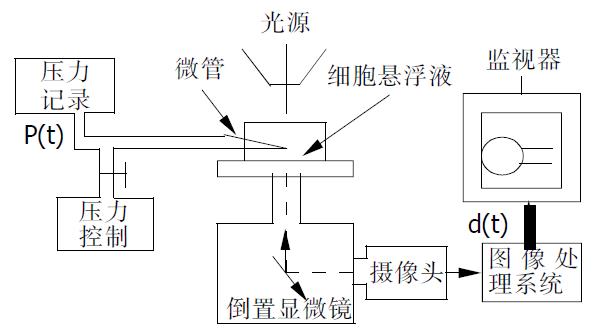
1.2.1 微管吸吮实验: 采用微管吸吮技术对单个细胞的粘弹特性进行实验测试[15]. 本实验在重庆大学生物医学工程学院及国家教育部生物力学与组织工程重点实验室完成. 微管吸吮实验系统由倒置显微镜、显微微操作器、图像处理仪、压力控制和记录系统及微管等部分组成(图1). 将细胞悬液0.5 mL注入一特定的圆形小室内, 一同置于倒置显微镜(Axiovert 35, Zeiss Co.德国)载物台上. 微管采用普通玻璃毛细管由微管拉制器(P-87.S mtter Ins.Co., 美国)拉制而成, 微管与显微微操作器(MR5170, eppendorf Co., 德国)相连并通过他连接于压力控制和记录系统. 利用显微微操作器控制微管尖部靠近细胞表面, 并用重庆大学研制的自动压力控制和记录系统通过微管给细胞施以阶跃负压, 使细胞的一小部分吸入微管, 细胞在微管内的变形时间过程由图像处理仪(Vidas21, 德国)记录, 并通过回放所记录的图像测量细胞在微管内的变形值. 所有实验均在室温(约15 ℃)下进行, 整个系统在图像监视器上的放大倍数为3 500倍, 并用40 mm的光栅尺进行标定.
1.2.2 细胞粘弹性模型: 在本研究中, MHCC97-H细胞在外加负压作用下发生小的被动变形. 肝癌细胞可视为不可压缩的均质粘弹性球形固体, 其半径为R. 为对实验结果进行分类和比较, 采用一粘弹性拟合实验结果, 可定量地比较在不同条件下细胞的粘弹性参数. 参照文献[16]选用标准线性固体模型拟合肝癌细胞变形的实验数据. 该模型由两条平行的"臂"组成, 其中一臂为弹性系数为K1的弹性元件, 另一臂为弹性系数为K2的弹性元件与粘性系数为m的粘性元件串联组成, 其本构方程由下式给出:
Math 1
这里σ和ε分别为应力和应变, 分别为应力和应变对时间的偏导数. 弹性系数K1和K2与时间无关, 主要描述细胞的刚性, 反映细胞的初始变形程度随[(1/K1)+(1/K2)]而变化. 粘性系数m描述了细胞变形对时间的依赖性, 反映了细胞的粘性. 在本文所设计的蠕变力学实验中, 细胞蠕变特性由时间常数m[(1/K1)+(1/K2)]确定, 最大变形值正比于1/K1[17].
统计学处理 采用两样本均数t检验进行显著性分析.
在475 N/m2的阶跃负压作用下, 肝癌细胞在微管内的变形经历了初始快速响应和其后稳定增加的时间过程(图2). 经拟合计算测得MHCC97-H亲本细胞、转染正义KAI1基因、反义KAI1基因以及空载体后该肝癌细胞的弹性系数K1, K2及粘性系数m. MHCC97-H-AS细胞的弹性系数K1, K2和粘性系数m较对照组MHCC97-H亲本细胞相应值降低, 差异有显著性(P = 0.000)(表1), 这表明在实验条件下MHCC97-H-AS细胞较MHCC97-H亲本细胞的刚性降低, 变形性增加; MHCC97-H-S细胞粘弹性系数K1、K2和m均较对照组MHCC97-H亲本细胞的相应值增加, 差异有显著性(P = 0.007), 这表明MHCC97-H-S细胞较MHCC97-H亲本细胞变形性降低;而MHCC97-H-pCI细胞与MHCC97-H亲本细胞比较则无明显变化(P = 0.444).
KAI1基因是1995年发现的一个新基因[18], 是前列腺癌的转移抑制基因. KAI1基因定位于人类染色体11p11.2, 编码产物为含267个氨基酸的细胞膜糖蛋白, 属于跨膜4超家族[19] (Transmembrane 4 superfamily, TM4SF). 该家族包括ME491/CD63, MRP-1/CD9, TAPA-1, CD81, CD37和CD53等, 大部分成员已被确定为白细胞表面蛋白, 其中至少3种与肿瘤转移有关, 包括CD9/MRP-1, CD63/ME491, CD82/KAI1. KAI1基因不仅在前列腺癌中表达下调, 而且在多种人类实体上皮肿瘤如结直肠癌[20-23]、胰腺癌[24]中均存在表达异常的现象, 由此认为KAI1基因不仅能抑制前列腺癌的转移, 而且可能对其他恶性肿瘤的侵袭和转移也起抑制作用[25-27].
肿瘤不仅在原发灶通过肿瘤血管从宿主获得营养, 而且向宿主输出大量恶性细胞, 导致肿瘤不断生长和转移[28-31]. 肝癌患者死亡的主要原因就在于其侵袭转移[32]. 癌细胞的侵袭转移是一个复杂的生物学过程, 涉及癌细胞从原发灶脱落, 侵袭和穿透基底膜, 降解细胞外基质, 向远处转移等[33]. 在此过程中首要的和重要的是癌细胞的运动和变形性, 而粘弹性是与细胞运动和变形密切相关的生物物理特性. 本实验即是从此角度入手, 采用微管吸吮技术, 测定已转染正、反义KAI1基因的高转移潜能肝癌MHCC97-H细胞的粘弹性, 从正反两方面阐明KAI1基因对肝癌细胞粘弹性的影响, 进而探讨KAI1基因在肝癌侵袭转移过程中的重要作用. 从实验结果可以看出, 转染反义KAI1基因后, MHCC97-H-AS的3个粘弹性系数K1, K2和m均小于未转染组, 且二者间差异具有显著性, 说明MHCC97-H-AS较MHCC97-H亲本细胞更易发生运动和变形, 提示反义KAI1基因可能降低了肝癌细胞与周围组织的黏附性而容易从原发灶脱落, 这样MHCC97-H-AS癌细胞就更具有侵袭和转移的恶性表型. 转染正义KAI1基因的MHCC97-H-S细胞粘弹性系数K1, K2和m均大于未转染组, 且二者间差异具有显著性, 说明MHCC97-H-S细胞没有MHCC97-H细胞容易运动和变形, 提示KAI1正义基因降低了MHCC97-H的粘弹性, 因而可能会降低癌细胞的侵袭和转移能力. 转染pCI-neo空载体的MHCC97-H-pCI细胞粘弹性系数K1, K2和m与MHCC97-H细胞比较无明显变化. 由上可知, 肿瘤转移抑制基因KAI1影响了肝癌细胞的粘弹性, 这为肿瘤侵袭和转移机制的研究提供了重要线索. 但肿瘤的发生、发展与宿主的微环境是密不可分的, 与肿瘤细胞之间的相互作用也是相关联的, 在今后的工作中我们拟采用动物模型的办法, 研究体内肝癌侵袭、转移过程中KAI1基因的变化及其分子机制, 进一步为肝癌转移的防治提供理论和实验依据.
重庆大学生物工程学院及国家教育部生物力学与组织工程重点实验室秦建和宋关斌老师的帮助.
| 1. | Lee JH, Ku JL, Park YJ, Lee KU, Kim WH, Park JG. Establishment and characterization of four human hepatocellular carcinoma cell lines containing hepatitis B virus DNA. World J Gastroenterol. 1999;5:289-295. [PubMed] [DOI] |
| 4. | 邵 晓冬, 吴 开春, 郭 晓钟, 徐 建华, 郭 长存, 孟 繁平, 樊 代明. KAI1基因在肝硬化和肝细胞癌组织中的表达及其意义. 世界华人消化杂志. 2001;9:1238-1241. [DOI] |
| 8. | Jiang YF, Yang ZH, Hu JQ. Recurrence or metastasis of HCC:predictors, early detection and experimental antiangiogenic therapy. World J Gastroenterol. 2000;6:61-65. [PubMed] [DOI] |
| 9. | Li Y, Shang P, Qian AR, Wang L, Yang Y, Chen ZN. Inhibitory effects of antisense RNA of HAb18G/CD147 on invasion of hepatocellular carcinoma cells in vitro. World J Gastroenterol. 2003;9:2174-2177. [PubMed] [DOI] |
| 10. | Wang W, Yang LY, Yang ZL, Huang GW, Lu WQ. Expression and significance of RhoC gene in hepatocellular carcinoma. World J Gastroenterol. 2003;9:1950-1953. [PubMed] [DOI] |
| 11. | Qian J, Feng GS, Vogl T. Combined interventional therapies of hepatocellular carcinoma. World J Gastroenterol. 2003;9:1885-1891. [PubMed] [DOI] |
| 12. | Wan YL, Zheng SS, Zhao ZC, Li MW, Jia CK, Zhang H. Expression of co-stimulator 4-1BB molecule in hepatocellular carcinoma and adjacent non-tumor liver tissue, and its possible role in tumor immunity. World J Gastroenterol. 2004;10:195-199. [PubMed] |
| 13. | Li Y, Tang ZY, Ye SL, Liu YK, Chen J, Xue Q, Chen J, Gao DM, Bao WH. Establishment of cell clones with different metastatic potential from the metastatic hepatocellular carcinoma cell line MHCC97. World J Gastroenterol. 2001;7:630-636. [PubMed] |
| 14. | 司 遂海, 杨 建民, 罗 元辉, 房 殿春, 周 平. KAI1正反义基因对MHCC97-H肝癌细胞KAI1蛋白表达的影响. 世界华人消化杂志. 2003;11:1341-1344. [DOI] |
| 15. | 陈 军, 肖 光夏, 吴 泽志, 秦 健, 李 章万. 肠上皮细胞的粘弹性生物力学研究. 四川大学学报(医学版). 2003;34:34-35. |
| 18. | Wu Q, Ji Y, Zhang MQ, Chen YQ, Chen F, Shi DL, Zheng ZH, Huang YJ, Su WJ. Role of tumor metastasis suppressor gene KAI1 in digestive tract carcinomas and cancer cells. Cell Tissue Res. 2003;314:237-249. [PubMed] [DOI] |
| 19. | Gao AC, Lou W, Dong JT, Barrett JC, Danielpour D, Isaacs JT. Defining regulatory elements in the human KAI1 (CD 82) metastasis suppressor gene. Prostate. 2003;57:256-260. [PubMed] [DOI] |
| 20. | Hashida H, Takabayashi A, Tokuhara T, Hattori N, Taki T, Hasegawa H, Satoh S, Kobayashi N, Yamaoka Y, Miyake M. Clinical significance of transmembrane 4 superfamily in colon cancer. Br J Cancer. 2003;89:158-167. [PubMed] [DOI] |
| 21. | Wu DH, Liu L, Chen LH, Ding YQ. Expression of KAI1/CD82 in human colorectal tumor. Diyi Junyi Daxue Xuebao. 2003;23:714-715, 719. [PubMed] |
| 22. | Liu L, Wu DH, Li ZG, Yang GZ, Ding YQ. Effects of KAI1/CD82 on biological behavior of human colorectal carcinoma cell line. World J Gastroenterol. 2003;9:1231-1236. [PubMed] [DOI] |
| 23. | Yang J, Liu FX, Yan XC, He GY, Liu LM. [Role of tumor metastasis suppressor gene KAI1 in development of colorectal cancer]. Ai Zheng. 2003;22:533-536. [PubMed] |
| 24. | Friess H, Guo XZ, Tempia-Caliera AA, Fukuda A, Martignoni ME, Zimmermann A, Korc M, Büchler MW. Differential expression of metastasis-associated genes in papilla of vater and pancreatic cancer correlates with disease stage. J Clin Oncol. 2001;19:2422-2432. [PubMed] [DOI] |
| 25. | Schindl M, Birner P, Bachtiary B, Breitenecker G, Selzer E, Oberhuber G. KAI1 metastasis suppressor protein in cervical cancer. Am J Pathol. 2002;160:1542-1543; author reply 1543. [PubMed] [DOI] |
| 26. | Uzawa K, Ono K, Suzuki H, Tanaka C, Yakushiji T, Yamamoto N, Yokoe H, Tanzawa H. High prevalence of decreased expression of KAI1 metastasis suppressor in human oral carcinogenesis. Clin Cancer Res. 2002;8:828-835. [PubMed] |
| 27. | Hashida H, Takabayashi A, Tokuhara T, Taki T, Kondo K, Kohno N, Yamaoka Y, Miyake M. Integrin alpha3 expression as a prognostic factor in colon cancer: association with MRP-1/CD9 and KAI1/CD82. Int J Cancer. 2002;97:518-525. [PubMed] [DOI] |
| 28. | Guo XZ, Friess H, Shao XD, Liu MP, Xia YT, Xu JH, Buchler MW. KAI1 gene is differently expressed in papillary and pancreatic cancer: influence on metastasis. World J Gastroenterol. 2000;6:866-871. [PubMed] [DOI] |
| 29. | Jaffe AB, Hall A. Rho GTPases in transformation and metastasis. Adv Cancer Res. 2002;84:57-80. [PubMed] [DOI] |
| 30. | Jiang BJ, Sun RX, Lin H, Gao YF. Study on the risk factors of lymphatic metastasis and the indications of less in vasive operations in early gastric cancer. World J Gastroenterol. 2000;6:553-556. [PubMed] |
| 31. | Furger KA, Menon RK, Tuck AB, Bramwell VH, Chambers AF. The functional and clinical roles of osteopontin in cancer and metastasis. Curr Mol Med. 2001;1:621-632. [PubMed] [DOI] |
| 32. | Yang JM, Chen WS, Liu ZP, Luo YH, Liu WW. Effects of insulin-like growth factors-IR and -IIR antisense gene transfection on the biological behaviors of SMMC-7721 human hepatoma cells. J Gastroenterol Hepatol. 2003;18:296-301. [PubMed] [DOI] |
| 33. | Steeg PS. Metastasis suppressors alter the signal transduction of cancer cells. Nat Rev Cancer. 2003;3:55-63. [PubMed] [DOI] |