修回日期: 2003-09-01
接受日期: 2003-09-24
在线出版日期: 2004-04-15
目的: 研究消痰散结方(以下简称消方)对裸鼠人胃癌原位种植瘤生长转移的抑制作用及其对(vascular endothelial growth factor, VEGF), (kinase insert domain receptor, KDR)表达的影响.
方法: 建立人胃癌裸鼠原位种植高转移模型, 实验动物随机分为4组(荷瘤对照组、消痰散结方组、5-FU化疗组、联合组), 于接种第12 wk处死动物, 取肝脏及淋巴结, 作组织病理学检查, 观察消方对肿瘤转移的抑制率, 同时留取部分标本运用逆转录聚合酶链反应(RT-PCR)对VEGF、KDRmRNA作定量检测.
结果: 所有荷瘤鼠胃壁均有肿瘤生长, 且有不同程度的远处转移. RT-PCR检测发现, 消方组、化疗组、联合组癌组织内VEGF、KDRmRNA含量均显著低于荷瘤对照组(P<0.01), 且消方组中癌组织VEGF、KDRmRNA表达量较化疗组、联合组亦明显降低(P<0.01), 具有统计学意义.
结论: 消方具有一定抑制胃癌转移的作用. 其作用机制之一可能是下调了肿瘤组织VEGF、KDRmRNA表达水平而起到抗胃癌浸润转移的作用.
引文著录: 许玲, 苏晓妹, 陈亚琳, 魏品康. 中药消痰散结方对人胃癌裸鼠原位移植瘤VEGF, KDRmRNA表达的影响. 世界华人消化杂志 2004; 12(4): 988-990
Revised: September 1, 2003
Accepted: September 24, 2003
Published online: April 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(4): 988-990
- URL: https://www.wjgnet.com/1009-3079/full/v12/i4/988.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i4.988
运用消痰散结法治疗胃癌, 不仅提高了患者的生活质量, 而且有抑制肿瘤转移的作用[1-2]. 然而其抑制肿瘤转移的机制尚须进一步研究. 近几年新生血管形成在肿瘤转移的分子水平机制研究中, 已受到人们的重视. 实体肿瘤生长及转移需要血管生成, 实体肿瘤形成后进入无血管的浸润前期, 此时肿瘤细胞依靠弥漫供给营养, 当肿瘤结节生长到1-2 mm3以后, 肿瘤必须有新生血管生成供给营养, 才能继续增生和转移[3-7]. 肿瘤细胞可分泌多种血管生成因子诱导血管生成, 其中血管内皮生长因子(vascular endothelial growth factor, VEGF)是目前已知的最主要、最直接的血管生成因子[4,8-9], 与相关受体结合后, 可直接刺激内皮细胞增生, 增加血管通透性, 参与诱导肿瘤血管形成, 为肿瘤浸润转移提供条件. 因此, 拟以VEGF及其受体为研究点来探讨消痰散结方的作用机制[10-11].
BALB/C nu/nu裸鼠由中科院国家啮齿类上海实验分中心提供, ♂, 6周龄, 体重18-20 g, 在SPF级条件下分笼饲养. 人胃腺Ca SGC-7901细胞株, 由中科院上海细胞生物研究所提供, 于裸鼠右腋后皮下注射并传代6次成实体瘤. 消痰散结方由天南星15 g, 半夏15 g, 茯苓15 g, 枳实10 g, 陈皮9 g, 鸡内金15 g, 炙甘草6 g等中药组成, 由第二军医大学长征医院药物制剂中心高压制成无菌针剂, 每毫升含生药2.5 g. 使用前先以生理盐水配成所需浓度, 置于4 ℃冰箱备用. 实验动物用氯胺酮50 mg/kg腹腔麻醉后, 常规皮肤消毒, 选择左侧正中旁切口, 打开腹腔, 暴露胃壁, 在胃大弯近胃窦处用1 mL空针头划破胃壁浆肌层, 植入直径1 mm大小的瘤组织块后, 在瘤块表面滴上一滴OB生物胶(广州白云医用胶公司提供), 使其覆盖瘤组织表面40 s 凝固后缝合腹膜及皮肤, 关腹.
裸鼠随机分为4组, 每组12只. 种植后1 wk, 分别自腹腔注射生理盐水(0.2 mL, 对照组)、2.5 kg/L消痰散结方(0.2 mL, 消方组)、6 g/L 5-Fu(0.2 mL, 化疗组), 同时给予中药组及化疗组的治疗方案(联合组). 5-Fu 1次/wk, 余每天一次, 连续3 wk. 于建模后12 wk动物濒临死亡时处死荷瘤鼠, 剥离胃壁肿瘤, 取肝脏及淋巴结, 常规石蜡切片, HE染色, 作组织病理学检查. 另留取部分胃癌标本迅速投入液氮中冷冻备用. 用高浓度强变性剂异硫氰酸胍等提取移植瘤组织中RNA, 紫外分光光度计测定总RNA, A260/A280鉴定RNA, 甲醛变性琼脂糖凝胶电泳鉴定RNA的完整性. 上海博亚生物有限公司合成引物, VEGF引物序列为: forward: 5'-TGC CTT GCT GCT CTA CCT CC-3', reverse: 5'-TCA CCG CCT CGG CTT GTC AC-3'; 扩增片断VEGF121、165分别为410 bp、540 bp; KDR引物序列为: forward: 5'-TAC CGG GAA ACT GAC TTG GCC T-3'reverse: 5'-TCA GTT CTT GCT GTA CAA TTT A-3'; 扩增片断为440 bp. -actin序列为: forward: 5'-TGA CGG GGT CAC CCA CAC TGT GCC CAT CTA-3' reverse: 5'-CTC AGG GCA GCG GAA CCG CTC ATT GCC AAT-3'; 扩增片断为310 bp. 参照TaKaRa公司合成的Reverse Transcription System Kit逆转录合成cDNA: 总RNA 1.0 L, dNTP 1.0 L, oligo (dT)18 1.0 L, AMV 1.0 L, RNAase inhibitor 1.0 L. PCR扩增的总反应体系25 L. cDNA模板1 L, 10×Buffer 2.5 L, 2.5 mmoL/L dNTP 2.5 L, 25 mmoL/L MgCl2 1.7 L, VEGF、KDR引物各1 L, -actin引物1 L, 最后加Taq酶1 L, 双蒸水14.3 L. PCR扩增条件: 预变性95 ℃, 5 min; 变性94 ℃, 40 s; 退火55 ℃, 40 s; 延伸72 ℃, 1 min, 扩增35个循环后, 72 ℃, 5 min延伸. PCR产物在15 g/L琼脂糖凝胶上电泳, 0.5 mg/L EB染色, 出现与扩增产物大小相等的电泳条带为阳性.
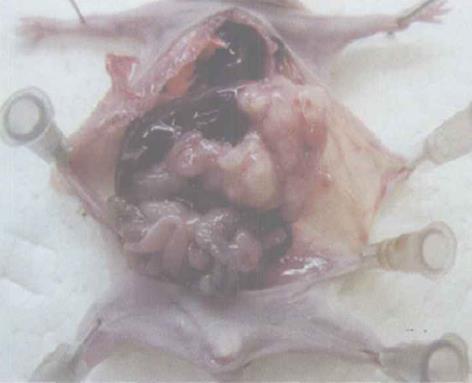
对照组、实验组荷瘤鼠胃壁均有肿瘤生长, 多呈圆形, 实质性, 表面有结节状隆起, 呈淡红色鱼肉状, 部分中心有坏死见图1. 病理学检测表明, 消方能在一定程度上抑制胃癌的转移, 胃癌转移情况见表1.
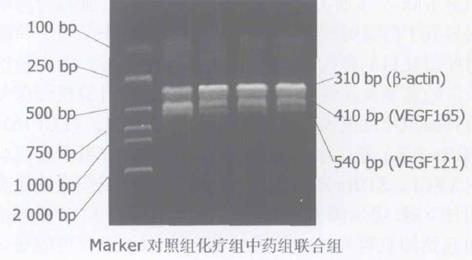
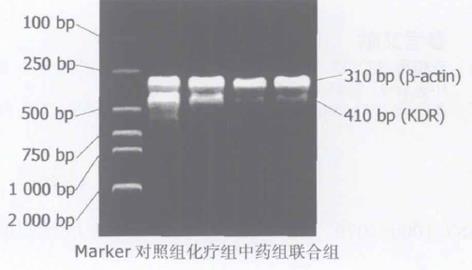
-actin在所有标本中均有表达, 各实验组、对照组中VEGF、KDRmRNA均有不同程度表达. 消方组VEGF, KDR的cDNA扩增产物的条带宽窄及深浅经计算机图像分析其面积灰度值较对照组显著下降(P<0.01); 在消方组胃癌组织内VEGF, KDRmRNA表达量亦较5-FU组明显下降, 具有统计学意义见表2. 说明消方能下调胃癌组织中VEGF, KDRmRNA的表达见图2, 3.
VEGF有4种异构体, 即VEGF121, VEGF165, VEGF189, VEGF206, 其中VEGF165是主要分泌分子, 也是主要效应分子, VEGF121作用稍弱, 二者以旁分泌形式促进血管内皮细胞分裂增生, 增加微血管通透性, 促进肿瘤浸润和转移. 肿瘤的恶性度越高、体积越大、转移越广的癌细胞内VEGFmRNA含量就越高. VEGF受体目前发现至少有2种以上, 即fms样酪氨酸激酶Flt和胎儿肝激酶-1/含激酶插入功能区受体KDR, 二者均为酪氨酸激酶受体, KDR主要表达于生长期的血管内皮细胞上, 是VEGF发挥主要功能的受体, 是VEGF诱导血管生成的主要通路[11]. KDR与其配体结合后其胞内信号传导机制可能是通过VEGFRs二聚化, 受体酪氨酸激活, 促使底物磷酸化而产生促进内皮细胞增生, 提高血管通透性, 改变细胞外基质的作用.
祖国医学认为肿瘤的形成主要是痰、瘀、毒互结而成[12]. 中医理论的痰既是一种脏腑功能失调后的病理产物, 同时又是一种致病因素, 他形成后阻于脏腑经络中, 一方面可致气滞血瘀, 结而成块; 另一方面, 又可随气升降流行附注于其他部位形成新的病灶, 这一特点与肿瘤的生物学行为非常相类似. 因此痰瘀交阻与肿瘤的形成和转移密切相关. 消痰散结方主要由半夏、南星等燥湿化痰药组成, 针对肿瘤痰瘀互结的特性, 以化痰除痞、散结聚、消除肿块为目的, 进而阻断肿瘤的生长和转移[13-14]. 中医辩证发现, 临床患者均具有不同程度的痰瘀互结的现象, 采用消痰散结中药治疗一段时间后, 病情可得到不同程度的缓解, 血清VEGF水平明显下降[2]. 本研究结果发现, 中药组远处脏器转移率明显低于荷瘤对照组及5-FU化疗组, 且中药组、荷瘤对照组在目的基因片断处均出现DNA条带, 但中药组条带的宽窄及深浅与对照组均不一致, 经计算机图像分析其面积灰度值表明, 消方可使VEGF121, VEGF165, KDRmRNA表达水平显著下降, 且在消方组中癌组织内VEGF, KDRmRNA表达量较化疗组癌组织表达量亦明显下降. 提示消方可能通过下调VEGF, KDR基因进而起到抑制胃癌的生长及转移的作用, 也有可能通过竞争性地抑制VEGF与其受体KDR的结合来抑制新生血管形成, 来达到抑制肿瘤的生长转移.
编辑: N/A
| 2. | 魏 品康, 许 玲, 秦 志丰, 张 申, 李 相勇, 郭 晓东, 王 建平, 李 峻, 肖 艳, 施 俊. 胃癌从痰论治的机制与临床研究. 中国中医基础医学杂志. 2002;3:18-20. |
| 3. | Folkman J, Watson K, Ingber D, Hanahan D. Induction of angiogenesis during the transition from hyperplasia to neoplasia. Nature. 1989;339:58-61. [DOI] |
| 5. | Kamei S, Kono K, Amemiya H, Takahashi A, Sugai H, Ichihara F, Fujii H, Matsumoto Y. Evaluation of VEGF and VEGF-C expression in gastric cancer cells producing alpha-fetoprotein. J Gastroenterol. 2003;38:540-547. [PubMed] |
| 6. | Gururaj AE, Belakavadi M, Salimath BP. Antiangiogenic effects of butyric acid involve inhibition of VEGF/KDR gene expression and endothelial cell proliferation. Mol Cell Biochem. 2003;243:107-112. [PubMed] [DOI] |
| 7. | Lewy-Trenda I, Wierzchniewska-Ławska A. Expression of vascular endothelial growth factor (VEGF) in human thyroid tumors. Pol J Pathol. 2002;53:129-132. [PubMed] |
| 8. | Tang K, Breen EC, Wagner PD. Hu protein R-mediated posttranscriptional regulation of VEGF expression in rat gastrocnemius muscle. Am J Physiol Heart Circ Physiol. 2002;283:H1497-H1504. [PubMed] [DOI] |
| 9. | Mints M, Blomgren B, Falconer C, Palmblad J. Expression of the vascular endothelial growth factor (VEGF) family in human endometrial blood vessels. Scand J Clin Lab Invest. 2002;62:167-175. [PubMed] [DOI] |
| 10. | Wang D, Lehman RE, Donner DB, Matli MR, Warren RS, Welton ML. Expression and endocytosis of VEGF and its receptors in human colonic vascular endothelial cells. Am J Physiol Gastrointest Liver Physiol. 2002;282:G1088-G1096. [PubMed] [DOI] |
| 11. | Waltenberger J, Claesson-Welsh L, Siegbahn A, Shibuya M, Heldin CH. Different signal transduction properties of KDR and Flt1, two receptors for vascular endothelial growth factor. J Biol Chem. 1994;269:26988-26995. [PubMed] |
| 14. | 钱 彦方. 肿瘤从痰论治探讨. 中国中医基础医学杂志. 1999;5:42-44. |