修回日期: 2004-01-01
接受日期: 2004-02-01
在线出版日期: 2004-04-15
随着医学科学的迅速发展, 肝移植和肝癌手术已逐渐成为普遍的手术. 然而, 供肝的保存和肝癌手术时, 肝门部常温阻血后的再灌注损伤是导致移植肝脏和肝癌术后的肝脏功能不良的重要因素. 当肝脏的缺血再灌注时, Ca2+细胞内大量流入, 引起与Ca2+依赖性水解蛋白酶(calpain )的活性化(初期反应变化)为十分重要的基点. 我们曾经通过TBHP(tert-butyl hydroperxride)处理培养肝细胞, 发现细胞内Ca2+的大量流入, 从而发现及确定了calpain 的活性化出现, 继而发现了细胞膜bleb的形成, 造成细胞骨骼蛋白如talin、-actinin酶系统的大量分解. 我们曾在大白鼠的动物模型中, 以68%肝门部常温阻血10 min, 再灌注5 min, 反复重复6次共缺血1 h, 但未发现calpain 的出现. 在人体肝脏手术中, 肝门常温阻血12 min也同样地未发现calpain 的出现. 另外, 在肝门部常温阻血前静脉注射prostaglandin I2 (PGI2)的诱导体OP2507、prostaglandin E1 (PGE1)或prednisolone, 发现即使肝门部常温阻血25 min, 也未发现calpain 的出现.
引文著录: 王蒙, 沈锋, 李锡锋, 陈旭, 吴孟超. Calpain 与肝脏的缺血再灌注损伤. 世界华人消化杂志 2004; 12(4): 969-971
Revised: January 1, 2004
Accepted: February 1, 2004
Published online: April 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(4): 969-971
- URL: https://www.wjgnet.com/1009-3079/full/v12/i4/969.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i4.969
在肝切除及肝移植手术中, 缺血再灌注损伤是不可避免的重要复杂问题. 众所周知, 肝脏是一个非常脆弱和容易出血的脏器. 自从1908年Prlingle [1]首先报道了肝两叶安全阻血方法以来, 此方法已经逐渐引起世界各国肝脏外科界的极大重视. 预防肝脏缺血再灌注损伤, 在肝移植和肝癌合并肝硬化手术中是非常重要的. 对于肝脏外科医生来说, 如果能有安全的1 h全肝血流阻断时间, 安全的肝切除术便能够得到很好的实施. 这样不仅减少出血量, 而且还可以避免输血所带来的一系列不良反应, 如肝炎(不同型)、HIV感染等. 所以对于寻找肝脏的缺血再灌注损伤的预防方法, 在肝脏外科日常手术中是至关重要的.
近年来, 对于肝脏的缺血再灌注损伤这一问题已经引起了许多研究者的极大重视, 并且做了大量的研究工作, 但依然未解明其全貌, 对其根本原因和机制并未有一个明确的解释. 肝脏的缺血再灌注损伤所引起的细胞反应如同"水面落石"所引起涟漪现象. 我们的研究是从肝脏的缺血再灌注损伤所引起的细胞分子结构, 细胞外的Ca2+的流入, 从而引起Ca2+依赖性蛋白水解酶(calpain )的活性化的初期反应这一重要和致命过程来着手的.
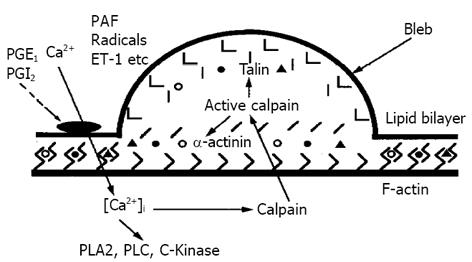
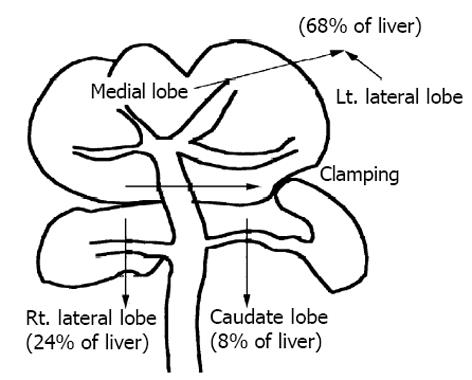
引起肝组织损害大体分为细胞外因素(细胞性和液性因素)和细胞内因素(细胞损害机构), 二者之间相互影响, 即使前者较显著受到影响, 后者的反应受到抑制, 所造成细胞损害也较轻微. 故从后者的细胞内损害机制来考虑肝脏的缺血损伤机制(图1). 当缺血再灌注时引起血流中诸多的因子, platelet-activating factor (血小板活性化因子)[2], endothelin (内皮因子)[3], surperoxide (过氧化物)[4]等大量增加, 从而引起细胞外Ca2+的大量流入细胞内, 细胞内Ca2+的大量增加从而引起Ca2+依赖性酶系统的活性化, 如: phospholipase C(磷酸脂质酶C)[5], calmodulin(钙调节蛋白)[6]依赖性kinase和calpain [7]等, 导致细胞凋亡的重要因素. 细胞膜存在的酶系统在维持细胞骨骼上起着非常重要的作用.
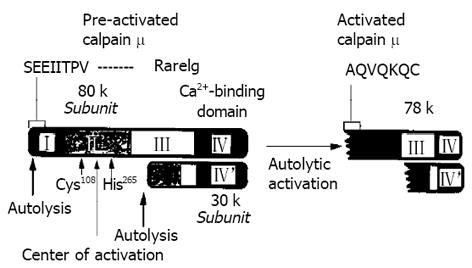
许多研究结果表明, 在这些酶系统中calpain是最敏感而又重要的枪机[8-12]. 近来有研究者报道calpain存在于很多的细胞膜上[13]. 在正常情况下, 细胞膜上的calpain是没有活性的. 当各种原因造成细胞环境改变时, 并且激活了calpain的活性时, 使其活性化. 自1964年由Goll et al[14]首先在大白鼠脑细胞中发现calpain的存在, 但对其作用及机制并没有明确阐述. 直到1976年由Dayton et al[15]解明了calpain 是与Ca2+相依赖的. calpain 的活性化必须由Ca2+激活. 由于Ca2+所流入的量不同以及各种细胞内所含量不同, 如心肌细胞和骨骼肌细胞及血小板中含量较多, 故引起calpain 可分为两种, 即M和m M(图2). 当细胞内Ca2+的浓度(M水平)增加时, 切断了calpain 构造式Ⅱ的中心Cys108和His265的结构, 从而使calpain构造式Ⅰ破裂, 继而使calpain的活性型(80 k)被降解到活性化型(78 k).
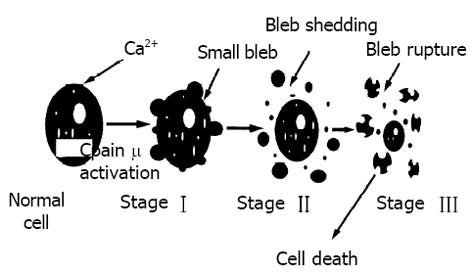
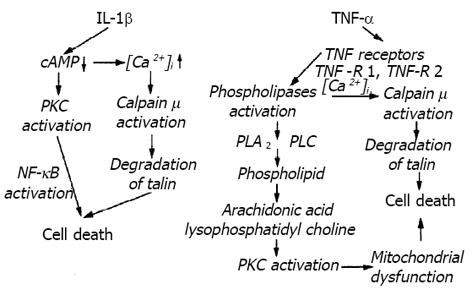
当calpain 活性降解后, 从而引起细胞膜上的酶如talin、-actinin的分解. 同时引起线粒体膜电位的改变, 进而导致细胞膜的Bleb出现, 最终导致细胞崩溃而凋亡. 另外, bleb的形成大致分为3个阶段(图3): 小的bleb, bleb的脱落和bleb的崩解. bleb的崩解可引起细胞不可逆性的损害. 研究还表明, 由于细胞内Ca2+的大量增加, 从而引起细胞内ATP减少, 使其降解为ADP-AMP, 同时也使Na+-K+-ATP酶活性减低, 导致细胞内Na+浓度增高, 从而激活细胞膜上Na+/Ca2+交换蛋白, 使细胞内Ca2+浓度增高的恶性循环. 另外, ATP大量降解使细胞内线粒体严重水肿, 最终导致细胞死亡. 在研究中还发现, 肝脏缺血再灌注可以引起细胞的cytokine, 如interleukin 1(IL-1)和tumor necrosis factor (TNF-)大量产生. 一方面, 当IL-1的大量产生, 可以使cAMP降解, 造成细胞内Ca2+浓度的增加, 使得calpain 活性化, 同时也使talin降解, 导致细胞凋亡. 另一方面, 由于TNF-的产生, 刺激了TNF的感受器TNF-R1和TNF-R2, 使磷脂酶活性化. 1996年Arora和Gores曾报道过当磷脂酶被活性化时, 更加使得calpain的活性化递增, 这样可以加速细胞的凋亡.
用TBHP (tert-butyl hydroperxride)处理后的肝细胞使细胞内Ca2+浓度上升, 从而激活calpain 的活性, 发现细胞膜的bleb形成, 同时talin 等的细胞骨骼蛋白分解也被证实[16].
研究者曾以68%大白鼠的肝温缺血1 h和2 h再灌注模型中(图 4), 在缺血前30 min从阴茎静脉注射PGI2的诱导体(OP-2507)或prednisolone, 来测定投入组和对照组的胆汁流量、血流量、AST和ALT的值、细胞膜的bleb形成、calpain 、talin及cytokine等, 发现投入组与对照组间有明显差异. 所以, 在肝缺血前, 静脉注射PGI2或prednisolone等, 对肝脏功能的保护起着非常重要的作用, 尤其是对长期肝硬化及肝硬化较重的患者来讲, 更是十分重要的[17].
研究者以68%间歇性肝温缺血1 h和再灌注2 h (图5)分为3个组: 1组是缺血10 min, 间歇5 min, 连续6次共缺血1 h后再灌注2 h; 2组是缺血15 min, 间歇5 min, 连续4次共缺血1 h后再灌注2 h; 3组是缺血20 min, 间歇5 min, 连续3次, 共缺血1 h后再灌注2 h. 以能否引起肝细胞膜的bleb的形成, 能否引起calpain 的活性化, 同时能否引起talin的分解. 对ATP及energy charge进行测试, 发现在间歇性缺血1 h后的第3组和2 h后再灌注的第2组和第3组均发现calpain 和talin的表达, 同时在电子及光学显微镜下发现bleb的形成. 研究者还测得了第3组在再灌注2 h后ATP及能量降解, 同时在电子显微镜下观察到了线粒体水肿及膨大.
总之, 间歇性的肝温缺血10 min, 再灌注5 min的连续操作的方法对于肝脏手术较为安全. 在肝脏外科手术中尤其是肝癌伴有活动性肝炎(乙型或丙型)来说, 术后能否引起肝功能衰竭是至关重要的原则. 我们绝对不能轻视这一点. 如果不注意不重视这一个环节, 将给肝脏手术后因肝功能衰竭带来危及患者的生命.
研究者已经确立了PGI2、PGE1和prednisolone对肝温缺血再灌注损伤的保护作用. 在肝脏外科及肝移植手术中, 缺血再灌注损伤是不可避免的. 那么如何来抑制缺血再灌注所带来的肝脏损害, 能否较安全的延长缺血时间, 是研究中一直关注的问题.
在肝切除手术中, 研究者曾以上述同样的方法进行了12 min的肝门部常温阻血, 发现肝活检中calpain 没有表达. 研究者还发现在肝门阻血前投入PGE1, 缺血时间延长到20-25 min, 其肝组织活检中calpain 也未被发现. 由此可见, 肝温阻血前投入PGE1 后, 25 min的肝温阻血是较为安全的时间.
近年来, 许多同行界对肝缺血再灌注损伤问题有种种看法, 尤其是对肝门部常温阻血时间纷说不一. 更重要的是对肝硬化较重的同时伴有活动性肝炎的肝癌患者, 到底在肝切除后能否引起肝功能衰竭, 行多长时间的肝门部阻血较为安全, 至今没有一个明确的报道. 我们从细胞膜及膜上酶系统的着眼, 较精确的科学的研究其损伤机制的全部过程, 并得到了肝安全温缺血的时间以及抑制肝温缺血再灌注损伤的方法.
编辑: N/A
| 1. | Pringle JH. V. Notes on the Arrest of Hepatic Hemorrhage Due to Trauma. Ann Surg. 1908;48:541-549. [PubMed] [DOI] |
| 2. | Wang KS, Monden M, Kanai T, Gotoh M, Umeshita K, Ukei T, Mori T. Protective effect of platelet-activating factor antagonist on ischemia-induced liver injury in rats. Surgery. 1993;113:76-83. [PubMed] |
| 3. | Kobayashi J, Takeyoshi I, Ohwada S, Iwanami K, Matsumoto K, Muramoto M, Morishita Y. The effects of FR167653 in extended liver resection with ischemia in dogs. Hepatology. 1998;28:459-465. [PubMed] [DOI] |
| 4. | Nakano H, Monden M, Umeshita K, Murata M, Miyoshi H, Kanai T, Gotoh M, Mori T. Cytoprotective effect of prostaglandin I2 analogues on superoxide-induced hepatocyte injury. Surgery. 1994;116:883-889. [PubMed] |
| 5. | Aderem A. Signal transduction and the actin cytoskeleton: the roles of MARCKS and profilin. Trends Biochem Sci. 1992;17:438-443. [PubMed] [DOI] |
| 6. | Nairn AC, Picciotto MR. Calcium/calmodulin-dependent protein kinases. Semin Cancer Biol. 1994;5:295-303. [PubMed] |
| 7. | Miyoshi H, Umeshita K, Sakon M, Imajoh-Ohmi S, Fujitani K, Gotoh M, Oiki E, Kambayashi J, Monden M. Calpain is activated in hepatocyte mitochondrion during ischemia-reperfusion injury. Hepatol Res. 1998;10:255-259. [DOI] |
| 8. | Beckerle MC, O'Halloran T, Burridge K. Demonstration of a relationship between talin and P235, a major substrate of the calcium-dependent protease in platelets. J Cell Biochem. 1986;30:259-270. [PubMed] [DOI] |
| 9. | Fox JE, Goll DE, Reynolds CC, Phillips DR. Identification of two proteins (actin-binding protein and P235) that are hydrolyzed by endogenous Ca2+-dependent protease during platelet aggregation. J Biol Chem. 1985;260:1060-1066. [PubMed] |
| 10. | Chen JJ. Anti-inflammatory steroid action, basic and clinical aspects. In: Schleimer RP, Claman HN, Oronsky AL, eds. San Diego Acad Press 1989; 111-131. |
| 11. | Wang M, Sakon M, Miyoshi H, Umeshita K, Kishimoto S, Taniguchi K, Gotoh M, Imajoh-Ohmi S, Monden M. Prostacyclin analog-suppressed ischemia-reperfusion injury of the rat liver: evaluation by calpain mu activation. J Surg Res. 1997;73:101-106. [PubMed] [DOI] |
| 12. | Wang M, Sakon M, Umeshita K, Miyoshi H, Taniguchi K, Kishimoto S, Imajoh-Ohmi S, Monden M. Determination of a safe vascular clamping method for liver surgery: evaluation by measuring activation of calpain mu. Arch Surg. 1998;133:983-987. [PubMed] [DOI] |
| 13. | Auphan N, DiDonato JA, Rosette C, Helmberg A, Karin M. Immunosuppression by glucocorticoids: inhibition of NF-kappa B activity through induction of I kappa B synthesis. Science. 1995;270:286-290. [PubMed] [DOI] |
| 14. | Goll DE, Kleese WC, Okitani A, Kumamoto . Historical background and current status of the Ca2+-dependent proteinase system. Mellgren RL, Murachi T, eds Calcium dependent proteolysis in mammalian cells. Boca Raton: CPC Press 1990; 3-24. |
| 15. | Dayton WR, Goll DE, Zeece MG, Robson RM, Reville WJ. A Ca2+-activated protease possibly involved in myofibrillar protein turnover. Purification from porcine muscle. Biochemistry. 1976;15:2150-2158. [PubMed] [DOI] |
| 16. | Miyoshi H, Umeshita K, Sakon M, Imajoh-Ohmi S, Fujitani K, Gotoh M, Oiki E, Kambayashi J, Monden M. Calpain activation in plasma membrane bleb formation during tert-butyl hydroperoxide-induced rat hepatocyte injury. Gastroenterology. 1996;110:1897-1904. [PubMed] [DOI] |