修回日期: 2003-12-01
接受日期: 2003-12-08
在线出版日期: 2004-04-15
目的: 探讨银杏叶提取物对实验性大鼠肝纤维化的预防及治疗作用机制.
方法: 采用四氯化碳腹腔注射诱导的大鼠肝纤维化模型, 60只Wistar大鼠分为5组: 模型组、银杏叶干预组、银杏叶治疗组、银杏叶组, 另设正常对照组, 应用HE染色观察大鼠肝组织的改变及Von-Gieson胶原纤维特殊染色观察肝纤维化程度, 并采用免疫组织化学染色法及RT-PCR法检测肝组织I型胶原、TGF-1蛋白和mRNA的表达.
结果: 银杏叶干预及治疗组与模型组相比肝组织结构明显改善、纤维化增生程度减轻; 肝组织内I型胶原、TGF-1的含量(I型胶原: 0.2 563±0.0 009 vs 0.2 885±0.0 025, 0.2 541±0.0 076 vs 0.2 885±0.0 025, P<0.01; TGF-1: 0.2 785±0.0 012 vs 0.3 015±0.0 012, 0.2 791±0.0016 vs 0.3 015±0.0 012, P<0.01)以及mRNA的表达均明显低于模型组(I型胶原: 0.0 778±0.054 vs 0.2 361±0.113, 0.1 075±0.007 vs 0.2 361±0.113, P<0.01; 0.523±0.015 vs 0.956±0.049, 0.524±0.009 vs 0.956±0.049, P<0.01); 银杏叶组与正常对照组之间无差异.
结论: 银杏叶提取物可抑制肝星状细胞激活和转化, 下调I型胶原、TGF-1蛋白质及其mRNA的表达, 从而抑制或逆转纤维化形成.
引文著录: 胡伟, 时昭红, 马庭芳, 于皆平. 银杏叶提取物抗大鼠肝纤维化的作用. 世界华人消化杂志 2004; 12(4): 886-891
Revised: December 1, 2003
Accepted: December 8, 2003
Published online: April 15, 2004
AIM: To study the effects of Ginko biloba extract (EGb) on hepato-fibrosis induced by carbon tetrachloride (Cl4) in rat model.
METHODS: Rat liver fibrosis model was induced by Cl4 administration. Wistar rats were randomly divided into 5 groups: normal control group, a model group, a interven-tional group, a therapeutic group, and a EGb group. The EGb interventional group, apart from administration of Cl4, was treated concurrently with EGb 0.3 g/kg, ig once a day; the EGb therapeutic group was treated with EGb 0.3 g/kg, ig once a day after cirrhosis was induced successfully, and the EGb group was treated only with EGb 0.3 g/kg, ig once a day. At the end of wk 8 and 16, all the rats were sacrificed. The pathological changes of liver were observed by H-E and Von-Gieson staining.The expression of mRNA and proteins of collagen I/TGF1 in liver were determined by RT-PCR and immunohistochemistry.
RESULTS: The degree of liver fibrosis and level of mRNA and proteins of collagen I/TGF1 in liver were significantly reduced in the EGb interventional and therapeutic groups compared with those in the model group (type I collagen mRNA: 0.0 778±0.054 vs 0.2 361±0.113, 0.1 075±0.007 vs 0.2 361±0.113, P < 0.01; type I collagen proteins: 0.2 563±0.0 009 vs 0.2 885±0.0 025, 0.2 541±0.0 076 vs 0.2 885±0.0 025 , P < 0.01; TGF1 mRNA: 0.523±0.015 vs 0.956±0.049 , 0.524±0.009 vs 0.956±0.049, P < 0.01; TGF1 proteins: 0.2 785±0.0 012 vs 0.3 015±0.0 012, 0.2 791±0.0 016 vs 0.3 015±0.0 012, P < 0.01).The EGb group had the same results as the normal control group.
CONCLUSION: EGb has prophylactic and therapeutic effects on CCl4-induced rat liver fibrosis, probably through its anti-lipoperoxidation, suppressing the activation of hepatic stellate cells and transition and reducing the synthesis of hepatic type I collagen and TGF1.
- Citation: Hu W, Shi ZH, Ma TF, Yu JP. Effects of Ginkgo biloba extract on liver fibrosis induced by carbon tetrachloride in rats. Shijie Huaren Xiaohua Zazhi 2004; 12(4): 886-891
- URL: https://www.wjgnet.com/1009-3079/full/v12/i4/886.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i4.886
肝纤维化是一切慢性肝病发展至肝硬化的必经之路, 是由于肝脏细胞外基质(ECM)合成和降解失衡, 最终引起ECM过渡沉积所致[1-8]. 其中转化生长因子1(TGF-1)被认为是肝纤维化形成过程中重要的始动刺激因子之一[9-12]. 虽然普遍认为肝纤维化在一定条件下是可以逆转的, 但至今仍缺乏有效的抗纤维化药物. 银杏叶提取物(EGb)主要药理成分为黄酮甙和银杏内酯, 具有广泛的生物学作用[13-18], 主要包括清除氧自由基、抑制脂质过氧化、改善微循环等. 银杏叶提取物具有防止肝损伤, 治疗肝纤维化的作用[19]. 我们选用CCl4诱导的大鼠肝纤维化模型, 旨在进一步探讨EGb抗肝纤维化作用的机制, 为EGb的临床应用提供理论依据.
SPF级, ♂Wistar大鼠60只, 体质量160±20 g, 购于湖北省实验动物中心; EGb由武汉市一医院中药制剂室提供, 经湖北午时药业股份有限公司检验, 编号02-391; CCl4, 郑州化学试剂二厂产品; I型胶原、TGF-1 多克隆抗体及兔抗鼠SP试剂盒为北京中山生物制品公司产品; Trizol购自Gibco公司; 逆转录酶MMLV, Oligo(dT)18, Tac酶, MixdNTP均为Promega公司产品; RNA酶抑制剂为大连宝生物工程有限公司产品; TGF1和I型胶原及磷酸甘油醛脱氢酶(GAPDH)基因引物序列为TGF1: 上游 5'-TGAGTGGCTGTCTTTTGA CG-3', 下游5'-ACTTCC AACCCAGGTCCTTC-3'; I型胶原: 上游 5'-TACTACCGGGCCGATGATGC-3', 下游5'-TCCTTGGGGTTTGGGCTGATGTA-3'; GAPDH: 上游5'-TCCCTC AACATTGTCAGCAA-3', 下游5'-AGCTCCACAACGGATACATT-3', 均由上海生物工程制品公司合成; HPIAAS-2000彩色图文分析系统; Biotra PCR扩增仪, Eppendorf低温离心机, 紫外分光光度仪等; Eppendorf 低温离心机, Biometra UNOII PCR扩增仪, PE-Lamda 25UV紫外分光光度计, HW-8B型超级微量恒温器, Bio-Rad 电泳仪, Bio-Rad GELDOC-2000紫外凝胶成像系统.
将60只大鼠随机分为5组: 正常对照组10只, 模型组18只, 银杏叶干预组12只, 银杏叶治疗组14只, 银杏叶组6只, 各组间暴露因素无差异. 模型组、干预组及治疗组均给予CCl4+石蜡油1: 1(V: V)混合, 腹腔注射8 wk, 1 mL/kg, 2次/wk. 干预组同时给予银杏叶制剂悬浊液0.3 g/kg灌胃, 1次/d. 模型组和治疗组在8 wk中共有6只死亡. 此后治疗组给予银杏叶制剂悬浊液0.3 g/kg灌胃, 1次/d, 共8 wk. 正常对照组给予生理盐水1 mL/kg, 腹腔注射8 wk. 银杏叶组仅给予银杏叶制剂悬浊液0.3 g/kg, 1次/d. 实验总周数为16 wk. 所有的动物都给予自来水及标准大鼠饲料喂养, 每12 h灯照及黑暗交替. 最后1次用药后3 d处死大鼠. 肝脏标本取右叶相同的部分以40 g/L甲醛固定, 3 d内石蜡包埋备组织病理学检测; 余下肝脏于液氮中速冻、-80 ℃冰箱内保存, 备肝组织匀浆测组织生化、抽提组织RNA.
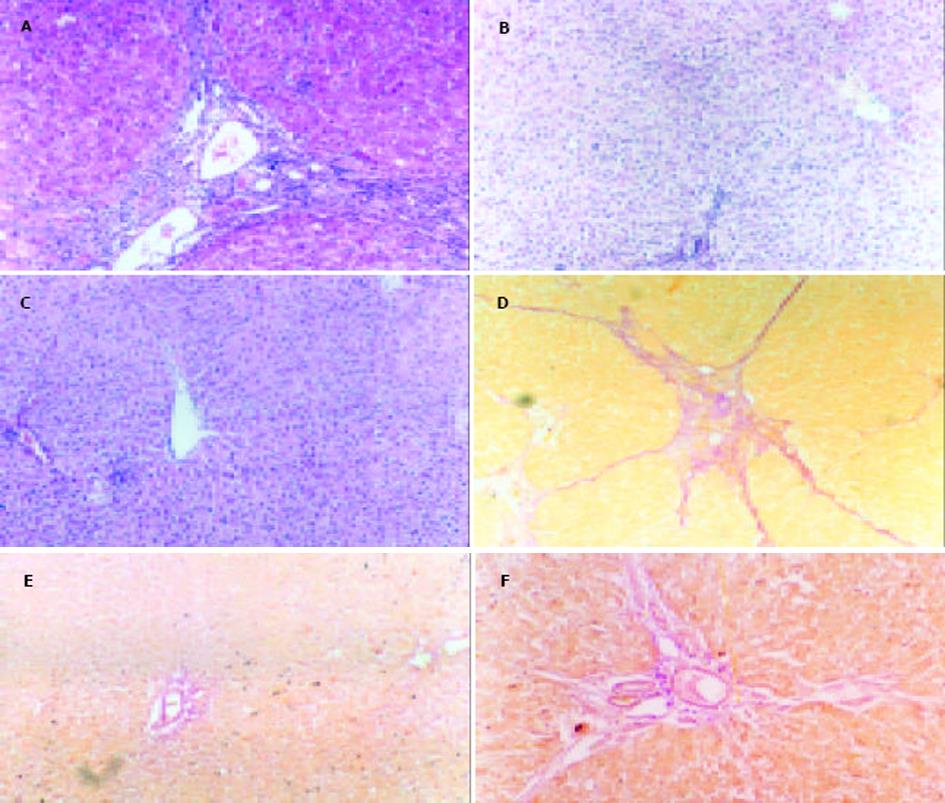
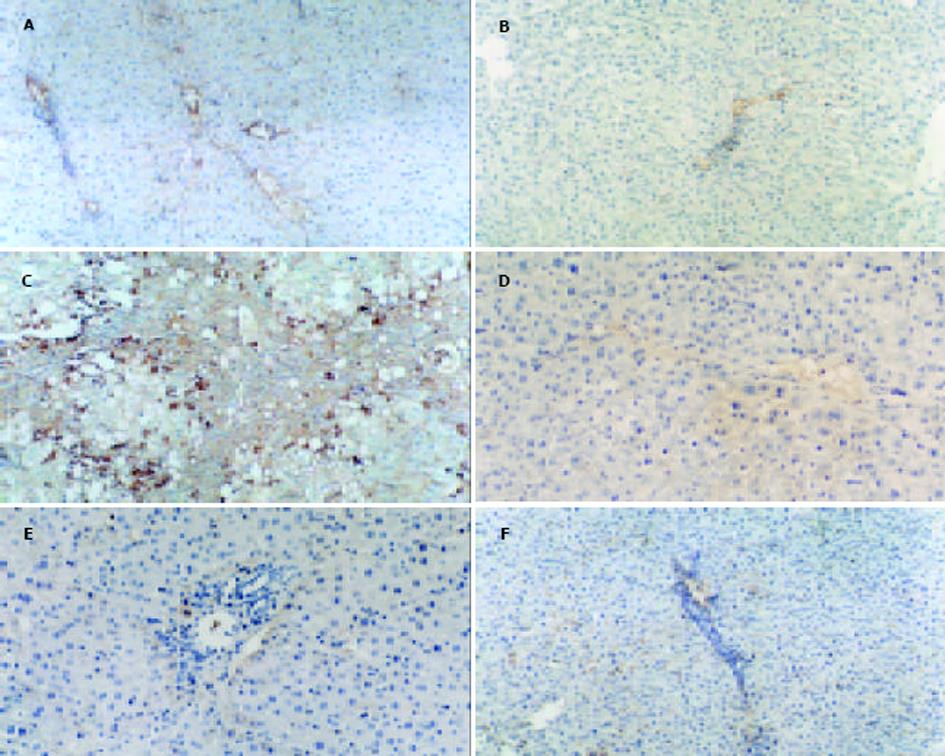
1.2.1 病理学研究: 肝组织分别用HE染色和Von-Gieson胶原纤维染色法检测肝纤维化组织病理学, 按照改良Knodell评分标准[20]进行纤维化程度评估: 0级, 无纤维化; 1级, 汇管区扩大, 轻度纤维化; 2级, 汇管区周围纤维化, 纤维隔形成, 小叶结构保留; 3级, 纤维隔伴小叶结构紊乱, 无肝硬化; 4级, 早期肝硬变或肯定的肝硬化. 肝组织I型胶原、TGF-1蛋白的免疫组化采用PAP法DAB显色. I型胶原、TGF-1表达程度应用HPIAAS-2000彩色医学图像分析仪, 对各组切片随机选取10个视野测量其光密度值, 取其平均值作为该切片的平均光密度值(MOD).
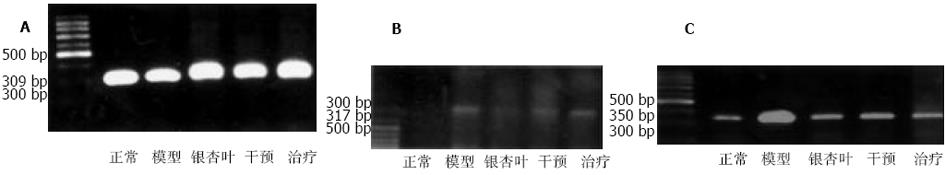
1.2.2 I型胶原、TGF-1mRNA表达: 取50-100 mg左右冻存标本放入0.5 mL玻璃匀浆器中加Trizol 1 mL室温下匀浆, 抽提组织RNA, 加氯仿0.2 mL, 4 ℃, 12 000 g下低温离心15 min, 取上清加等体积异戊醇 4 ℃, 12 000 g下低温离心10 min, 750 mL/L乙醇1 mL洗涤, 加dd H2O 30-50 L, 55-60 ℃温浴10 min. 紫外分光光度仪检测吸光度A值. -80 ℃冰箱内保存. 取RNA 2 g加上dd H2O及Oligo (dT) 1 L置于70 ℃水浴箱内5 min, 冰上5 min, 加MMLV buffer, dNTP, RNA酶及其抑制剂、ddH2O共25 L, 于42 ℃温浴90 min. 反应总体积为25 L, 含Taq酶Buffer 2.5 L, d NTP Mix (2.5 moL/L) 2 L, Taq酶1 U, Pimer (mix)1 L, c DNA 1 L, 加双蒸水达25 L体系混匀后离心15 s. TGF1的扩增条件: 95 ℃ 3 min 预变性, 开始循环: 95 ℃ 30 s, 54 ℃ 30 s, 72 ℃ 45 s. 共循环 35次, 最后彻底延伸于72 ℃ 7 min, 4 ℃保存, 扩增产物长度为350 bp. I型胶原的扩增条件: 95 ℃ 3 min 预变性, 开始循环: 95 ℃ 30 s, 57 ℃ 30 s, 72 ℃ 45 s. 共循环 35次, 最后彻底延伸于72 ℃ 7 min, 4 ℃保存, 扩增产物长度为317 bp. GAPDH的扩增条件: 95 ℃3 min 预变性, 开始循环: 95 ℃ 30 s, 54 ℃ 30 s, 72 ℃ 45 s. 共循环 35次, 最后彻底延伸于72 ℃ 7 min, 4 ℃保存, 扩增产物长度为309 bp. PCR产物经2%琼脂糖凝胶, 25 mV, 50 mA下电泳. 电泳结果经Fluros-Multimager扫描仪扫描成像. 用Multi-Analyst software package进行PCR产物半定量, TGF1和I型胶原mRNA相对含量用TGF1和I型胶原的积分光密度值与GAPDH的积分光密度值的比值表示.
统计学处理 计量资料以mean±SD 表示. 应用SPSS 1.0统计软件包处理分析. 纤维化程度以等级资料表示, 并采用Ridit检验进行分析. P<0.05有统计学意义.
模型组HE染色可见多数正常肝小叶结构破坏或消失, 由汇管区伸出较粗大的胶原纤维条索, 分割、包绕肝小叶形成假小叶, 肝细胞索排列紊乱, 肝细胞浊肿明显, 并见广泛的脂肪变性, 部分肝细胞坏死. 纤维隔内有大量单核、淋巴、嗜酸性细胞及成纤维细胞浸润; VG胶原染色可见红色胶原纤维大量增生, 汇管区-中央静脉区纤维间隔宽大, 增生的肝细胞被胶原纤维包绕、分割成大小不等的假小叶, 部分肝脏已形成典型肝硬化的改变. 银杏叶干预组肝细胞有不同程度变性、坏死, 汇管区及小叶间有少量纤维组织增生, 与模型组比较差异显著, 肝纤维化程度计分显示与模型组有明显差异(P<0.05); 治疗组肝细胞也有不同程度变性、坏死, 汇管区及小叶间有少量纤维组织增生, 部分向小叶内伸展, 纤维间隔变细, 肝纤维化程度计分也显示与模型组有明显差异(P<0.05, 表1, 图1).
正常对照组和银杏叶组肝组织几乎不表达TGF-1, 模型组TGF-1阳性细胞主要位于中央小叶和门静脉周围纤维带及肝纤维间隔中, 主要见于Kuffer细胞、类间质细胞质及其周围; EGb干预及治疗组阳性染色程度较模型组明显减轻. 正常对照组和银杏叶组肝组织I型胶原蛋白主要存在于中央静脉、门脉区三联管管周及管间纤维组织, 模型组I型胶原阳性细胞染色明显增多, 除汇管区、中央静脉周围增多外, 在纤维间隔内弥漫分布; 而EGb干预及治疗组I型胶原蛋白主要位于中央静脉和门静脉周围纤维带(表2, 图2).
肝星状细胞(HSC)活化是肝纤维化发生的核心环节, 氧化应激及脂质过氧化是引起肝细胞损伤与HSC活化的重要机制[21-26]. 肝损伤产生的氧自由基及细胞因子等激活HSC, 产生大量以I型胶原为主的间质胶原, 引起细胞外基质(ECM)数量和质量上的变化, 最终导致肝纤维化的发生[27-31]. 因此, 抑制HSC的激活, 减轻细胞因子对其的影响成为防治肝纤维化的关键. 银杏叶提取物(EGb)是天然的血小板活化因子拮抗剂. 其主要成分银杏黄酮甙类有较强的抗氧化作用[13-17]. 黄酮苷的母核中含有还原性羟基功能基团, 可直接清除O2-,/OH, H2O2等氧自由基, 并能捕获脂质自由基、脂过氧自由基、脂氧自由基和烷自由基等基团, 终止自由基连锁反应链, 从而抑制氧自由基反应和脂质过氧化反应, 抑制MDA、共轭二烯等毒性物质的生成, 增强自由基反应酶类如SOD, GST-PX等的活性, 减缓氧自由基和脂质过氧化损伤. 国内已有资料表明[19], EGb通过抗氧化应激抑制NF-B诱导的HSC活化, 抑制肝纤维化的发生.
我们利用CCl4诱导实验性肝纤维化模型, 同时用EGb干预和治疗, 结果显示, 实验性大鼠腹腔注射CCl4 8 wk后肝表面可见大小不一的颗粒, 镜下可见胶原纤维大量沉积于汇管区, 围绕肝再生结节, 成功诱导出肝纤维化. 干预组8 wk后大鼠均无明显肝纤维化形成, 与正常对照组相比, 除肝细胞排列紊乱外, 汇管区无胶原纤维沉积; 治疗组8 wk后肝纤维化的程度也明显改善, 汇管区及小叶间仅有少量纤维组织增生, 部分向小叶内伸展, 证实EGb具有防治CCl4诱导实验性肝纤维化的作用. 免疫组化则显示正常对照组及银杏叶组I型胶原的表达仅见于汇管区, 而模型组中, I型胶原阳性细胞染色明显增多, 其分布除汇管区、中央静脉周围增多外, 在肝纤维隔内也呈弥漫分布, EGb干预及治疗组I型胶原阳性细胞免疫组化染色程度明显弱于模型组; 正常对照组及银杏叶组TGF1几乎不表达, 模型组TGF-1阳性细胞主要位于中央小叶和门静脉周围纤维带及肝纤维间隔中, EGb干预及治疗组阳性染色程度较模型组明显减轻. 同样, 利用RT-PCR检测肝组织I型胶原和TGF1 mRNA的相对含量也表明正常及EGb组大鼠的表达很弱, 而模型组I型胶原和TGF1 mRNA显著增强, EGb干预及治疗组则明显低于模型组, 二者有显著差异(P<0.0 001). 提示EGb可能通过减轻氧自由基和脂质过氧化对肝细胞的损伤, 抑制HSC的增生, 减少 TGF-1 mRNA的表达, 从转录水平降低了I型胶原mRNA的生成, 最终抑制/逆转肝纤维化的发生, 并且无毒副作用. 此为EGb应用于肝纤维化的防治提供了理论依据.
编辑: N/A
| 2. | Yao XX, Tang YW, Yao DM, Xiu HM. Effects of Yigan Decoction on proliferation and apoptosis of hepatic stellate cells. World J Gastroenterol. 2002;8:511-514. [PubMed] [DOI] |
| 4. | Liu YK, Shen W. Inhibitive effect of cordyceps sinensis on experimental hepatic fibrosis and its possible mechanism. World J Gastroenterol. 2003;9:529-533. [PubMed] [DOI] |
| 5. | Wang ZR, Chen XM, Li DG, Wei HS, Huang X, Zhan YT, Lu HM. Suppression of expression extracellular matrix in hepatic fibrosis rat with tetrandrine and glycyrrhizinic acid. Shijie Huaren Xiaohua Zazhi. 2003;11:970-974. [DOI] |
| 7. | Schaefer B, Rivas-Estilla AM, Meraz-Cruz N, Reyes-Romero MA, Hernández-Nazara ZH, Domínguez-Rosales JA, Schuppan D, Greenwel P, Rojkind M. Reciprocal modulation of matrix metalloproteinase-13 and type I collagen genes in rat hepatic stellate cells. Am J Pathol. 2003;162:1771-1780. [PubMed] [DOI] |
| 8. | Dooley S, Hamzavi J, Breitkopf K, Wiercinska E, Said HM, Lorenzen J, Ten Dijke P, Gressner AM. Smad7 prevents activation of hepatic stellate cells and liver fibrosis in rats. Gastroenterology. 2003;125:178-191. [PubMed] [DOI] |
| 9. | Gressner AM, Weiskirchen R, Breitkopf K, Dooley S. Roles of TGF-beta in hepatic fibrosis. Front Biosci. 2002;7:d793-d807. [PubMed] [DOI] |
| 10. | Xu JW, Gong J, Feng XL, Chang XM, Luo JY, Dong L, Jia A, Xu GP. Effects of estradiol on type I, III collagens and TGFβ1 in hepatic fibrosis in rats. Shijie Huaren Xiaohua Zazhi. 2003;11:1185-1188. [DOI] |
| 11. | Gressner AM, Krull N, Bachem MG. Regulation of proteoglycan expression in fibrotic liver and cultured fat-storing cells. Pathol Res Pract. 1994;190:864-882. [PubMed] [DOI] |
| 12. | Williams EJ, Gaça MD, Brigstock DR, Arthur MJ, Benyon RC. Increased expression of connective tissue growth factor in fibrotic human liver and in activated hepatic stellate cells. J Hepatol. 2000;32:754-761. [PubMed] [DOI] |
| 13. | Li W, Dai QT, Liu ZE. [Preliminary study on early fibrosis of chronic hepatitis B treated with Ginkgo biloba Composita]. Zhongguo Zhong Xi Yi Jie He Za Zhi. 1995;15:593-595. [PubMed] |
| 14. | Ozenirler S, Dinçer S, Akyol G, Ozoğul C, Oz E. The protective effect of Ginkgo biloba extract on Cl4-induced hepatic damage. Acta Physiol Hung. 1997;85:277-285. [PubMed] |
| 15. | Bruck R, Shirin H, Aeed H, Matas Z, Hochman A, Pines M, Avni Y. Prevention of hepatic cirrhosis in rats by hydroxyl radical scavengers. J Hepatol. 2001;35:457-464. [PubMed] [DOI] |
| 16. | Gohil K, Packer L. Bioflavonoid-rich botanical extracts show antioxidant and gene regulatory activity. Ann N Y Acad Sci. 2002;957:70-77. [PubMed] [DOI] |
| 17. | Rimbach G, Wolffram S, Watanabe C, Packer L, Gohil K. Effect of Ginkgo biloba (EGb 761) on differential gene expression. Pharmacopsychiatry. 2003;36 Suppl 1:S95-S99. [PubMed] |
| 18. | Birks J, Grimley EV, Van Dongen M. Ginkgo biloba for cognitive impairment and dementia. Cochrane Database Syst Rev. 2002;CD003120. [PubMed] [DOI] |
| 19. | Liu SQ, Yu JP, Luo HS, Ran ZX. Effects of Ginkgo biboba extract on expression of NF-κB in rat liver fibrosis. Shijie Huaren Xiaohua Zazhi. 2002;10:922-926. [DOI] |
| 20. | Brunt EM. Grading and staging the histopathological lesions of chronic hepatitis: the Knodell histology activity index and beyond. Hepatology. 2000;31:241-246. [PubMed] [DOI] |
| 21. | Baroni GS, Pastorelli A, Manzin A, Benedetti A, Marucci L, Solforosi L, Di Sario A, Brunelli E, Orlandi F, Clementi M. Hepatic stellate cell activation and liver fibrosis are associated with necroinflammatory injury and Th1-like response in chronic hepatitis C. Liver. 1999;19:212-219. [PubMed] [DOI] |
| 22. | Lee KS, Lee SJ, Park HJ, Chung JP, Han KH, Chon CY, Lee SI, Moon YM. Oxidative stress effect on the activation of hepatic stellate cells. Yonsei Med J. 2001;42:1-8. [PubMed] [DOI] |
| 23. | Kang WZ, Xie YM, Nie QH, Zhang Y, Hao CQ, Wang JP, Chen WH. Effect of Oxymatrine on experimental liver fibrosis. Shijie Huaren Xiaohua Zazhi. 2003;11:195-198. [DOI] |
| 24. | Liu C, Liu P, Liu CH, Zhu XQ, Ji G. Effects of Fuzhenghuayu decoction on collagen synthesis of cultured hepatic stellate cells, hepatocytes and fibroblasts in rats. World J Gastroenterol. 1998;4:548-549. [PubMed] [DOI] |
| 25. | Wang LT, Zhang B, Chen JJ. Effect of anti-fibrosis compound on collagen expression of hepatic cells in experimental liver fibrosis of rats. World J Gastroenterol. 2000;6:877-880. [PubMed] [DOI] |
| 26. | Wang JY, Zhang QS, Guo JS, Hu MY. Effects of glycyrrhetinic acid on collagen metabolism of hepatic stellate cells at different stages of liver fibrosis in rats. World J Gastroenterol. 2001;7:115-119. [PubMed] [DOI] |
| 27. | Xu JW, Gong J, Chang XM, Luo JY, Dong L, Hao ZM, Jia A, Xu GP. Estrogen reduces CCL4- induced liver fibrosis in rats. World J Gastroenterol. 2002;8:883-887. [PubMed] [DOI] |
| 28. | Honda H, Ikejima K, Hirose M, Yoshikawa M, Lang T, Enomoto N, Kitamura T, Takei Y, Sato N. Leptin is required for fibrogenic responses induced by thioacetamide in the murine liver. Hepatology. 2002;36:12-21. [PubMed] [DOI] |
| 29. | Liang J, Yang GY, Zhang XL, Pang YS, Yuan HF, Liang JS, Huang RB, Wei X, Wei M. Inhibitory mechanism of taurine against Cl4- induced hepatic fibrosis in rats. Shijie Huaren Xiaohua Zazhi. 2003;11:1392-1395. [DOI] |
| 31. | Wu XL, Zeng WZ, Wang PL, Lei CT, Jiang MD, Chen XB, Zhang Y, Xu H, Wang Z. Effect of compound rhodiola sachalinensis A Bor on Cl4-induced liver fibrosis in rats and its probable molecular mechanisms. World J Gastroenterol. 2003;9:1559-1562. [PubMed] [DOI] |