修回日期: 2003-09-01
接受日期: 2003-09-24
在线出版日期: 2004-04-15
目的: 探讨一氧化氮(NO)在梗阻性黄疸合并肝功能障碍中的作用.
方法: 将56只Wistar大鼠随机分成假手术对照组和胆总管结扎组(实验组). 应用胶原酶灌注法分离肝细胞并进行培养; 用白介素-1(IL-1)等细胞因子处理培养的肝细胞, 应用Griess法和Western印迹分析法检测两组NO及诱导型一氧化氮合酶(iNOS)的产生; 应用高效液相色谱法(HPLC)检测两组肝细胞5'三磷酸腺苷(ATP)的合成; 应用酶法检测两组肝细胞酮体含量并计算酮体比率(乙酰乙酸盐/-羟基丁酸盐)(KBR).
结果: 实验组NO产生量明显高于对照组(207.99 moL/L vs 78.57 moL/L P<0.01); NO的产生与IL-1作用时间和作用剂量有关; 实验组和对照组的iNOS产生量在蛋白水平没有差异; IL-1降低了实验组培养肝细胞的ATP含量 (15.94 nmoL/106 cells vs 20.21 nmoL/106cells, P<0.05), 对照组改变不明显; IL-1降低了两组的KBR, 实验组降低程度大于对照组; 一氧化氮合酶(NOS)抑制剂NG-甲基-L-精氨酸(L-NMMA)抑制了NO的产生, 使降低的肝细胞ATP含量、KBR得以恢复.
结论: 梗阻性黄疸能够促进肝细胞产生NO, 导致肝功能障碍. L-NMMA可以缓解由于大量NO导致的ATP合成障碍及KBR下降. 对NO产生的调节可能会成为预防及治疗梗阻性黄疸继发肝功能损害的有效方法.
引文著录: 涂巍, 智迎辉, 郭仁宣. 一氧化氮在大鼠梗阻性黄疸继发肝功能损伤中的作用. 世界华人消化杂志 2004; 12(4): 875-879
Revised: September 1, 2003
Accepted: September 24, 2003
Published online: April 15, 2004
AIM: To examine whether obstructive jaundice influences the production of nitric oxide and alters hepatic functions including energy metabolism.
METHODS: Hepatocytes were isolated by perfusing the liver with collagenase and cultured from a rat model of obstructive jaundice or sham-control. Rat cultured hepatocytes were incubated with cytokines including IL-1. The production of nitric oxide was measured with Griess reagent method and Western blot analysis. Adenine nucleotides (ATP, ADP and AMP) were measured by a high performance liqiud chromatography. Ketone bodies in the medium were measured enzymatically.
RESULTS: Obstructive jaundice increased the production of nitric oxide by IL-1 time-and dose- dependently. Western blot analysis revealed that protein levels of iNOS were unchanged between two groups. IL-1 decreased the ATP content and KBR in obstructive jaundice but not that in sham-control. Addition of L-NMMA blocked the decreases of ATP content and KBR as well as nitric oxide production.
CONCLUSION: Enhancement of nitric oxide production following obstructive jaundice is associated with the alteration of hepatic energy metabolism through mitochondrial dysfuntion, resulting in liver failure. Regulation of nitric oxide may be a useful therapy for preventing liver damage in obstructive jaundice.
- Citation: Tu W, Zhi YH, Guo RX. Effect of nitric oxide on hepatic dysfuction in rat obstructive jaundice. Shijie Huaren Xiaohua Zazhi 2004; 12(4): 875-879
- URL: https://www.wjgnet.com/1009-3079/full/v12/i4/875.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i4.875
梗阻性黄疸患者术后经常并发肝功能衰竭, 严重者导致死亡. 梗阻性黄疸可以导致机体复杂而严重的病理生理改变[1-3], 但目前其机制尚不清楚. 一氧化氮(NO)对机体生理活动的影响作用主要依靠刺激因子的种类和反应条件[4-8] . 某些细胞因子如IL-1等能够诱导肝细胞iNOS基因的表达, 促进肝细胞产生NO, 抑制ATP合成, 降低酮体比率(KBR), 从而造成细胞线粒体功能的异常[9-11]. 因此, 可以推测NO与梗阻性黄疸并发的肝功能衰竭之间存在着密切关系. 目前, 国内外关于此方面的研究较少并且存在着争议. 我们检测梗阻性黄疸大鼠肝细胞NO的产生并探讨其在肝功能障碍中的作用如下:
56只♂Wistar大鼠(6-8周龄, 250-300 g), 由中国医科大学实验动物管理中心提供. 人重组IL-1由大塚制药公司提供, 每毫克IL-1蛋白含有2107u的活性成分. 兔抗鼠iNOS多克隆抗体购自美国Santa Cruz公司. Williams'E培养基购自美国GIBCO公司. ECL显色剂购自Amersham Pharmacia公司. 测定酮体含量的酶反应试剂盒购自美国Phoenix Pharmaceuticals公司. 其他试剂购自美国Sigma公司.
动物模型制作根据中国医科大学实验动物管理中心的饲养方法喂养所有大鼠. 实验动物随机分成2组: 假手术对照组28只; 胆总管结扎组(实验组)28只. 在乙醚全身麻醉下, 对实验组大鼠进行胆总管结扎术: 取上腹部正中切口入腹, 游离胆总管后用4-0丝线双重结扎, 结间横断胆总管, 关腹. 对照组仅在胰腺上方游离胆总管, 不结扎即关腹[12]. 分别于术后1, 3, 5, 7 d对实验组(OJ)和对照组(Sham)大鼠取血样. 血样在室温下存放30 min后进行血清生化分析, 即测定两组大鼠血清总胆红素水平和转氨酶水平. 应用胶原酶灌注法, 分别于术后1, 3, 5, 7 d从OJ组和Sham组大鼠肝脏中分离肝细胞[13]. 应用trypan blue法计算选取具有80%以上活性的肝细胞进行培养. 将每毫升含有5-6×105个有活性细胞的培养液播种于塑料培养皿(2 mL培养液/培养皿, 美国Falcon Plastic公司)中. 将培养皿放入37 ℃、50 mL/L CO2的温箱内进行单层培养. 培养基为Williams'E培养基(含有11 mmol/L的葡萄糖), 其中加入100 mL/L新生小牛血清, HEPES (5 mmol/L), 青霉素(100 ku/L), 链霉素(0.1 g/L), 地塞米松(10-8 moL/L)和胰岛素(10-8 mol/L). 培养4-5 h后用含有新鲜血清而不含激素的培养基(1.5 mL/皿)取代原培养基, 培养过夜后以备后续实验. 参考Horiuti法通过计算细胞核的数量推算细胞数量[14]. 细胞核与细胞比例为1.39±0.03 (mean±SD). 应用显微镜确定培养肝细胞的纯化率大于98%[15]. NO产生量的测定 参照以往文献报道, 应用Griess reagent法通过测定培养上清液中亚硝酸盐含量来估算NO产生量[16]. 移去原培养基, 用新鲜的Williams'E培养液漂洗肝细胞两遍. 分别用含有和不含有IL-1(IL-1, 1 nm; 347 ku/L)的1 mL培养液继续培养术后 7 d分离的肝细胞12 h, 测定亚硝酸盐含量前15 min向培养液中加入NG-甲基-L-精氨酸(L-NMMA, 330 mol/L)或L-精氨酸(10 mmoL/L). 分别测定两组术后不同时间分离肝细胞培养上清液中的亚硝酸盐含量. 在未加入IL-1时及加入后0 h、4h、8h和12 h, 分别测定两组术后7 d分离的肝细胞培养上清液内的亚硝酸盐含量. 亚硝酸钠作为标准对照. Western印迹分析 将OJ组术后7d分离肝细胞的培养皿置于冰面, 用冷磷酸盐缓冲液漂洗细胞两遍, 将细胞放入含有50 mL/L甘油, 20 g/L SDS和20 g/L 2-巯基乙醇的125 mmol/L Tris-Hcl缓冲液中(PH =6.8), 在100 ℃下煮沸3 min, 以16 500 g离心5 min. 抽取上清液, 行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE), 将电泳印记固定于聚乙烯二氟膜上. 以兔抗鼠iNOS多克隆抗体作为一抗进行免疫结合, 应用ECL系统显色. 细胞内ATP含量的测定 参照以往报道所描述的方法[17], 应用高效液相色谱法测定两组肝细胞核苷酸(ATP, ADP和AMP)含量. 在4 ℃下, 迅速移去培养液, 用1 mL盐溶液漂洗细胞两遍, 与70 g/L高氯酸混合, 以橡胶棒搅匀. 用2 moL/L磷酸钾试剂调整细胞裂解液PH值至6.0-6.5, 以10 000 g离心10 min. 滤过上清液并在-80 ℃下保存, 以备测定. 应用容积为40 mL, 以0.1 mmoL/L磷酸二氢胺盐(PH6.0)为缓冲剂, 流动率为1 mL/min的反向洗脱柱(ODS-M4 mm×50 mm, 柱温50 ℃, 灌注体积40 L)分别在2.19 min, 2.48 min和4.05 min分离出ATP, ADP和AMP. 以254 nm的光谱测定核苷酸含量. 酮体率的测定 应用酶反应试剂盒测定两组培养肝细胞的酮体含量. 酮体率(KBR)可通过计算乙酰乙酸盐与-羟基丁酸盐含量的比值而获得.
统计学处理 所有数据采用mean±SD 表示, 统计学处理采用SPSS软件和Microsoft excel软件在微机上进行, 两组间差异比较采用t检验, 以P<0.05为差异显著, P<0.01为差异非常显著.
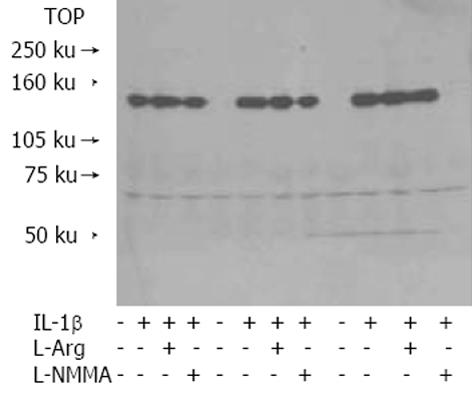
胆总管结扎后1 d (实验1 d) OJ组大鼠血清胆红素、AST和ALT水平没有发生显著变化, 大于或等于3 d出现显著升高并在5 d和7 d达到最高值.整个实验中, Sham组胆红素和转氨酶水平没有发生明显变化(表1, 2). 在实验1 d、3 d、5 d和7 d分离两组大鼠肝细胞并进行培养. 加入IL-1后, Sham组有NO产生, 但其水平没有变化. OJ组NO1-5 d逐渐增加, 7 d时其水平大约是Sham组的3倍以上. 大于或等于9 d未见NO产生, 考虑可能是肝细胞活性降低的缘故(表3). 培养肝细胞中添加IL-1后, 4 h开始NO逐渐产生. 于12 h, 实验(OJ)组NO产生量明显高于对照(Sham)组 (P<0.01). 当向两组培养肝细胞中加入NO产生促进剂L-精氨酸(L-Arg), 两组NO产生量增加, 加入NOS抑制剂L-NMMA后NO水平显著降低(表4). 两组NO水平的差异随着IL-1应用浓度的增加而增大, 最大可达1-10 nmoL/L, 但于10--9浓度时达到峰值, 继续增加IL-1浓度并不能使NO产生得到增加. 两组ED50相似, 大约为0.2 nmol/L. 这表明梗阻性黄疸提高了肝细胞iNOS对IL-1的反应性(表5). Western电泳分析显示两组间iNOS蛋白(130 ku)产生量并没有显著差异(图1), 无论是否向两组中加入L-NMMA或L-精氨酸, iNOS蛋白所对应的电泳条带均未发生变化, 这说明OJ组高水平NO的产生可能是NOS蛋白受到翻译后修饰作用的结果.
| NO(nmol/L) | Day 1 | Day 3 | Day 5 | Day 7 |
| Sham | 82.94±4.2 | 80.06±5.2 | 89.35±4.8 | 78.57±3.2 |
| OJ | 110.92±9.2 | 119.80±9.8 | 123.19±10.2 | 210.00±15.1b |
NO对正常或受损肝细胞能量代谢的调节起着重要的作用. 我们对两组培养肝细胞ATP含量进行了比较(表6). 未加入IL-1时, 两组培养肝细胞的ATP含量相似. 加入IL-1后, OJ组ATP含量下降, Sham组没有发生显著变化, 二者差异显著. L-NMMA的加入使OJ组下降的ATP含量有所上升. L-精氨酸的加入使Sham组的ATP含量有所下降, 但他并没有使两组的ATP含量产生显著差异. KBR与线粒体NAD+/NADH的比例成正相关(氧化还原状态下), 因此他能够反映肝细胞的线粒体功能. IL-1显著降低了OJ组的KBR, Sham组的降低程度不明显, 二者差异显著. L-NMMA的加入使OJ组下降的ATP含量有所上升, 而L-精氨酸的加入对KBR的影响作用不显著(表7).
NO代谢异常会导致许多疾病的发生[18-20]. 决定NO是保护性还是损伤性的最重要因素在于NO的定位、产生NO的数量以及与NO相同位置中正在产生的超氧化阴离子的相对数量[21-24]. 梗阻性黄疸后期, 机体产生的NO大量积聚, 其血管舒张作用和毒性作用增强, 血管过度扩张不仅不能改善肝微循环, 反而加剧门体静脉分流, 减少肝脏对抗原物质的接触和摄取, 结果导致肝脏损伤加重乃至肝硬化[25]. 张崴et al[26]也曾报道肝硬化晚期血清中NO的产生增加, 并且与肝硬化腹水病程密切相关. 陈刚et al[27]报道在腹腔感染及其并发症的发生发展过程中, 可观察到iNOS的表达和大量NO的产生. 本结果显示, 与Sham组相比, 炎症递质IL-1显著增加了胆总管结扎后1 d OJ组NO的产生. 血清胆红素和转氨酶(AST, ALT)水平并无变化, 而3 d显著升高, 5-7 d AST, ALT达最高值, 7 d NO产生量大约是对照组的3倍以上. IL-1对两组NO产生的影响效应与其作用的时间及作用剂量有关. Western印迹分析分析表明iNOS的活化导致了OJ组NO产生量的增加, 而NOS的含量并没有增加. 王玉梅et al[23]也曾报道在FS-112诱导的肝衰竭模型中, 肝组织iNOS的变化与血清ALT, TB水平的变化相平行, 提示NO的变化与肝损伤的程度相一致. 另据报道, 酪氨酸磷酸化作用可能参与iNOS翻译后的修饰过程, L-精氨酸(阳离子氨基酸)能够促进NO的产生[28]. 以上报道与本研究的结果相似, 此外, 酶的磷酸化作用似乎能够激活iNOS.
本结果显示, 实验7d NOS抑制剂L-NMMA的加入可以抑制肝细胞NO的产生, 使降低的肝细胞ATP含量、KBR得以恢复. L-精氨酸的加入使两组NO的产生量增加50%-60%. 加入IL-1后, OJ组培养肝细胞ATP含量和KBR下降显著. KBR反映线粒体NAD+/NADH的比例关系(氧化还原状态下), 并且与线粒体呼吸链磷酸化作用密切相关, 低水平KBR与线粒体功能障碍有关[29]. L-NMMA可以抑制OJ组ATP含量和KBR的降低, 同时也可以使Sham组的KBR得以恢复, 而L-精氨酸的加入对两组ATP含量和KBR都未产生显著影响. 这些结果表明, NO产生量的增加能够使肝细胞线粒体的功能发生障碍, 从而抑制ATP的合成. 另据报道, NO在线粒体水平可以抑制Krebs 环化酶的活性和呼吸链作用, NOS抑制剂能够抑制细胞因子和内毒素介导的NO产生并且对肝硬化导致的循环超负荷具有治疗作用[30-31], 这些观点也支持了本实验的结论.
研究表明, NO的大量产生尤其是血管内皮源性NO的产生与血管、心脏的活动及肾脏功能的改变密切相关[32-33]. 梗阻性黄疸的预后同有效循环血量改变密切相关[34]. 然而, 目前关于梗阻性黄疸时NO产生与肝功能障碍之间关系的研究很少. 我们发现, 梗阻性黄疸时NO的大量产生可以促进肝细胞线粒体功能发生障碍, IL-1诱导产生的NO对于梗阻性黄疸时肝功能的进一步恶化具有重要的促进作用. L-NMMA可以缓解由于大量NO导致的ATP合成障碍及KBR下降. 因此, 对NO产生的调节可能会成为预防及治疗梗阻性黄疸继发肝功能损害的有效方法.
编辑: N/A
| 1. | Su CH, P'eng FK, Lui WY. Factors affecting morbidity and mortality in biliary tract surgery. World J Surg. 1992;16:536-540. [PubMed] [DOI] |
| 4. | Wang QG, He LY, Chen YW, Hu SL. Enzymohistochemical study on burn effect on rat intestinal NOS. World J Gastroenterol. 2000;6:421-423. [PubMed] [DOI] |
| 12. | Reynolds JV, Murchan P, Redmond HP, Watson RW, Leonard N, Hill A, Clarke P, Marks P, Keane FB, Tanner WA. Failure of macrophage activation in experimental obstructive jaundice: association with bacterial translocation. Br J Surg. 1995;82:534-538. [PubMed] [DOI] |
| 13. | Kanemaki T, Kitade H, Hiramatsu Y, Kamiyama Y, Okumura T. Stimulation of glycogen degradation by prostaglandin E2 in primary cultured rat hepatocytes. Prostaglandins. 1993;45:459-474. [PubMed] [DOI] |
| 14. | Horiuti Y, Ogishima M, Yano K, Shibuya Y. Quantification of cell nuclei isolated from hepatocytes by cell lysis with nonionic detergent in citric acid. Cell Struct Funct. 1991;16:203-207. [PubMed] [DOI] |
| 15. | Seglen PO. Preparation of isolated rat liver cells. Methods Cell Biol. 1976;13:29-83. [PubMed] [DOI] |
| 16. | Green LC, Wagner DA, Glogowski J, Skipper PL, Wishnok JS, Tannenbaum SR. Analysis of nitrate, nitrite, and [15N]nitrate in biological fluids. Anal Biochem. 1982;126:131-138. [PubMed] [DOI] |
| 17. | Matsui Y, Kitade H, Kamiya T, Kanemaki T, Hiramatsu Y, Okumura T, Kamiyama Y. Adenylate energy charge of rat and human cultured hepatocytes. In Vitro Cell Dev Biol Anim. 1994;30A:609-614. [PubMed] [DOI] |
| 18. | Peng X, Feng JB, Wang SL. Distribution of nitric oxide synthase in stomach wall in rats. World J Gastroenterol. 1999;5:92. [PubMed] [DOI] |
| 19. | Huang YQ, Xiao SD, Zhang DZ, Mo JZ. Nitric oxide synthase distribution in esophageal mucosa and hemodynamic changes in rats with cirrhosis. World J Gastroenterol. 1999;5:213-216. [PubMed] [DOI] |
| 25. | Bories PN, Campillo B, Azaou L, Scherman E. Long-lasting NO overproduction in cirrhotic patients with spontaneous bacterial peritonitis. Hepatology. 1997;25:1328-1333. [PubMed] [DOI] |
| 29. | Williamson DH, Lund P, Krebs HA. The redox state of free nicotinamide-adenine dinucleotide in the cytoplasm and mitochondria of rat liver. Biochem J. 1967;103:514-527. [PubMed] [DOI] |
| 30. | Hibbs JB Jr, Taintor RR, Vavrin Z, Rachlin EM. Nitric oxide: a cytotoxic activated macrophage effector molecule. Biochem Biophys Res Commun. 1988;157:87-94. [PubMed] [DOI] |
| 31. | Stadler J, Billiar TR, Curran RD, Stuehr DJ, Ochoa JB, Simmons RL. Effect of exogenous and endogenous nitric oxide on mitochondrial respiration of rat hepatocytes. Am J Physiol. 1991;260:C910-C916. [PubMed] |