修回日期: 2003-09-05
接受日期: 2003-09-18
在线出版日期: 2004-03-15
目的: 观察胃电节律失常大鼠模型中胃肌间Cajal 间质细胞(Interstitial Cells of Cajal, ICC)含量的变化, 以探讨该模型病理机制, 为今后的研究奠定基础.
方法: 采用不规则喂养法制备大鼠胃电节律失常模型, 用免疫组化法检测其胃肌间c-kit阳性I CC含量的变化.
结果: 胃电节律失常模型大鼠的胃肌间c-kit阳性ICC含量比正常对照组明显升高(P <0.001).
结论: 张氏大鼠胃电节律失常模型中作为起搏细胞的ICC的增加, 可能导致异常的胃电起搏点的增加, 从而引发胃电节律失常.
引文著录: 李宇航, 王庆国, 陈萌, 杨美娟, 赵丽云, 李丽娜, 张冬梅, 王丹. 大鼠胃电节律失常模型胃肌间Cajal间质细胞含量的变化. 世界华人消化杂志 2004; 12(3): 639-641
Revised: September 5, 2003
Accepted: September 18, 2003
Published online: March 15, 2004
AIM: To observe the change of the interstitial cells of Cajal (ICC) content in the stomach wall in rats with electrogastric dysrhythmias, and to discuss the pathological mechanism of the rat model.
METHODS: Irregular feeding was adopted to establish a rat model of electrogastric dysrhythmias. Immunohistochemical staining was used to detect the content of c-kit positive ICC.
RESULTS: The content of ICC in the model group was higher than that in the control group, and showed a significant difference from that in the control group (P <0.001).
CONCLUSION: The increase of the ICC content in the model group may lead to the increase of the abnormal pacing impulse points, which results in the electrogastric dysrhythmias in the stomach.
- Citation: Li YH, Wang QG, Chen M, Yang MJ, Zhao LY, Li LN, Zhang DM, Wang D. Changes of interstitial cell of Cajal content in a rat model of electrogastric dysrhythmias. Shijie Huaren Xiaohua Zazhi 2004; 12(3): 639-641
- URL: https://www.wjgnet.com/1009-3079/full/v12/i3/639.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i3.639
胃电节律失常与胃功能性疾病密切相关[1-2]. 节律失常模型的建立对胃电节律失常的深入研究有重要意义. 张勇et al采用的隔日进食、在饮水中加入盐酸的喂养方法成功建立了大鼠胃电节律失常模型. 在此基础上, 我们通过免疫组化法观察了胃电节律失常大鼠模型中胃肌间c-kit阳性Cajal间质细胞(interstitial cells of cajal, I CC)含量的变化. 以探讨大鼠胃电节律失常模型的病理机制.
健康Wistar♂大鼠, 体重180±20 g, 共30只, 由中国医学科学院动物研究所提供. 随机分为正常对照组和模型组各15只. LMS-2R二道热笔生理仪(成都仪器厂). 兔抗人多克隆c-kit抗体(CD117), 试剂盒由北京中山生物技术有限公司提供(Santa Cruz公司产品).
1.2.1 模型的建立: 按张氏法[3], 模型组以不规则喂养方法饲养4 wk, 即动物逢单日正常进食、双日禁食, 以打乱正常的饮食节律; 自由饮水, 水中加入盐酸(每升水加10 mol/L盐酸10 ml)以破坏胃内酸碱环境, 制备大鼠胃电节律失常模型. 正常对照组常规饲养. 从造模结束后第3 d开始, 1次/d予蒸馏水灌胃(1 ml/100 g体重), 连续2 wk. 2 wk后从正常组随机抽取6只, 模型组随机抽取8只, 胃窦部浆膜下埋置银丝电极, 7 d后记录胃电慢波.
1.2.2 胃电参数分析: 胃电记录以每10 min为一个时间段, 计算每组动物每一个时间段的慢波频率以及慢波频率变异系数. 慢波频率变异系数=慢波频率标准差/慢波频率均值×100%[4].
1.2.3 取材及检测方法: 胃电检测完毕后, 将两组大鼠断头处死, 剖开腹腔, 迅速取出全胃, 沿胃小弯剖开, 生理盐水, 冲去内容物, 取胃体中1/3段的胃壁全层, 约为0.5 cm×0.5 cm大小. 立即置于40 g/L多聚甲醛中固定2 h, 然后经洗涤、脱水、透明、浸蜡和石蜡包埋后, 切片待测.
1.2.4 免疫组化染色: 采用两步法. 所有免疫组化染色步骤均在室温条件下完成. 具体步骤如下: 将石蜡组织块切片(厚4 m), 贴于涂有多聚赖氨酸的载玻片上; 60 ℃烘烤1 h后, 37 ℃恒温箱内烘烤2 d; 逐级二甲苯脱蜡、梯度乙醇至水. 0.01MPBS洗3 min×2. 3%过氧化氢孵育15 min, 以阻断内源性过氧化物酶. 0.01MPBS洗3 min×2. 蛋白酶K, 37 ℃, 20 min, 充分暴露抗原. 0.01MPBS洗3 min×2. 将切片放入加满PH6.0枸橼酸缓冲液的抗原修复盒中, 微波炉8马力修复9 min后, 取出待其降至常温. 0.01MPBS洗3 min×2. 10%正常羊血清封闭15 min后, 甩去不洗. 吸干组织旁的液体. 将一抗用0.01 MPBS稀释为1: 200, 滴在切片上, 并留出一块滴加0.01MPBS作阴性对照. 将切片放入湿盒中, 置于4 ℃冰箱过夜. 0.01MPBS洗3 min×2. 吸干组织旁的液体. 将DAB显色剂滴在切片上, 在镜下观察3-10 min, 直至阳性部位着色为止. 蒸馏水冲洗、复染、脱水、封片.
1.2.5 图像分析: 采用美国Tractor Northern 8502图像分析仪, 以着色呈棕黄色者为阳性部位, 每张切片取15个视野, 计算每个视野中阳性部位的面积百分比, 来表示ICC的含量.
统计学处理 全部数据以均数±标准差表示. 两均数间比较采用t检验.
2.1 经胃电参数分析, 模型组大鼠慢波频率变异系数明显高于正常组, 见表1, 经统计处理有显著性差异(a = 0.001 , P<0.001).
| 组别 | n | 慢波频率变异系数(%) |
| 对照组 | 6 | 3.275±1.059 |
| 模型组 | 8 | 7.834±1.832 |
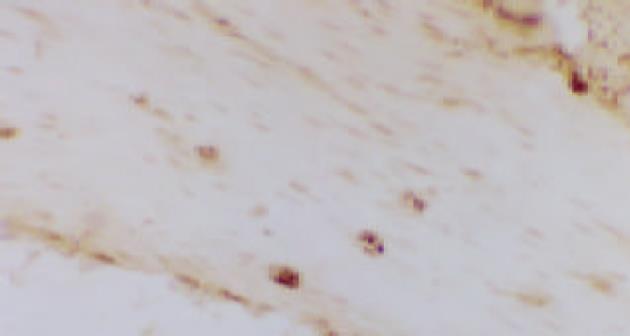
2.2 如图1, 图2所示, 光镜下, 胃肌间神经丛c-kit阳性ICC呈棕黄色, 位于环行肌层与纵行肌层之间、环行肌细胞之间以及环行肌层的内表面, 并尤以环纵肌之间为多. 存在于肌细胞之间的ICC形状较圆, 存在于环行肌层内表面的ICC的形状则为细长形. 光镜下, 模型组大鼠的胃肌间神经丛c-kit阳性ICC较正常组密集. 经图像分析显示, 模型组大鼠的胃肌间神经丛c-kit阳性ICC含量明显高于正常组, 见表2. 经统计学检验, 正常组与模型组之间存在显著性差异(a =0.003, P<0.001).
| 组别 | n | 面积百分比 |
| 正常组 | 15 | 0.399±0.291 |
| 模型组 | 15 | 3.699±2.356 |
本实验根据张氏法, 通过不规则喂养打乱大鼠正常的进食习惯, 在饮水中加入盐酸以破坏胃内酸碱环境, 使大鼠出现不同类型的胃电失常. 实验结果显示, 模型组慢波频率变异系数明显高于正常组, 经统计处理, 有显著差异. 说明实验成功制备了大鼠胃电节律失常模型.
由于是在清醒状态下检测大鼠胃电, 埋置电极后需继续喂养7 d, 其间部分电极被大鼠咬断甚至脱落, 不能检测胃电. 对照组有6只, 模型组有8只成功检测胃电, 免疫组化染色时, 所有大鼠胃体均取材进行染色, 造成胃电检测与免疫组化染色中的例数不同, 为保证两个指标时间上的平行, 且实验数据能满足统计学的要求, 故未增补胃电检测例数.
ICC存在于胃肠纵肌与环肌之间, 是胃肠道平滑肌慢波电位的起搏者和传导者[5]. 他既不属于特殊的神经元细胞, 也不是胶质细胞, 更不是平滑肌细胞, 而是具有独立功能的特殊间质细胞, 以网状结构存在于胃肠道[6]. 大鼠ICC数量在胃窦比胃底多, 在结肠比小肠多[7]. ICC分布于环行肌细胞之间、环行肌层的内表面及环行肌层与纵行肌层之间, 往往与神经纤维末梢及神经束伴随存在, 并由许多的缝隙连接紧密连接在一起[8]. ICC与胃肠道运动的发生和控制密切相关. 他可自发激活并产生节律性去极化慢波(slow wave, SW), 经由ICC形成的网络传向平滑肌细胞, 并向远端扩布. ICC的功能及分布的改变是很多动力紊乱性疾病的病理生理学基础. 已知的与ICC有关的人类疾病有: 先天性巨结肠、婴儿幽门肥厚性狭窄、慢性传输型便秘及肠易激惹综合征等[9-12]. Ekblad发现大鼠肥大的回肠ICC-AP数目明显减少, ICC-DMP几乎完全缺如[13], Ws/Ws大鼠回肠运动明显紊乱[14]. 糖尿病大鼠胃肠功能紊乱时, ICC的超微结构发生了显著的改变, 最显著的变化为ICC之间、ICC与神经末梢之间和肌细胞之间的连接显著减少, 结构显著破坏, 连接松散, 这些变化必然影响其功能的发挥, 影响平滑肌的运动, 这很可能是糖尿病胃肠功能紊乱的发病原因[15].
1996年Komuro et al研究显示豚鼠小肠肠肌间ICC表达c-kit[16]. 1997年Burns et al用c-kit免疫组化法研究标记豚鼠胃肠道ICC, 结论提示c-kit免疫组化方法是一种优秀的, 有选择性的标记胃肠道ICC的方法. c-kit可以标记胃肌间神经丛ICC, 从而间接反映ICC的数目及含量[17]. c-kit免疫反应能标记各种不同的细胞类型, 但在消化道c-kit仅能标记ICC和肥大细胞[18-19], 二者在光学显微镜下可加以区分.
本实验观察了胃电节律失常大鼠模型中胃肌间c-kit阳性I CC含量的变化, 实验结果显示, 模型组大鼠的胃肌间c-kit阳性ICC含量明显高于正常组, 提示张氏大鼠胃电节律失常模型出现了胃肌间c-kit阳性ICC含量的异常增加. 张勇et al 研究发现不规则喂养后大鼠胃电节律失常的发生与胃窦部肌间神经丛内源性亮啡肽增加及继发乙酰胆碱减少有关[20]. 陈代陆et al也研究发现, 饥饿应激对大鼠肠神经系统神经递质存在一定的影响[21]. 林丽娜et al研究发现, 酸或碱性溶液对胃电活动有一定影响, 酸化或碱化内容物可使胃电慢波频率减少[22]. 因此, 张氏法所造成的胃电节律失常, 可能与神经递质改变和破坏胃内酸碱环境等有关. ICC是胃肠道平滑肌活动的起搏细胞, 除了能推进电活动的传播, 还能调节神经递质的释放[23-25], 有文献报道不规则喂养法建立的大鼠胃电节律失常模型中胃窦肌间神经丛内氮能神经明显增多[26], 而ICC是一氧化氮(NO)的作用部位之一, 并能够合成NO, 从而起到放大器的作用[27]. 我们推测张氏法所造成的胃电节律失常模型中可能存在类似的胃肠神经递质的改变, ICC可能是该模型中胃电节律失常形成的中介, 这有待于进一步的实验来证实. 大量文献报道了胃肠ICC的减少、缺乏或受损可影响胃肠电活动, 而ICC含量的异常增加与胃肠电活动的关系却未见报道. 我们推测张氏大鼠胃电节律失常模型中出现的ICC含量的异常增加可能与胃酸直接刺激和饥饿应激刺激有关, 作为起搏细胞的ICC的增加, 可能导致异常的胃电起搏点的增加, 从而引发胃电节律失常.
| 1. | 杨 君佑, 许 冠荪. 胃电节律紊乱及其机制. 国外医学生理病理与临床分册. 1990;10:70-73. |
| 2. | Chen JD, McCallum RW. Clinical applications of electrogastrography. Am J Gastroenterol. 1993;88:1324-1336. [PubMed] |
| 5. | Lee JC, Thuneberg L, Berezin I, Huizinga JD. Generation of slow waves in membrane potential is an intrinsic property of interstitial cells of Cajal. Am J Physiol. 1999;277:G409-G423. [PubMed] |
| 6. | Sanders KM, Ordög T, Koh SD, Torihashi S, Ward SM. Development and plasticity of interstitial cells of Cajal. Neurogastroenterol Motil. 1999;11:311-338. [PubMed] [DOI] |
| 7. | Christensen J, Rick GA, Lowe LS. Distributions of interstitial cells of Cajal in stomach and colon of cat, dog, ferret, opossum, rat, guinea pig and rabbit. J Auton Nerv Syst. 1992;37:47-56. [PubMed] [DOI] |
| 8. | 张 亚萍, 张 宽学, 高 革. 大鼠胃肠道Cajal间质细胞的超微结构研究. 胃肠病学和肝病学杂志. 2002;11:112-114. |
| 9. | Rumessen JJ, Peters S, Thuneberg L. Light- and electron microscopical studies of interstitial cells of Cajal and muscle cells at the submucosal border of human colon. Lab Invest. 1993;68:481-495. [PubMed] |
| 10. | Yamataka A, Kato Y, Tibboel D, Murata Y, Sueyoshi N, Fujimoto T, Nishiye H, Miyano T. A lack of intestinal pacemaker (c-kit) in aganglionic bowel of patients with Hirschsprung's disease. J Pediatr Surg. 1995;30:441-444. [PubMed] [DOI] |
| 11. | Langer JC, Berezin I, Daniel EE. Hypertrophic pyloric stenosis: ultrastructural abnormalities of enteric nerves and the interstitial cells of Cajal. J Pediatr Surg. 1995;30:1535-1543. [PubMed] [DOI] |
| 12. | Cortesini C, Cianchi F, Infantino A, Lise M. Nitric oxide synthase and VIP distribution in enteric nervous system in idiopathic chronic constipation. Dig Dis Sci. 1995;40:2450-2455. [PubMed] [DOI] |
| 13. | Ekblad E, Sjuve R, Arner A, Sundler F. Enteric neuronal plasticity and a reduced number of interstitial cells of Cajal in hypertrophic rat ileum. Gut. 1998;42:836-844. [PubMed] [DOI] |
| 14. | Nakama A, Hirota S, Okazaki T, Nagano K, Kawano S, Hori M, Kitamura Y. Disturbed pyloric motility in Ws/Ws mutant rats due to deficiency of c-kit-expressing interstitial cells of Cajal. Pathol Int. 1998;48:843-849. [PubMed] [DOI] |
| 16. | Komuro T, Tokui K, Zhou DS. Indentification of the intersititial cells of Cajal. Histol histopathol. 1996;11:769. |
| 18. | Huizinga JD, Thuneberg L, Vanderwinden JM, Rumessen JJ. Interstitial cells of Cajal as targets for pharmacological intervention in gastrointestinal motor disorders. Trends Pharmacol Sci. 1997;18:393-403. [PubMed] [DOI] |
| 19. | Maeda H, Yamagata A, Nishikawa S, Yoshinaga K, Kobayashi S, Nishi K, Nishikawa S. Requirement of c-kit for development of intestinal pacemaker system. Development. 1992;116:369-375. [PubMed] |
| 23. | Ward SM, Beckett EA, Wang X, Baker F, Khoyi M, Sanders KM. Interstitial cells of Cajal mediate cholinergic neurotransmission from enteric motor neurons. J Neurosci. 2000;20:1393-1403. [PubMed] |
| 24. | Wang XY, Sanders KM, Ward SM. Intimate relationship between interstitial cells of cajal and enteric nerves in the guinea-pig small intestine. Cell Tissue Res. 1999;295:247-256. [PubMed] [DOI] |
| 25. | Burns AJ, Lomax AE, Torihashi S, Sanders KM, Ward SM. Interstitial cells of Cajal mediate inhibitory neurotransmission in the stomach. Proc Natl Acad Sci USA. 1996;93:12008-12013. [PubMed] [DOI] |
| 27. | Shuttleworth CW, Xue C, Ward SM, de Vente J, Sanders KM. Immunohistochemical localization of 3',5'-cyclic guanosine monophosphate in the canine proximal colon: responses to nitric oxide and electrical stimulation of enteric inhibitory neurons. Neuroscience. 1993;56:513-522. [PubMed] [DOI] |