修回日期: 2003-07-25
接受日期: 2003-08-16
在线出版日期: 2004-03-15
目的: 了解拉米夫定治疗慢性乙型肝炎过程中HBV P基因YMDD变异的意义, 为临床治疗提供指导.
方法: 用定量PCR监测40例拉米夫定治疗期间的HBV DNA动态变化, 对治疗48 wk时HBV DNA仍为阳性的患者, 采用Uniarray技术和基因芯片检测YMDD突变.
结果: 拉米夫定治疗48 wk时, HBV DNA转阴者23例(57.5%). HBV DNA仍为阳性者17例, 其中8例在治疗过程中出现HBV DNA定量反跳. 用基因芯片法与Uniarray技术共检测出7例YMDD变异(5例出现于8例HBV DNA定量反跳者), 变异率为17.5%(7/40).
结论: 拉米夫定治疗过程中, 可导致部分患者的HBV YMDD发生变异. 该变异使多数患者HBV DNA定量反跳 . 检测HBV YMDD变异对慢性乙型肝炎的治疗具有重要的指导意义.
引文著录: 王平忠, 张岩, 白雪帆, 张颖, 李谨革, 陈红梅, 王九平. 乙型肝炎病毒P基因YMDD变异的意义. 世界华人消化杂志 2004; 12(3): 600-603
Revised: July 25, 2003
Accepted: August 16, 2003
Published online: March 15, 2004
AIM: To determine significance of the YMDD motif mutation of P gene of hepatitis B virus during lamivudine therapy for chronic hepatitis B and to provide guideline for the clinical treatment.
METHODS: Dynamic change of HBV DNA quantitation was measured with fluorescence quantitative PCR during lamivudine treatment. 40 patients from chronic hepatitis B were treated with lamivudine for 48 wks. In 17 patients HBV DNA remained to be positive, YMDD mutation were examined by GeneChip and Uniarray techniques.
RESULTS: In patients treated with lamivudine for 48 wks, HBV DNA turned negative in 23 cases (57.5%). In 17 patients HBV DNA remained to be positive, there was HBV DNA rebound in 8 patients during lamivudine treatment. There were YMDD mutations in 7 cases (5 cases from patients of HBV DNA rebound).The rate of YMDD mutation was 17.5% (7/40).
CONCLUSION: During lamivudine treatment, HBV YMDD in some patients can mutate. The HBV DNA rebound is associated with emergence of YMDD mutants. Detection of the YMDD motif mutation in P gene of hepatitis B virus is important to clinical treatment for chronic hepatitis B.
- Citation: Wang PZ, Zhang Y, Bai XF, Zhang Y, Li JG, Chen HM, Wang JP. Significance of the YMDD motif mutation of P gene of hepatitis B virus. Shijie Huaren Xiaohua Zazhi 2004; 12(3): 600-603
- URL: https://www.wjgnet.com/1009-3079/full/v12/i3/600.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i3.600
拉米夫定(lamivudine)是核苷类的抗乙型肝炎病毒(HBV)的新药, 是HBV复制强有力的抑制剂, 其作用靶为HBV DNA多聚酶, 通过抑制前基因组RNA逆转录为负链DNA及DNA链延伸过程中起到链终止作用来抑制HBV复制. 拉米夫定用于治疗慢性乙型肝炎已有较明确的疗效, 但由于其难以完全清除体内病毒, 尤其是对cccDNA无直接作用, 故需要长期用药以期耗竭cccDNA库来达到清除HBV的目的. 但长期用药可引起HBV DNA多聚酶活性区核苷酸序列的变异, 称为YMDD变异. 国内学者报道YMDD变异发生率第1年和第2年分别为14%和49%[1], 变异后的HBV对拉米夫定的敏感性下降, 从而导致治疗失败[2-4]. 因此, 检测YMDD基序变异对及时调整治疗方案、合理用药及提高疗效具有重要的指导意义[5]. 为更好地监测慢性乙型肝炎患者应用拉米夫定治疗过程中耐药性的产生, 我们用定量PCR监测了40例拉米夫定治疗期间的HBV DNA动态变化, 对治疗48 wk时HBV DNA仍为阳性的患者, 用基因芯片和Uniarray技术检测YMDD突变.
本院1999-12/2000-11住院和门诊患者血清标本40例, 男28例, 女12例. 年龄15-68(平均36.7岁). 临床诊断符合2000-09西安会议《病毒性肝炎防治方案》标准. 入选患者HBsAg, HBeAg阳性; 抗HIV, 抗-HDV, 抗-HCV阴性(华美公司试剂). HBV DNA斑点杂交阳性(上海医科大学预防医学研究所生产的试剂盒测定), 且HBV DNA定量均大于109拷贝/L(荧光定量PCR法). 所有患者口服拉米夫定100 mg/d, 疗程48 wk. 于治疗前及治疗24 wk、36 wk和48 wk时采集外周血, 分离血清, -20 ℃保存, 统一检测. HBV DNA定量试剂由中山医科大学达安基因诊断中心提供. Uniarray技术检测试剂为上海基达基因技术有限公司生产的UniArrayTM HBV拉米夫定耐药检测试剂盒. 所用仪器为GeneAmp 5700 Sequence Detection System (applied biosystem 公司)荧光PCR扩增仪. HBV YMDD检测芯片由联合基因集团上海博华基因芯片技术有限公司制备. 图片扫描仪为ScanArray 300 (美国).
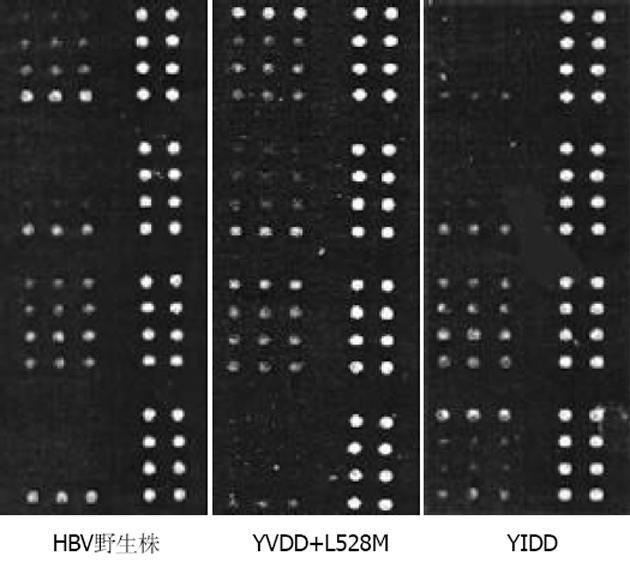
(1)HBV DNA定量 采用荧光定量PCR法. 按说明书进行操作. (2)Uniarray技术 主要步骤如下: 取待测血清、质控品I(内参照阳性、YIDD阳性、YVDD阴性)和质控品V(内参照阳性、YVDD阳性、YIDD阴性)各50 L, 分别加入DNA提取液A50 L, 振荡混匀, 12 000 r/min离心10 min, 弃上清. 再加入DNA提取液B 50 L, 振荡混匀, 100 ℃水浴10 min, 12 000 r/min离心2 min, 取上清5 L进行PCR扩增. 扩增 PCR反应体系为50 L, 包括PCR缓冲液31 L, MgCl2 6 L, Taq酶3 L, 荧光探针5 L, 待检DNA样品5 L. 将各反应管按一定顺序放入PE Gene Amp 5700荧光PCR扩增仪上, 先50 ℃保温2 min, 再94 ℃变性5 min, 然后94 ℃ 20 s, 61 ℃ 40 s, 40个循环. 结果以YIDD或YVDD引物孔的Ct值与内参照引物孔的Ct值 (基准值)之差 (∆Ct)的大小作为突变是否发生的依据. 若∆Ct小于或等于3, 则为YMDD变异; 若∆Ct 大于3, 则为YMDD野生型. (3)基因芯片测定方法 HBV YMDD (拉米夫定耐药基因) 检测芯片选定HBV P基因的保守区序列, 并设计了相关的引物, 扩增出包含有YMDD变异区的核苷酸片断, 针对L528M, A548V, M552I及M552V 4个位点设计探针, 将探针固定在经过特殊处理的玻片上, 并且与特定的PCR法标记扩增的片断杂交. 经过洗脱后, 在微排列扫描仪上扫描, 用专门的软件分析确定耐药的类型. 取待检测血清10 L, 采用常规酚、氯仿、异戊醇方法抽提HBV DNA, 异丙醇沉淀; 取5 L用于PCR扩增, 共35个循环; 再吸取PCR产物2 L, 加入CY5标记的dUTP, 进行PCR标记, 共35个循环. 标记的产物沉淀后加入杂交试剂, 并与芯片分别于95 ℃变性5 min, 冷却后将杂交液10 L滴于芯片的上样区, 封闭后在湿盒内42 ℃杂交1.5 h, 然后用0.1碨SC洗涤10 min, 双蒸水冲洗并避光晾干; 将杂交后的芯片插入ScanArray 300扫描仪(美国)中进行扫描, 扫描强度55%-60%, 获得的图片用GenArray-Check软件分析各点的信号状况, 根据信号强度及比值作出判断结果(图1, 表1).
| 平均值 | 比值 | 结果 | |
| YIDD突变点 | 116.65 | 0.05 | 野生 |
| 单点差异对照 | 165.19 | ||
| 单点差异对照 | 261.10 | ||
| YMDD野生点 | 2 267.16 | ||
| A548V突变点 | 186.37 | 0.02 | 野生 |
| 单点差异对照 | 320.44 | ||
| 单点差异对照 | 804.78 | ||
| A548V野生点 | 8 212.13 | ||
| L528M突变点 | 4 271.79 | 0.34 | 野生 |
| 单点差异对照 | 8 890.03 | ||
| L528M野生点 | 1 2670.01 | ||
| L528M野生点 | 8 189.31 | ||
| YIDD突变点 | 24 518.07 | 4.86 | 突变 |
| 单点差异对照 | 1 704.71 | ||
| 单点差异对照 | 1 471.62 | ||
| YMDD野生点 | 5 039.73 |
治疗48 wk时, 17例HBV DNA仍为阳性, 对这17例患者治疗前及治疗24 wk、36 wk和48 wk的系列血清进行了HBV DNA定量检测. 结果发现, 8例患者治疗过程中一度降低的HBV DNA水平又复升高(2例于36 wk升高, 6例于48 wk升高)(表2).
| 编号病例 | t /wk | |||
| 0 | 24 | 36 | 48 | |
| 03 | 8.19×107 | 5.41×106 | 2.28×105 | 4.19×106 |
| 06 | 2.35×108 | 3.08×106 | 4.72×107 | 2.31×106 |
| 16 | 3.27×108 | 4.84×106 | 6.18×105 | 2.17×107 |
| 21 | 4.32×108 | 2.32×106 | <1.00×103 | 7.18×106 |
| 23 | 6.18×107 | 1.28×106 | 4.42×105 | 2.21×106 |
| 25 | 7.84×107 | 1.35×105 | 4.05×106 | 8.12×106 |
| 28 | 4.67×106 | 3.22×105 | 5.09×104 | 6.16×105 |
| 30 | 5.56×108 | 4.32×106 | 3.92×104 | 1.92×106 |
用Uniarray技术测定40例拉米夫定治疗48 wk时HBV DNA仍为阳性的17例血清, 3例为YVDD变异, 4例为YIDD, 其余10例全部为野生株(表3).
用基因芯片法测定治疗48 wk HBV DNA仍为阳性的17例患者血清, 发现YMDD变异7例, 9例为野生株(无变异), 1例为阴性. 在7例YMDD变异中, YVDD变异 3例, YIDD变异4例. 3例YVDD中, 2例合并528突变(核苷酸C669→A, 使氨基酸由亮氨酸528→蛋氨酸), 1例变异株和野生株同时存在(表3).
拉米夫定是HBV复制强有力的抑制剂, 能够与HBV DNA多聚酶YMDD (酪氨酸-蛋氨酸-天冬氨酸-天冬氨酸) 基序特异性结合, 从而起到抑制病毒复制的作用. 拉米夫定的临床试验结果表明, 拉米夫定可明显抑制HBV的复制, 进而达到控制炎症、稳定病情甚至阻止肝纤维化的进展. 但对肝细胞内cccDNA无直接作用, 而且他所抑制的HBV DNA多聚酶的活性在停药后又回复到原来的水平. 因此其抑制病毒复制作用短暂, 停药后易于复发, 需要长期用药. 但随着用药时间的延长, 在药物和人体免疫选择压力下, 可能产生耐药. 体内外研究均已表明, 拉米夫定耐药主要是由HBV P基因C区YMDD变异所引起. YMDD变异分为两种, 一种是HBV P基因第550位氨基酸由蛋氨酸(methionine, M)突变为缬氨酸(valine, V), 此乃YVDD变异, 同时伴有528位的突变(核苷酸A669→C, 使氨基酸由亮氨酸528→蛋氨酸); 另一种是HBV P基因第550位氨基酸由M突变为异亮氨酸(isoleucine, I), 此乃YIDD变异. 这两种变异分别由HBV第739位碱基A→G和741位G→T突变所引起[6-7]. 一旦出现YMDD变异株, 对拉米夫定不再敏感. 耐药可能会伴有HBV DNA定量反跳和肝功能变化, 甚至导致病情恶化. de Man et al[8]报道了1例肝移植术后HBV感染者, 乙型肝炎免疫球蛋白治疗导致HBsAg逃避变异株, 用泛昔洛韦治疗(500 mg 3次/d) 6 mo无效, P基因测序发现第513位氨基酸有异亮氨酸→亮氨酸的突变, 改用拉米夫定100 mg 1次/d, HBV DNA水平骤降, 但拉米夫定治疗12 mo后HBV DNA复升, 且发生重症肝炎, 最后死亡. 测序发现在YMDD区域附近有突变. 因此在出现YMDD变异株后要密切监视患者病情变化, 包括肝脏功能、HBV DNA定量等. 如出现ALT明显升高, 临床症状加重, 则应停药. 新出现的一些核苷类似药物如阿的福韦, 对YMDD变异株仍然有效, 将来上市后可以作为治疗这种变异株的有效药物[9-10].
随着拉米夫定耐药株的出现, 国内外研究者都在积极寻找检测他的有效方法. 目前对变异株的检测与分析多采用RT-PCR产物测序法、错配PCR-RFLP及PCR-ELISA等[11-13]. 这些方法存在着烦琐、费时、只能检测单个位点突变、不能提供全面的变异株情况等特点. 基因芯片技术是近年来发展起来的高效分子诊断技术, 已广泛应用于药物筛选, 基因表达谱测定, 多态性分析, 新基因鉴定, 测序, 临床检测等领域的研究[14-30]. 但该技术需专用仪器, 不便推广使用. Uniarray技术是近年出现的又一检测YMDD变异的新技术, 他是以UT-PCR (通用模板信号扩增技术)为基础的多基因/位点同时检测的阵列技术. UT-PCR是在Taqman荧光定量PCR基础上建立起来的新型PCR技术, 主要是使用通用模板和通用荧光探针. 通用引物由5'端的通用模板(UT)序列和3'的特异引物序列构成, 通用模板序列不与任何天然核酸序列相匹配, 只能与通用荧光探针匹配. 通用荧光探针5'端标以荧光发射基团FAM标记, 3'端以荧光淬灭基团TAMRA标记, 由于距离相近, 基团相互作用不产生荧光. 该技术将各个被测基因位点的特异性UT引物置于标明的反应容器中, 如微型试管中, 利用UT-PCR的通用条件优势, 在同一热循环中扩增和检测. 他绕过了目前国际流行基因芯片技术需要大量的PCR预合成和核酸杂交等繁锁步骤, 直接在阵列中进行成百上千个特异性的UT-PCR扩增检测反应, 检测成本低, 并且不需要特殊专用仪器. 能够快速准确地检测出HBV耐药突变中临床最常见YMDD变异, 并且能够与现在主流荧光实时PCR仪配合. 因此UT-PCR和Uniarray的高灵敏、高特异、高精确度和高通量特点, 在临床病原体检测、药效监测、突变分析以及相关科学研究领域中具有广阔的应用前景.
我们采用基因芯片法和Uniarray技术测定了40例拉米夫定治疗48 wk, HBV DNA仍为阳性的17例患者血清. 共检出7例YMDD变异, 其中5例为HBV DNA定量反跳者. 提示YMDD变异与HBV DNA定量反跳密切有关, 是HBV耐药的主要原因. 对8例HBV DNA定量反跳者治疗前、治疗24、36、48 wk的系列血清进行了DNA定量检测, 发现24 wk时DNA定量均下降, 36 wk时有2例反跳, 48 wk时有6例反跳, 但仍低于治疗前基线水平, 可能与变异病毒复制能力降低有关. 基因芯片和Uniarray技术对YMDD变异检测结果基本相符. 但基因芯片能同时检测出多个点位的变异, 而且能检测出野生株和变异株共存, 即混合感染. 这种情况往往早于临床HBV DNA定量和肝功能的变化, 因此可以及早发现患者的病情变化. 同时, 如果检测结果由混合感染变为单一变异株或野生株, 也有利于指导临床是否再继续使用拉米夫定或停药改用其他药物. 随着拉米夫定的广泛和长期应用, 国内慢性乙肝患者中由此而引起HBV YMDD变异导致耐药、肝炎复发、以致发生病情恶化的问题会更引人关注. 因此, 临床上迫切需要一种简便、高效、成本较低的方法, 对应用拉米夫定治疗的患者进行动态监测, 以指导临床合理用药. Uniarray检测技术的开发和应用, 期望能够解决这一问题.
编辑: N/A
| 1. | 马 红, 尤 红, 尹 珊珊, 贾 继东, 王 宝恩. 拉米夫定治疗慢性乙型肝炎2年临床疗效. 中华实验和临床病毒学杂志. 2001;5:147-149. |
| 2. | Wakil SM, Kazim SN, Khan LA, Raisuddin S, Parvez MK, Guptan RC, Thakur V, Hasnain SE, Sarin SK. Prevalence and profile of mutations associated with lamivudine therapy in Indian patients with chronic hepatitis B in the surface and polymerase genes of hepatitis B virus. J Med Virol. 2002;68:311-318. [PubMed] [DOI] |
| 3. | Fischer KP, Gutfreund KS, Tyrrell DL. Lamivudine resistance in hepatitis B: mechanisms and clinical implications. Drug Resist Updat. 2001;4:118-128. [PubMed] [DOI] |
| 4. | Zöllner B, Petersen J, Schröter M, Laufs R, Schoder V, Feucht HH. 20-fold increase in risk of lamivudine resistance in hepatitis B virus subtype adw. Lancet. 2001;357:934-935. [PubMed] [DOI] |
| 5. | Jaboli MF, Fabbri C, Liva S, Azzaroli F, Nigro G, Giovanelli S, Ferrara F, Miracolo A, Marchetto S, Montagnani M. Long-term alpha interferon and lamivudine combination therapy in non-responder patients with anti-HBe-positive chronic hepatitis B: results of an open, controlled trial. World J Gastroenterol. 2003;9:1491-1495. [PubMed] [DOI] |
| 6. | Niesters HG, Honkoop P, Haagsma EB, de Man RA, Schalm SW, Osterhaus AD. Identification of more than one mutation in the hepatitis B virus polymerase gene arising during prolonged lamivudine treatment. J Infect Dis. 1998;177:1382-1385. [PubMed] [DOI] |
| 7. | Xiong X, Flores C, Yang H, Toole JJ, Gibbs CS. Mutations in hepatitis B DNA polymerase associated with resistance to lamivudine do not confer resistance to adefovir in vitro. Hepatology. 1998;28:1669-1673. [PubMed] [DOI] |
| 8. | de Man RA, Bartholomeusz AI, Niesters HG, Zondervan PE, Locarnini SA. The sequential occurrence of viral mutations in a liver transplant recipient re-infected with hepatitis B: hepatitis B immune globulin escape, famciclovir non-response, followed by lamivudine resistance resulting in graft loss. J Hepatol. 1998;29:669-675. [PubMed] [DOI] |
| 12. | Chayama K, Suzuki Y, Kobayashi M, Kobayashi M, Tsubota A, Hashimoto M, Miyano Y, Koike H, Kobayashi M, Koida I. Emergence and takeover of YMDD motif mutant hepatitis B virus during long-term lamivudine therapy and re-takeover by wild type after cessation of therapy. Hepatology. 1998;27:1711-1716. [PubMed] [DOI] |
| 14. | 杨 守平, 胡 德昌, 郑 可飞, 孙 小兵, 陶 维玉, 马 宁. 基因芯片检测拉米夫定治疗慢性乙型肝炎中HBV YMDD变异25例. 世界华人消化杂志. 2002;10:1067-1068. [DOI] |
| 15. | 李 刚, 舒 欣, 马 会慧, 陈 伟, 陈 文思, 陈 青, 江 元森, 姚 集鲁. 基因芯片技术检测HBV HCV及HBV YMDD变异株. 世界华人消化杂志. 2003;11:178-181. [DOI] |
| 16. | Wilson JW, Bean P, Robins T, Graziano F, Persing DH. Comparative evaluation of three human immunodeficiency virus genotyping systems: the HIV-GenotypR method, the HIV PRT GeneChip assay, and the HIV-1 RT line probe assay. J Clin Microbiol. 2000;38:3022-3028. [PubMed] |
| 17. | Honda M, Kaneko S, Kawai H, Shirota Y, Kobayashi K. Differential gene expression between chronic hepatitis B and C hepatic lesion. Gastroenterology. 2001;120:955-966. [PubMed] [DOI] |
| 18. | Okabe H, Satoh S, Kato T, Kitahara O, Yanagawa R, Yamaoka Y, Tsunoda T, Furukawa Y, Nakamura Y. Genome-wide analysis of gene expression in human hepatocellular carcinomas using cDNA microarray: identification of genes involved in viral carcinogenesis and tumor progression. Cancer Res. 2001;61:2129-2137. [PubMed] |
| 19. | Xu XR, Huang J, Xu ZG, Qian BZ, Zhu ZD, Yan Q, Cai T, Zhang X, Xiao HS, Qu J. Insight into hepatocellular carcinogenesis at transcriptome level by comparing gene expression profiles of hepatocellular carcinoma with those of corresponding noncancerous liver. Proc Natl Acad Sci U S A. 2001;98:15089-15094. [PubMed] [DOI] |
| 20. | Zou TT, Selaru FM, Xu Y, Shustova V, Yin J, Mori Y, Shibata D, Sato F, Wang S, Olaru A. Application of cDNA microarrays to generate a molecular taxonomy capable of distinguishing between colon cancer and normal colon. Oncogene. 2002;21:4855-4862. [PubMed] [DOI] |
| 21. | Chizhikov V, Wagner M, Ivshina A, Hoshino Y, Kapikian AZ, Chumakov K. Detection and genotyping of human group A rotaviruses by oligonucleotide microarray hybridization. J Clin Microbiol. 2002;40:2398-2407. [PubMed] [DOI] |
| 22. | Bustin SA, Dorudi S. The value of microarray techniques for quantitative gene profiling in molecular diagnostics. Trends Mol Med. 2002;8:269-272. [PubMed] [DOI] |
| 23. | Shoemaker DD, Linsley PS. Recent developments in DNA microarrays. Curr Opin Microbiol. 2002;5:334-337. [PubMed] [DOI] |
| 24. | Wu CG, Salvay DM, Forgues M, Valerie K, Farnsworth J, Markin RS, Wang XW. Distinctive gene expression profiles associated with Hepatitis B virus x protein. Oncogene. 2001;20:3674-3682. [PubMed] [DOI] |
| 25. | Bigger CB, Brasky KM, Lanford RE. DNA microarray analysis of chimpanzee liver during acute resolving hepatitis C virus infection. J Virol. 2001;75:7059-7066. [PubMed] [DOI] |
| 26. | Wen WH, Bernstein L, Lescallett J, Beazer-Barclay Y, Sullivan-Halley J, White M, Press MF. Comparison of TP53 mutations identified by oligonucleotide microarray and conventional DNA sequence analysis. Cancer Res. 2000;60:2716-2722. [PubMed] |
| 27. | Ahrendt SA, Halachmi S, Chow JT, Wu L, Halachmi N, Yang SC, Wehage S, Jen J, Sidransky D. Rapid p53 sequence analysis in primary lung cancer using an oligonucleotide probe array. Proc Natl Acad Sci U S A. 1999;96:7382-7387. [PubMed] [DOI] |
| 28. | Wikman FP, Lu ML, Thykjaer T, Olesen SH, Andersen LD, Cordon-Cardo C, Orntoft TF. Evaluation of the performance of a p53 sequencing microarray chip using 140 previously sequenced bladder tumor samples. Clin Chem. 2000;46:1555-1561. [PubMed] |