修回日期: 2003-10-25
接受日期: 2003-11-19
在线出版日期: 2004-03-15
目的: 研究直肠癌系膜淋巴结(LN)大小、分布、转移及微转移规律.
方法: 对全直肠系膜切除的直肠癌标本用LN显示液处理, 切取的LN以常规病理结合免疫组化染色检测.
结果: 本组31例548枚LN, 27例(87.1%)153枚(27.9%)LN发现转移. 其中, 直径小于0.5 cm LN 366枚(66.8%), 转移91枚(59.5%). 转移病例中, 后壁直肠癌15例, 78枚LN转移, 75枚沿直肠上动脉分布. 侧壁直肠癌12例, 75枚LN转移, 同侧直肠上动脉分支、直肠中动脉旁转移37和8枚, 对侧分别为9和0枚.
结论: 直肠癌大部分转移LN直径小于0.5 cm, 主要分布于直肠上动脉旁. LN转移与肿瘤方位有关, 后壁癌可同时沿肿瘤两侧系膜扩散, 侧壁癌以同侧LN受累为主.
引文著录: 郑阳春, 周总光, 郑雪莲, 李立, 雷文章, 王天才, 邓伊伶, 陈代云, 刘卫平. 直肠癌细胞系膜内淋巴结转移的解剖病理学研究. 世界华人消化杂志 2004; 12(3): 570-573
Revised: October 25, 2003
Accepted: November 19, 2003
Published online: March 15, 2004
AIM: To investigate the size, distribution, and pattern of metastases and micrometastases of lymph nodes (LNs) within the mesorectum of rectal cancer.
METHODS: All rectal cancer specimens obtained by total mesorectal excision were treated with lymph node revealing solution to retrieve all LNs, which were detected with a combination use of haematoxylin and eosin staining and immunohistochemical (IHC) staining with an antibody against cytokeratin 20.
RESULTS: A total of 548 LNs in 31 specimens were harvested, with 17.7 nodes per case. 153 nodes (27.9%) in 27 patients (87.1%) were found positive by routine pathological examination and IHC staining. Of all the nodes retrieved, nodes <0.5 cm numbered 366 (66.8%) with 91 (59.5%) positive. Among the 27 metastasized cases, there were 15 cases whose tumors were located in the back wall of the rectum, in which 78 nodes were detected positive with 75 nodes along the superior rectal artery. In the other 12 cases with tumors positioned in the lateral wall, 75 nodes were diagnosed positive, with 37 nodes, 8 nodes around the branch of superior rectal artery and middle rectal artery on tumor side, and 9 nodes, 0 nodes on the opposite side, respectively.
CONCLUSION: The majority of tumor positive LNs in the mesorectum are <0.5 cm in diameter. LNs within the mesorectum are distributed mainly along major supplying vessels with around the superior rectal artery most. The pattern of lymphatic spread of rectal cancer has close relationships with tumor location in the rectal wall. Tumors in the posterior wall may spread in both sides of the mesorectum simultaneously, while tumors localized in one lateral wall tend to metastasize preferably to LNs in the mesorectum of tumor side.
- Citation: Zheng YC, Zhou ZG, Zheng XL, Li L, Lei WZ, Wang TC, Deng YL, Chen DY, Liu WP. Anatomic pathology of tumor cell spread through lymph nodes in the mesorectum of rectal cancer. Shijie Huaren Xiaohua Zazhi 2004; 12(3): 570-573
- URL: https://www.wjgnet.com/1009-3079/full/v12/i3/570.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i3.570
直肠癌是最常见的消化道恶性肿瘤之一, 其发病率逐年上升[1-5]. 手术切除是目前直肠癌治疗的主要手段[6-8], 然而约30%的患者在根治术后5年内出现复发[9-11]. 肿瘤细胞在区域淋巴结中的转移、微转移被认为是导致直肠癌术后复发、转移的重要原因[12-16]. 全直肠系膜切除术(total mesorectal excision, TME)以低局部复发率, 高5年生存率的优势, 正逐步成为中、低位直肠癌手术治疗的新标准[17-18]. 然而迄今, 有关直肠癌系膜淋巴结分布的报道较少, 直肠癌系膜淋巴结的转移规律尚有争议, 直肠癌系膜淋巴结的微转移规律有待阐明[19-20]. 我们研究直肠癌系膜内淋巴结的数目、大小、分布及转移、微转移情况, 探讨直肠癌系膜淋巴结的转移、微转移规律, 为直肠癌术式的合理选择提供客观依据.
前瞻性随机收集2001-10/2002-10我院行TME治疗的直肠癌标本31例, 所有患者术前均未接受放疗或化疗, 并经纤维结肠镜及病理活检证实为直肠腺癌. 男18例, 女13例, 年龄32-74 (中位55)岁. 以腹膜反折为界, 高位直肠癌7例, 低位直肠癌24例. 高分化腺癌3例, 中分化腺癌20例, 低分化腺癌8例.
根据Koren et al (Dis Colon Rectum 1997; 40: 407-410) 介绍的淋巴结显示技术, 手术标本经中性甲醛固定24 h后, 于淋巴结显示液(lymph node revealing solution, LNRS)中浸泡6 h, 流水彻底冲洗后, 淋巴结呈现为白垩色的结节. 从直肠上动脉根部沿其走行进行解剖, 直至其末级分支. 系膜内的其他组织以2-3 mm间隔连续剪切、清除脂肪组织, 检取淋巴结, 测量大小并记录解剖学位置. 切取的淋巴结按分布分别石蜡包埋, 每个蜡块按20-40 m间隔连续切片, 切片厚度4 m. 然后从不同代表平面的10张切片中选取2张进行HE染色. HE阴性的淋巴结另抽取3张切片, 1张再行HE染色, 另2张行细胞角蛋白20 (cytokeratin 20, CK20) 免疫组化(immunohistochemistry, IHC)染色, 检测肿瘤微转移. 免疫组化检测采用LsAB法. CK20 mAb购自美国NeoMarkers公司, 二抗及染色试剂盒购自美国Zymed公司. 组织切片染色前置60 ℃烤箱过夜, 烘干的切片依次经二甲苯、梯度酒精脱蜡至水, 3 mL/L H2O2溶液浸泡20 min以灭活内源性过氧化物酶, 然后切片置入枸橼酸修复液中高压锅煮沸3 min充分暴露抗原. 正常山羊血清室温下封闭10 min后, 滴加1: 50稀释的鼠抗人CK20 mAb, 4 ℃孵育过夜. 滴加生物素化羊抗鼠二抗, 37 ℃反应45 min, 再滴加SP复合物, 37 ℃孵育30 min. 随后DAB显色5-8 min, 再经苏木素复染、脱水、透明、封片. 每次染色均以PBS代替一抗作阴性对照, 直肠癌组织作为阳性对照, 细胞质呈橙黄色视为阳性.
统计学处理 采用SPSS 10.0软件, 均数的比较采用t检验, 率的比较采用x2检验, P<0.05为差异有显著性.
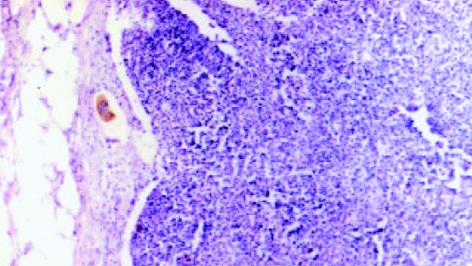
本组31例直肠癌标本, 共检获淋巴结548枚, 平均每例17.7 (3-34)枚. HE染色22例114枚淋巴结有肿瘤转移, 淋巴结转移率80.1%, 转移度20.8%. 经IHC检测, 发现18例39枚淋巴结存在肿瘤微转移, 淋巴结微转移率58.1%, 微转移度7.1%, 其中HE阴性的9例166枚淋巴结中有5例(55.6%)10枚(6.0%)淋巴结存在肿瘤微转移. 镜下观察, 直肠癌细胞CK20的阳性表达定位于胞质, 微转移灶表现为单个散在、或2-3个及数个聚集成簇的癌细胞团. 所有微转移细胞呈恶性肿瘤细胞表现, 核大、核小体清晰(图1).
本组31例548枚淋巴结, 平均直径0.41 (0.07-1.10 cm), 转移淋巴结共153枚, 平均直径0.49 (0.15-1.10 cm). 其中HE阳性淋巴结114枚, 平均直径0.52 (0.15-1.10 cm), IHC阳性淋巴结39枚, 平均直径0.39 (0.15-0.8 cm), 二者比较差异有显著性(t =4.152, P<0.01). 直径小于或等于0.2 cm淋巴结92枚(16.8%), 转移7枚, 占转移淋巴结总数的4.6%, 直径大于或等于0.5 cm淋巴结182枚(33.2%), 转移62枚(40.5%), 直径0.2-0.5 cm淋巴结274枚 (50.0%), 转移84枚(54.9%) (表1).
本组27例转移标本, 共切取淋巴结499枚. 以腹膜反折为界, 高位直肠癌5例, 切取淋巴结81枚, 分布于肿瘤旁2枚(2.5%), 转移0枚; 直肠上动脉旁79枚(97.5%), HE阳性18枚, IHC阳性4枚. 低位直肠癌22例, 检获淋巴结418枚, 分布于肿瘤旁52枚(12.4%), HE阳性7枚, IHC阳性6枚, 直肠上动脉旁333枚(79.7%), HE阳性87枚, IHC阳性23枚, 直肠中动脉旁33枚(7.9%), HE阳性2枚, IHC阳性6枚; 以肿瘤在肠壁的位置划分, 后壁直肠癌15例, 侧壁直肠癌12例 (表2).
直肠癌术后肿瘤复发、转移一直是直肠癌外科治疗中倍受关注的问题. 近20年的临床实践证明, TME可以根除传统手术中直肠系膜切除不全, 系膜内残留癌灶的隐患, 有效降低直肠癌术后局部复发率和提高5年生存率, 是治疗中、低位直肠癌的理想术式[6-8,21-22]. 直肠系膜是指盆筋膜脏层所包裹的直肠周围脂肪、血管和淋巴组织, 系膜内的淋巴结是直肠癌扩散、转移最先受累的组织. Canessa et al[19]对20例尸检标本的解剖显示, 直肠系膜淋巴结每例平均8.4枚, 71.4%位于腹膜反折上方. Topor et al[20]对7例尸检标本施行全直肠系膜切除及盆腔淋巴结清扫, 切取的标本用LNRS进行处理, 结果盆腔淋巴结每例平均24.9枚, 包括直肠系膜淋巴结每例平均13.6枚, 54%的淋巴结位于直肠后方. 本组资料中, 直肠癌系膜淋巴结每例平均17.7枚, 直肠上动脉主干及其分支旁、肿瘤旁、直肠中动脉旁淋巴结分布各占16.8%, 65.5%, 11.7%与6.0%. 最小检出淋巴结直径0.07 cm, 66.8%的淋巴结直径小于0.5 cm, 16.8%淋巴结直径小于或等于0.2 cm, 59.5%转移淋巴结直径小于0.5 cm. 这些小淋巴结尤其是直径小于或等于0.2 cm者极易在术中活检、术后的病理取材中被遗漏, 致使淋巴结检测不全, 影响病情判断[13,23-24]. 有些外科医生倾向于术中凭手扪判断淋巴结有无转移, 或以有无探及肿大的淋巴结来决定是否行淋巴结清扫. 本研究表明, 肿大的淋巴结并不一定是肿瘤转移, 而术中未探及肿大的淋巴结, 也不意味着系膜淋巴结就没有转移, 即使常规病理检查阴性的淋巴结中仍有9.0%存在肿瘤微转移.
本组资料显示, 直肠的淋巴引流与系膜血管相伴行. 直肠癌系膜淋巴结大部分沿直肠上动脉左、右侧分支(65.5%)及直肠上动脉主干(16.8%)排列, 肿瘤旁(11.7%)及直肠中动脉旁(6.0%)分布较少. 高位直肠癌淋巴转移以上行方向为主, 即自肠管肿瘤旁淋巴结开始, 沿着直肠上动脉分支向其主干方向转移, 累及肠系膜下淋巴结群, 最后到肠系膜根部淋巴结. 低位直肠癌除可发生上行转移外, 还可向侧方、下方转移. 侧方淋巴结转移主要是沿肛提肌转移至直肠中动脉旁、或穿过肛提肌注入闭孔淋巴结, 再注入髂内、髂总淋巴结. 文献报道低位直肠癌淋巴结侧方转移率10%-25%[6,12,25], 本组为19.4%, 均发生于肿瘤距齿状线5 cm以内的患者. 直肠癌淋巴结的下行转移极少见, 一般认为是正常的上行通道被肿瘤阻断后, 淋巴逆行引流所致. 本组未见下行转移病例. 本组资料还表明, 直肠癌淋巴结转移方向不仅与肿瘤在直肠所处的节段有关, 还与肿瘤在肠壁所处的方位密切相关. 结果显示, 后壁直肠癌主要是沿直肠上血管向肠系膜根部淋巴结转移, 肿瘤在直肠上动脉左、右两侧分支旁的淋巴结转移频率没有差异(P>0.05). 侧壁直肠癌可以同时发生上方与侧方淋巴结转移, 但是均以肿瘤同侧淋巴结受累为主. 本组侧壁直肠癌12例, 发生同侧直肠上动脉分支旁淋巴结转移9例, 对侧5例, 淋巴结转移度分别为43.0%与16.1%, 二者比较有显著性差异(P<0.01), 而且存在对侧直肠上动脉分支旁淋巴结转移的病例都有同侧直肠上动脉分支旁淋巴结受累. 发生同侧直肠中动脉旁淋巴结转移6例, 对侧0例, 淋巴结转移度分别为40.6%与0 (P<0.05), 其中4例仅为直肠中动脉旁淋巴结微转移.
淋巴结转移是影响直肠癌预后最主要的因素之一, 因此手术彻底清除受累淋巴结显得尤为重要. 直肠癌TME手术要求在直视下沿盆筋膜脏、壁层之间的无血管间隙进行锐性解剖, 完整的切除直肠系膜及其内的脂肪、血管和淋巴组织[17,26-27]. 为了根除肿瘤复发的隐患, 有学者主张对低位直肠癌, 尤其是低位进展期直肠癌施行包括髂总、髂内、髂外、闭孔、直肠中动脉根部淋巴结在内的扩大的盆腔淋巴结清扫[6,28]. 另有学者则指出, 侧方淋巴结清扫并不能提高根治术后5年生存率, 反而增加了手术并发症, 尤其是患者的泌尿功能及性功能严重受损, 极大地降低了术后生活质量[29-30].
根据本组资料发现, 不仅不同肠管节段的直肠癌淋巴流向不同, 不同肠壁方位的直肠癌淋巴结转移规律也存在很大的差异. 由于进展期低位直肠癌(距齿状线小于5 cm)存在一定数量的侧方淋巴结转移, 对这些患者如果不进行侧方淋巴结清扫, 残留的病变将成为术后局部复发的重要原因, 影响长期生存率; 而直肠癌不同的手术方式和淋巴结清扫范围又直接影响患者术后的生存率与生活质量, 因此我们认为, 直肠癌术式的选择应该个体化: (1)对于后壁直肠癌, 可按照TME的原则, 完整切除癌肿及包裹其周围的直肠系膜; 若术前已有证据显示肿瘤发生侧方淋巴结转移, 则同时行双侧侧方淋巴结清扫, 手术操作时仔细耐心, 注意保护盆腔自主神经, 防止术后泌尿功能及性功能障碍的发生. (2)对于侧壁直肠癌, 若癌肿局限于一侧肠壁未超过中线、且系膜未发生淋巴结转移, 可行选择性单侧全直肠系膜切除(selective unilateral total mesorectal excision, SULTME), 手术完整切除肿瘤侧直肠系膜, 而在切除对侧直肠系膜时, 靠近直肠系膜侧断离侧韧带, 尽量多保留部分直肠侧韧带组织, 以确保盆腔自主神经丛不受损伤; 若肿瘤已发生侧方淋巴结转移, 但转移仅限于肿瘤侧直肠中动脉旁而对侧尚未受累时, 尤其是对于部分肿瘤分化程度高、仅查及肿瘤侧直肠中动脉旁淋巴结微转移者, 可在TME的基础上视情况仅行单侧侧方淋巴结清扫, 以保留至少一侧盆腔神经免受损伤, 利于术后排便、排尿及性功能的恢复, 提高生活质量. 若肿瘤已发生双侧侧方淋巴结转移, 或肿瘤已超越中线累及对侧肠壁者, 手术原则同后壁直肠癌. (3)对于直肠前壁肿瘤, 手术切除遵循TME原则, 重点强调完整切除直肠前方的Denonvillier's筋膜.
编辑: N/A
| 1. | Zhang YL, Zhang ZS, Wu BP, Zhou DY. Early diagnosis for colorectal cancer in China. World J Gastroenterol. 2002;8:21-25. [PubMed] [DOI] |
| 2. | Zheng S, Liu XY, Ding KF, Wang LB, Qiu PL, Ding XF, Shen YZ, Shen GF, Sun QR, Li WD. Reduction of the incidence and mortality of rectal cancer by polypectomy: a prospective cohort study in Haining County. World J Gastroenterol. 2002;8:488-492. [PubMed] [DOI] |
| 3. | Zhou ZG, Wang Z, Yu YY, Shu Y, Cheng Z, Li L, Lei WZ, Wang TC. Laparoscopic total mesorectal excision of low rectal cancer with preservation of anal sphincter: A report of 82 cases. World J Gastroenterol. 2003;9:1477-1481. [PubMed] [DOI] |
| 6. | Dong XS, Xu HT, Yu ZW, Liu M, Cu BB, Zhao P, Wang XS. Effect of extended radical resection for rectal cancer. World J Gastroenterol. 2003;9:970-973. [PubMed] [DOI] |
| 7. | Hu JK, Zhou ZG, Chen ZX, Wang LL, Yu YY, Liu J, Zhang B, Li L, Shu Y, Chen JP. Comparative evaluation of immune response after laparoscopical and open total mesorectal excisions with anal sphincter preservation in patients with rectal cancer. World J Gastroenterol. 2003;9:2690-2694. [PubMed] [DOI] |
| 8. | Makin GB, Breen DJ, Monson JR. The impact of new technology on surgery for colorectal cancer. World J Gastroenterol. 2001;7:612-621. [PubMed] |
| 9. | Sun XN, Yang QC, Hu JB. Pre-operative radiochemotherapy of locally advanced rectal cancer. World J Gastroenterol. 2003;9:717-720. [PubMed] [DOI] |
| 10. | Demols A, Van Laethem JL. Adjuvant chemotherapy for colorectal cancer. Curr Gastroenterol Rep. 2002;4:420-426. [PubMed] [DOI] |
| 11. | Frizelle FA, Emanuel JC, Keating JP, Dobbs BR. A multicentre retrospective audit of outcome of patients undergoing curative resection for rectal cancer. N Z Med J. 2002;115:284-286. [PubMed] |
| 12. | Shimoyama M, Yamazaki T, Suda T, Hatakeyama K. Prognostic significance of lateral lymph node micrometastases in lower rectal cancer: an immunohistochemical study with CAM5.2. Dis Colon Rectum. 2003;46:333-339. [PubMed] [DOI] |
| 13. | Andreola S, Leo E, Belli F, Gallino G, Sirizzotti G, Sampietro G. Adenocarcinoma of the lower third of the rectum: metastases in lymph nodes smaller than 5 mm and occult micrometastases; preliminary results on early tumor recurrence. Ann Surg Oncol. 2001;8:413-417. [PubMed] [DOI] |
| 14. | Chen K, Cai J, Liu XY, Ma XY, Yao KY, Zheng S. Nested case-control study on the risk factors of colorectal cancer. World J Gastroenterol. 2003;9:99-103. [PubMed] [DOI] |
| 15. | Yuan HY, Li Y, Yang GL, Bei DJ, Wang K. Study on the causes of local recurrence of rectal cancer after curative resection: analysis of 213 cases. World J Gastroenterol. 1998;4:527-529. [PubMed] [DOI] |
| 17. | Vironen JH, Halme L, Sainio P, Kyllönen LE, Scheinin T, Husa AI, Kellokumpu IH. New approaches in the management of rectal carcinoma result in reduced local recurrence rate and improved survival. Eur J Surg. 2002;168:158-164. [PubMed] [DOI] |
| 18. | Bülow S, Christensen IJ, Harling H, Kronborg O, Fenger C, Nielsen HJ; Danish TME Study Group; RANX05 Colorectal Cancer Study Group. Recurrence and survival after mesorectal excision for rectal cancer. Br J Surg. 2003;90:974-980. [PubMed] [DOI] |
| 19. | Canessa CE, Badia F, Fierro S, Fiol V, Hayek G. Anatomic study of the lymph nodes of the mesorectum. Dis Colon Rectum. 2001;44:1333-1336. [PubMed] [DOI] |
| 20. | Topor B, Acland R, Kolodko V, Galandiuk S. Mesorectal lymph nodes: their location and distribution within the mesorectum. Dis Colon Rectum. 2003;46:779-785. [PubMed] [DOI] |
| 21. | Wibe A, Møller B, Norstein J, Carlsen E, Wiig JN, Heald RJ, Langmark F, Myrvold HE, Søreide O; Norwegian Rectal Cancer Group. A national strategic change in treatment policy for rectal cancer--implementation of total mesorectal excision as routine treatment in Norway. A national audit. Dis Colon Rectum. 2002;45:857-866. [PubMed] [DOI] |
| 22. | Ridgway PF, Darzi AW. The role of total mesorectal excision in the management of rectal cancer. Cancer Control. 2003;10:205-211. [PubMed] [DOI] |
| 23. | Cserni G. The influence of nodal size on the staging of colorectal carcinomas. J Clin Pathol. 2002;55:386-390. [PubMed] [DOI] |
| 24. | Nagtegaal ID, van Krieken JH. The role of pathologists in the quality control of diagnosis and treatment of rectal cancer- an overview. Eur J Cancer. 2002;38:964-972. [PubMed] [DOI] |
| 25. | Ueno H, Mochizuki H, Hashiguchi Y, Hase K. Prognostic determinants of patients with lateral nodal involvement by rectal cancer. Ann Surg. 2001;234:190-197. [PubMed] [DOI] |
| 26. | Wibe A, Eriksen MT, Syse A, Myrvold HE, Søreide O; Norwegian Rectal Cancer Group. Total mesorectal excision for rectal cancer--what can be achieved by a national audit? Colorectal Dis. 2003;5:471-477. [PubMed] [DOI] |
| 27. | Kneist W, Heintz A, Junginger T. Intraoperative identification and neurophysiologic parameters to verify pelvic autonomic nerve function during total mesorectal excision for rectal cancer. J Am Coll Surg. 2004;198:59-66. [PubMed] [DOI] |
| 28. | Fujita S, Yamamoto S, Akasu T, Moriya Y. Lateral pelvic lymph node dissection for advanced lower rectal cancer. Br J Surg. 2003;90:1580-1585. [PubMed] [DOI] |