修回日期: 2003-09-15
接受日期: 2003-10-18
在线出版日期: 2004-03-15
目的: 研究鸦胆子油乳体外诱导人肝癌细胞SMMC-7721凋亡的作用及对细胞周期和凋亡相关基因p53和Bcl-2表达的影响, 探讨其抗肿瘤机制.
方法: MTT法检测鸦胆子油乳不同浓度和作用时间对肝癌细胞的抑制增生作用; 透射电镜观察细胞形态学改变; 琼脂糖凝胶电泳分析DNA特征; 流式细胞仪检测细胞凋亡和细胞周期分布; 免疫细胞化学染色检测p53和Bcl-2的表达.
结果: 鸦胆子油乳对人肝癌细胞SMMC-7721具有显著的抑制增生作用, 且有时间和浓度依赖性. 透射电镜和凝胶电泳可观察到凋亡特征性的形态学和生化特征改变. 0.10 g/L鸦胆子油乳作用12, 24, 48 h后, 流式细胞仪分析可见典型的亚二倍体峰, 细胞周期阻滞于G0/G1期, 与对照组相比有显著性差异(P<0.05). p53和Bcl-2在经鸦胆子油乳作用后表达水平均下降, 二者呈正相关(r = 0.966, P<0.05), p53下降更为明显.
结论: 鸦胆子油乳体外对肝癌细胞SMMC-7721有显著的抑制增生作用, 能诱导凋亡、阻滞细胞周期于G0/G1期, 抑制p53和Bcl-2的表达是其重要机制, 其中p53途径起主导作用.
引文著录: 马力, 张月宁. 鸦胆子油乳诱导肝癌细胞凋亡及对相关基因表达的影响. 世界华人消化杂志 2004; 12(3): 559-562
Revised: September 15, 2003
Accepted: October 18, 2003
Published online: March 15, 2004
AIM: To explore the anti-tumor mechanism of seminal oil emulsion of Brucea javanica by studying in vitro its effects on apoptosis, cell cycle and expression of apoptosis-related genes p53 and Bcl-2 in human hepatocellular carcinoma cell line SMMC-7721.
METHODS: Anti-proliferation effect was measured by MTT assay. The morphology of cells was observed under transmission electron microscope. Agarose gel electrophoresis was used to analyze DNA character and the flow cytometry to detect apoptotic rate and cell cycle distribution. The levels of p53 and Bcl-2 protein were examined by immunocytochemical staining.
RESULTS: The proliferation of hepatocellular carcinoma cell line SMMC-7721 could be remarkably inhibited by seminal oil emulsion of Brucea javanica in a time- and concentration-dependent manner. Morphological and biochemical changes characteristic of apoptosis were observed through electron microscope and agarose gel electrophoresis. After 12, 24, 48 h incubation with 0.10 g/L emulsion of seminal oil of Brucea javanica, the flow cytometry showed typical subdiploid peaks and the cell cycle was arrested at G0/G1 phase(P < 0.05). The expression of p53 and Bcl-2 was down-regulated after exposure to the drug, with a positive correlation between them (r = 0.966, P < 0.05).
CONCLUSION: Seminal oil emulsion of Brucea javanica can significantly inhibit the proliferation of human hepatocellular carcinoma cell line SMMC-7721 in vitro through inducing apoptosis and arresting cell cycle at G0/G1 phase, and its underlying mechanism is related to the down-regulating mutant type p53 as well as Bcl-2, with p53 pathway playing a leading role.
- Citation: Ma L, Zhang YN. Effects of seminal oil emulsion of Brucea javanica on apoptosis and apoptosis-related genes in human hepatocellular carcinoma cells. Shijie Huaren Xiaohua Zazhi 2004; 12(3): 559-562
- URL: https://www.wjgnet.com/1009-3079/full/v12/i3/559.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i3.559
诱导肿瘤细胞凋亡是许多化疗药物(也包括一些中药)发挥抗肿瘤作用的主要机制之一[1-4]. 肿瘤细胞凋亡与化疗敏感性有关, 凋亡调控机制障碍对刺激不敏感是肿瘤耐药的重要原因[5-8]. 诱导肿瘤细胞凋亡及寻找有效的凋亡诱导药物仍是目前肿瘤治疗研究的热点之一[9-13]. 细胞凋亡是诱导基因、抑制基因和双向控制基因相互作用的结果, p53和Bcl-2在其中发挥着重要作用[14-16]. 一旦发生凋亡相关基因的突变或缺失, 就会导致细胞凋亡失控, 引起疾病的发生[17]. 鸦胆子系苦木科鸦胆子属植物Brucea javanica (L.)Merr的成熟果实, 其醇提取物对多种瘤株有抑制作用[18-19]. 鸦胆子油具有抗癌及抗动脉栓塞的双重作用, 因此被用于介入治疗[20]. 我们研究了鸦胆子油乳体外对人肝癌细胞SMMC-7721抑制生长和诱导凋亡的作用, 及对p53, Bcl-2表达的影响.
人肝癌细胞系SMMC-7721由兰州大学生物学院提供; 100 g/L鸦胆子油乳由浙江三九邦而康药业有限公司提供; RPMI1640: Gibco公司; 小牛血清: 杭州四季青生物工程材料研究所; MTT, SDS, 细胞凋亡电泳检测试剂盒: Sigma公司; 鼠抗人p53、鼠抗人Bcl-2、免疫细胞化学SP药盒、DAB显液: Biotech公司. 细胞在含100 ml/L小牛血清的RPMI 1640培养液中于37 ℃, 50 ml/L CO2、饱和湿度的孵箱中培养. 鸦胆子油乳用培养液稀释成工作浓度.
鸦胆子油乳对SMMC-7721细胞的毒性作用采用MTT比色法. 取对数生长期的细胞以5×104个/孔接种于96孔培养板中培养, 24h后弃培养液. 实验组加入鸦胆子油乳, 据预实验结果设立0.05, 0.10, 0.25, 0.50, 1.00 g/L组; 对照组仅加入等量培养液; 调零组为等量培养液, 不含细胞及药物. 每组设4个复孔. 分别培养8, 20, 44, 68 h后弃培养液, 每孔加入MTT (1 g/L)50 L, 继续培养4 h, 弃上清液, 每孔加入100 g/L SDS 100 L, 37 ℃孵育30 min, 酶标仪(EXL800型, 威士达公司)测定各孔于570 nm波长处的吸光度A(OD)值. 用以下公式计算抑制率(IR)=(1-实验组A值/对照组A值)×100%. 将对照组及0.10 g/L鸦胆子油乳作用12, 24, 48 h的细胞消化, 制成单细胞悬液(各样本细胞数大于109/L). 离心, PBS洗2次, 4 ℃预冷700 ml/L乙醇固定12 h后, 用流式细胞仪(Epic SXL型: Coulter公司)检测凋亡百分率和各细胞周期所占百分比. 收集对照组及0.05, 0.10, 0.50 g/L鸦胆子油乳作用48h的细胞(每个样本约2×106个细胞), 按试剂盒要求提取DNA, 15 g/L琼脂糖凝胶进行电泳, 紫外灯下观察, 照相. 胰酶消化对照组及0.10 g/L鸦胆子油乳作用48 h的细胞制成细胞悬液, 离心弃上清, 25 g/L戊二醛固定, 制备超薄切片, 双铅染色, 电镜(日本JEM100CX型)下观察并照相. 收集对照组及0.10 g/L鸦胆子油乳作用12, 24, 48 h的细胞, 制成细胞悬液, 均匀涂于防脱片, 40 g/L多聚甲醛固定, 采用SP染色法, DAB显色(操作步骤按说明书). 一抗和二抗工作浓度均为1: 200. 阴性对照取PBS代替一抗; 阳性对照为已知p53, Bcl-2阳性的乳腺癌组织切片. 图像分析系统(THW-5002型: 四川联合大学)下测定p53, Bcl-2阳性细胞数, 测量窗面积为100 m2, 放大40倍.
统计学处理 实验数据均由3次以上独立的实验得出, 结果用mean±SD表示. 应用SPSS 10.0软件进行单因素方差分析和直线相关分析.
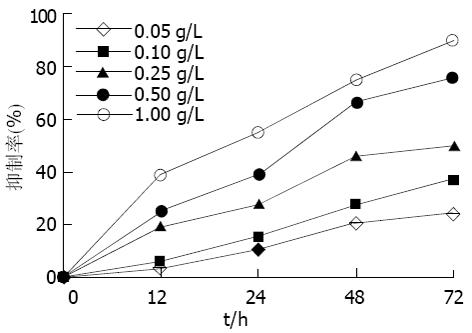
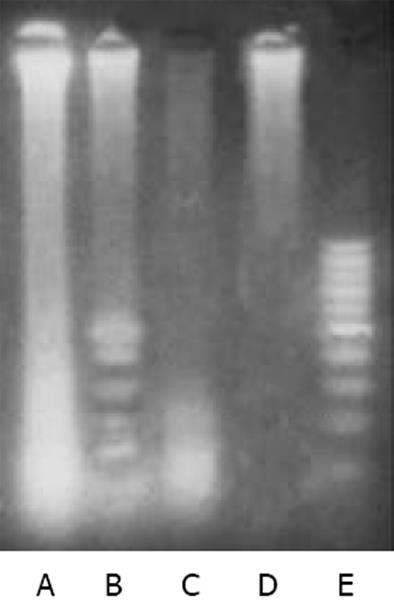
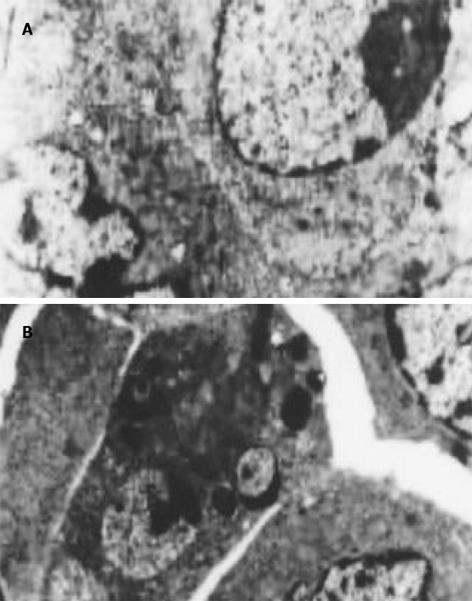
MTT检测结果显示鸦胆子油乳处理肝癌细胞后, 其生长增生被抑制, 实验组与对照组相比有显著性差异(P<0.01). 随着药物浓度提高和作用时间延长, 抑制率亦相应增大(图1). 经鸦胆子油乳作用后, 流式图上G1期前出现典型的亚二倍体峰, 48 h达(25.7%±3.8%), 显著高于对照组(P<0.01). G0/G1期细胞比率上升, S期和G2/M期细胞比率下降, 表明细胞周期被阻滞于G0/G1期(表1). 0.05和0.10 g/L浓度组作用48 h后电泳均出现凋亡特征性的梯状带, 0.10 g/L浓度组较明显. 0.50 g/L浓度组条带模糊, 无梯状带出现(图2). 透射电镜下观察, 正常细胞的胞膜完整, 细胞核和细胞器亚微结构清晰. 0.10 g/L乳鸦胆子油乳作用48 h后, 同一电镜切片中可观察到细胞凋亡不同时期典型的形态学改变, 表现为胞质浓缩、空泡形成; 核固缩, 染色质向核膜聚集, 呈块状或新月形小体; 胞膜出泡和凋亡小体形成, 但细胞器保持相对完整(图3).
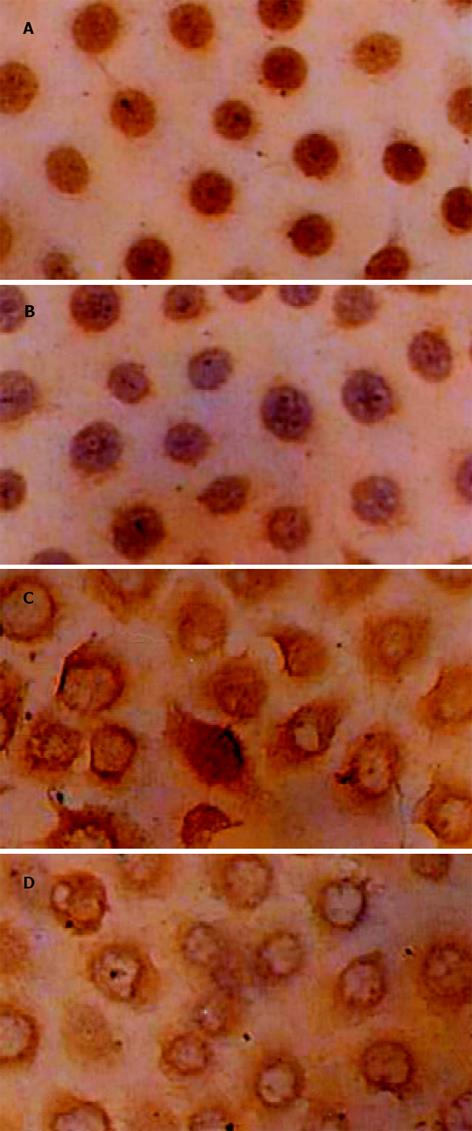
阳性细胞染成棕黄色或棕褐色, p53免疫反应定位于胞核, Bcl-2免疫反应定位于胞膜、胞质及核膜(图4). 对照组p53和Bcl-2均呈高表达, 经0.10 g/L鸦胆子油乳作用后表达水平下降, p53较Bcl-2显著, 二者呈正相关(r = 0.966, P<0.05), 这种作用有时间依赖性(表2).
本实验结果表明, 鸦胆子油乳可以诱导肝癌细胞凋亡. 电泳图显示0.05, 0.10 g/L浓度组出现细胞凋亡特征性的梯状带, 后者较明显, 而0.25 g/L浓度组无梯状带出现. 表明鸦胆子油乳在低浓度时以诱导细胞凋亡为主, 高浓度时可能以引起细胞坏死为主, 因此其诱导凋亡作用与浓度有关. 0.10 g/L鸦胆子油乳处理肝癌细胞12 h后在流式图上即出现典型的亚二倍体峰, 且随时间延长而增高, 表明鸦胆子油乳诱导肝癌细胞凋亡也呈时间依赖性. 因此, 从诱导凋亡角度看, 应选择合适的药物浓度和作用时间, 这样既能清除肿瘤细胞, 又能避免正常细胞因药物剂量过大和作用时间过长而受到损害. 通过测定细胞凋亡, 既能根据肿瘤细胞对药物的反应性优选敏感药物, 又可通过观察细胞凋亡率的变化确定合适的药物浓度[7,21].
作为细胞周期重要的负性调控因子, p53在维持基因组稳定性、调控细胞凋亡和细胞周期中起重要作用[14-15,22-23]. 野生型p53的蛋白产物能阻滞DNA受损的细胞于G1期, 抑制DNA合成, 诱导DNA修复, 修复不成功则诱导其凋亡[24]. 突变型p53失去这种监控作用, 可导致细胞增生失控发生肿瘤[25]. 野生型p53蛋白半衰期短, 含量很低, 而突变型p53蛋白稳定性增加, 因此常规免疫化学检测的p53蛋白被认为是突变型p53基因的产物. Bcl-2能抑制细胞凋亡, 延长细胞存活[26-27]. 其过表达可导致细胞对多种促凋亡因素耐受, 而表达下调可诱导细胞凋亡[28]. 本文结果显示, 鸦胆子油乳作用后, 肝癌细胞p53和Bcl-2表达水平均下降, p53较显著, 细胞凋亡增加, 细胞周期被阻滞于G0/G1期, 表明抑制突变型p53和Bcl-2的表达, 甚至诱导部分突变型p53恢复成野生型p53, 是其调控细胞凋亡和细胞周期的重要机制, 其中p53起了主导作用. 由于p53和Bcl-2的下降呈正相关, 而Bcl-2的表达受p53调控, 故推测p53参与了鸦胆子油乳对Bcl-2表达的下调作用.
从鸦胆子中可以分离出一系列苦木内酯成分, 其抗癌活性主要与其所含的不饱和脂肪酸, 特别是油酸、亚油酸有关. 鸦胆子抗肿瘤的机制包括不饱和脂肪酸抑制癌细胞DNA合成, 破坏肿瘤生物膜结构, 增强机体细胞免疫能力, 增强自然杀伤细胞对肿瘤细胞的敏感性, 通过激活凝血系统形成血栓起栓塞作用, 鸦胆子油乳可促进骨髓干细胞形成, 与放疗和/或化疗联合应用有一定的防止白细胞和血小板降低的作用[20]. 俞丽芬et al[29] 研究表明鸦胆子油乳对人胃腺癌耐药细胞的耐药性有逆转作用. 本实验明确了鸦胆子油乳对肝癌细胞有明显的抑制生长作用, 诱导细胞凋亡、阻滞细胞周期于G0/G1期是其抗肿瘤的重要机制; p53和Bcl-2表达水平的调节在不同程度上参与了这一过程. 本研究为临床应用鸦胆子油乳治疗肝癌提供了有力的实验证据和理论依据, 同时也为进一步研究、开发我国特有的鸦胆子类药物开创了广阔前景.
编辑: N/A
| 2. | Kleibl Z, Raisová M, Novotný J, Pohlreich P, Matous B. [Apoptosis and its importance in the development and therapy of tumors (review)]. Sb Lek. 2002;103:1-13. [PubMed] |
| 5. | Yang HH, Ma MH, Vescio RA, Berenson JR. Overcoming drug resistance in multiple myeloma: the emergence of therapeutic approaches to induce apoptosis. J Clin Oncol. 2003;21:4239-4247. [PubMed] [DOI] |
| 6. | Elliott MJ, Farmer MR, Atienza C Jr, Seilwell A, Dong YB, Yang HL, Wong SL, McMasters KM. E2F-1 gene therapy induces apoptosis and increases chemosensitivity in human pancreatic carcinoma cells. Tumour Biol. 2002;23:76-86. [DOI] |
| 7. | Makin G, Dive C. Modulating sensitivity to drug-induced apoptosis: the future for chemotherapy? Breast Cancer Res. 2001;3:150-153. [PubMed] [DOI] |
| 8. | Luk'ianova NIu, Kulik GI, Chehun VF. [Role of the p53 and bcl-2 genes in apoptosis and drug resistance of tumors]. Vopr Onkol. 2000;46:121-128. [PubMed] |
| 9. | Yang LQ, Fang DC, Wang RQ, Yang SM. Effect of NF-kappaB, survivin, Bcl-2 and Caspase3 on apoptosis of gastric cancer cells induced by tumor necrosis factor related apoptosis inducing ligand. World J Gastroenterol. 2004;10:22-25. [PubMed] |
| 10. | Thorburn A, Thorburn J, Frankel AE. Induction of apoptosis by tumor cell-targeted toxins. Apoptosis. 2004;9:19-25. [PubMed] [DOI] |
| 12. | 李 小安, 房 殿春, 司 佩任, 张 汝刚, 杨 柳芹, 秦 建平. TRAIL诱导肝癌细胞系SMMC-7721的凋亡作用. 世界华人消化杂志. 2003;11:1369-1371. [DOI] |
| 16. | Fu YF, Fan TJ. Bcl-2 family proteins and apoptosis. Shengwu Huaxue Yu Shengwu Wuli Xuebao. 2002;34:389-394. |
| 17. | Chan WY, Cheung KK, Schorge JO, Huang LW, Welch WR, Bell DA, Berkowitz RS, Mok SC. Bcl-2 and p53 protein expression, apoptosis, and p53 mutation in human epithelial ovation cancers. Am J Pathol. 2000;156:409-417. [DOI] |
| 18. | Luyengi L, Suh N, Fong HH, Pezzuto JM, Kinghorn AD. A lignan and four terpenoids from Brucea javanica that induce differentiation with cultured HL-60 promyelocytic leukemia cells. Phytochemistry. 1996;43:409-412. [DOI] |
| 19. | Xuan YB, Yasuda S, Shimada K, Nagai S, Ishihama H. [Growth inhibition of the emulsion from to Brucea javanica cultured human carcinoma cells]. Gan To Kagaku Ryoho. 1994;21:2421-2425. [PubMed] |
| 23. | Hickman ES, Moroni MC, Helin K. The role of p53 and pRB in apoptosis and cancer. Curr Opin Genet Dev. 2002;12:60-66. [DOI] |
| 24. | Schuler M, Green DR. Mechanisms of p53-dependent apoptosis. Biochem Soc Trans. 2001;29:684-688. [PubMed] [DOI] |
| 25. | Cappello F, Bellafiore M, Palma A, Bucchieri F. Defective apoptosis and tumorigenesis: role of p53 mutation and Fas/FasL system dysregulation. Eur J Histochem. 2002;46:199-208. [DOI] |
| 26. | Humlová Z. Protooncogene bcl-2 in process of apoptosis. Review article. Sb Lek. 2002;103:419-425. [PubMed] |
| 27. | Deveraux QL, Schendel SL, Reed JC. Antiapoptotic proteins. The Bcl-2 and inhibitor of apoptosis protein families. Cardiol Clin. 2001;19:57-74. [DOI] |
| 28. | Klasa RJ, Gillum AM, Klem RE, Frankel SR. Oblimersen Bcl-2 antisense: facilitating apoptosis in anticancer treatment. Antisense Nucleic Acid Drug Dev. 2002;12:193-213. [PubMed] [DOI] |