修回日期: 2003-08-20
接受日期: 2003-09-18
在线出版日期: 2004-02-15
目的: 建立一种灵敏、特异和简便实用的细胞周期蛋白D1(Cyclin D1) mRNA表达水平的检测手段.
方法: 生物素标记Cyclin D1 5'端引物, PCR DIG Labeling Mix取代dNTP, RT-PCR终产物置于链霉亲和素包被的ELISA板中孵育, 洗涤、显色后, 自动酶联检测仪测A450nm值. 常规RT-PCR方法作对照. 检测对象包括Cyclin D1表达细胞系SGC7901, 转染反义Cyclin D1基因的SGC7901D1AS细胞及转染空载体的SGC7901neo细胞, 原发性胃癌组织30例、胃癌旁和正常胃黏膜组织20例, 胃良性病变组织22例.
结果: RT-PCR ELISA与RT-PCR琼脂糖电泳检测结果吻合, 所测得的A450nm值与Cyclin D1特异性基因片段的丰度和检测细胞数量有一很好的对应关系. SGC7901胃癌细胞转染Cyclin D1反义基因后, Cyclin D1mRNA表达显著降低(P<0.05). Cyclin D1 mRNA在胃良性疾病起即开始明显升高(P<0.05). 在胃癌各组中, 进展期胃癌伴转移组的Cyclin D1 mRNA表达水平显著高于其他两组(P<0.05).
结论: 本文建立的Cyclin D1 RT-PCR ELISA可作为一种侯选的、较为简便和半定量的cyclin D1 mRNA检测方法.
引文著录: 陈兵, 张雪, 府伟灵, 常杭花, 刘为纹, 徐采朴, 史景泉. 细胞周期蛋白D1 RT-PCR ELISA的建立及其初步应用. 世界华人消化杂志 2004; 12(2): 473-475
Revised: August 20, 2003
Accepted: September 18, 2003
Published online: February 15, 2004
N/A
- Citation: N/A. N/A. Shijie Huaren Xiaohua Zazhi 2004; 12(2): 473-475
- URL: https://www.wjgnet.com/1009-3079/full/v12/i2/473.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i2.473
酶联免疫黏附测定法(enzyme linked immunosorbent assay, ELISA)是临床检测中最常用的方法, 具有半定量、自动化程度高和可大批量检测的优势[1]. 逆转录聚合酶链式反应(RT-PCR)是一种检测mRNA水平的高灵敏度方法[2]. 本文中建立的细胞周期蛋白D1 (Cyclin D1) RT-PCR ELISA结合了两种方法的优点, 旨在建立一种灵敏、特异和简便实用的Cyclin D1 mRNA表达水平的检测手段.
细胞标本: 人胃癌细胞系SGC7901由军事医学科学院提供, 为Cyclin D1表达阳性细胞系[3], 来源于伴淋巴结转移的胃癌组织, 其培养及生物学特性见文献[4]. 稳定表达反义Cyclin D1基因的SGC7901衍生细胞SGC7901D1AS及转染其空载体的细胞SGC7901neo为自行制备, 其培养及生物学特性见文献[3].
组织标本: 分别取自我院、第三军医大学大坪医院和重庆市第九人民医院手术和胃镜活检标本, 均经临床和病理诊断, 无化疗和放疗经历. 标本搜集至DEPC处理后的容器中速冻, -80 ℃贮藏备用[2,5].
1.2.1 引物及其生物素标记: Cyclin D1引物根据文献[6]设计, 由上海生工生物工程公司合成. 其序列为: 5'-AAGCCTCAGCCCTCCCCAGCTGCCAG-3'; 5'-AACCAACAACAAGGAGGATG-3'. 按军事医学科学院"生物素核酸标记和检测试剂盒"使用说明书进行标记[7].
1.2.2 RT-PCR: 细胞和组织标本总RNA的提取按Boehringer Mannheim公司TriPureTM Isolation Reagent Kit说明书进行. RT-PCR参照Boehringer Mannheim公司TitanTM One Tube RT-PCR System说明书及文献[8]进行.
1.2.3 RT-PCR ELISA: RT-PCR ELISA中RT-PCR条件不变, 但用生物素标记的Cyclin D1 5'端引物替代其中原未标记的引物, 用PCR DIG Labeling Mix取代dNTP. 阳性对照为SGC7901细胞, 阴性对照为K562细胞[3]. 扩增产物按下述流程进行检测: 扩增产物5 μL与0.01 mol/L pH7.5 PBS 300 μL混匀, 100 μL/孔加入Streptavidin-coated Microtite (链霉亲和素包被的ELISA板, Boehringer Mannheim公司)中, 37 ℃、300 r/min振荡孵育2 h, 弃液、PBS-T 250 μL/孔, 30 S×3, 加入10mU/mL Anti-DIG-POD工作液100 μL/孔, 37℃、300 r/min振荡孵育30 min, 弃液、PBS-T 250 μL/孔, 30 S×3, 加TMB底物液100 μL/孔, 37℃、300 r/min振荡孵育17 min, 加终止液100 μL /孔, EIA V. 1.8-0自动酶联检测仪测A450nm值.
统计学处理 利用STATISTICA/W5.0统计软件进行统计学分析. 统计项目包括Descriptive statictics、t-test和χ2检验.
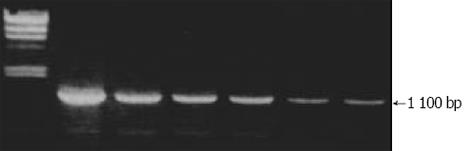
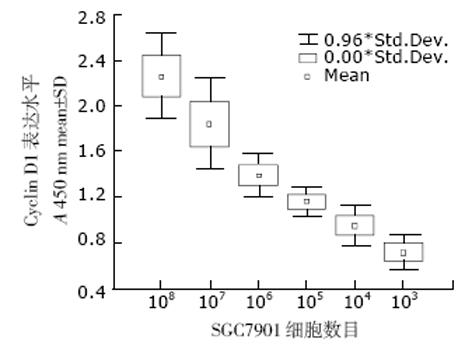
文献报道应用免疫细胞化学和原位杂交的方法证实SGC7901胃癌细胞中有Cyclin D1 蛋白和mRNA的高表达[3,9-10]. 本文RT-PCR的方法也检出Cyclin D1 mRNA在此细胞中表达. RT-PCR琼脂糖电泳检测结果可见1 100 bp的Cyclin D1特异性基因片段出现, 其丰度随细胞数量的减低而减低(图1). 而本文中建立的RT-PCR ELISA检测的结果(图2)与RT-PCR琼脂糖电泳检测结果吻合, 且所测得的A450nm值与Cyclin D1特异性基因片段的丰度和检测细胞数量有一很好的对应关系.
利用Cyclin D1 RT-PCR ELISA对SGC7901胃癌细胞及其衍生细胞SGC7901neo、SGC7901D1AS, 未经治疗的原发性胃癌30例、食管癌6例、结肠癌6例, 胃癌旁和正常胃黏膜组织20例, 胃良性病变组织22例进行检测. 检测数据及统计结果见表1和表2. SGC7901胃癌细胞转染Cyclin D1反义基因后, Cyclin D1 mRNA表达显著降低(P<0.05). 由表2看出, Cyclin D1 mRNA在胃良性疾病起即开始明显升高(P<0.05). 在胃癌各组中, 进展期胃癌伴转移组的Cyclin D1 mRNA表达水平显著高于其他两组(P<0.05), 但早期胃癌组的Cyclin D1 mRNA表达水平与进展期胃癌组差别不明显(P>0.05).
Cyclin D1是目前研究较为深入的一种G1期Cyclin, 其异常高表达在多种肿瘤中检出[3,9-10], 被认是癌基因. 因此探索简便、有效的Cyclin D1表达检测手段具有较好的科学研究和临床应用意义[10]. 常用检测Cyclin D1 mRNA表达方法有Northern blot、原位杂交、RT-PCR[3,9]. 其中RT-PCR具有灵敏度高、操作相对简便的优点, 但在大规模检测、检测结果半定量尚显不足. RT-PCR ELISA则可弥补常规RT-PCR的不足. 我们建立的Cyclin D1 RT-PCR ELISA除去空白和对照外, 每个ELISA板可检测40个复孔样本, 通过呈色反应可获得数量化的结果数据. 本文在同一标本的不同量的检测中, Cyclin D1 RT-PCR ELISA检测结果与Cyclin D1 RT-PCR 琼脂糖电泳检测结果吻合, 且所测得的A 450nm值与Cyclin D1特异性基因片段的丰度和检测细胞数量有很好的对应关系. 同时在多标本的Cyclin D1 RT-PCR ELISA检测中, 证实胃癌组织中Cyclin D1 mRNA异常高表达, 与文献报道的用其他方法如RT-PCR、Northern blot和原位杂交的检测结果相同[3,9]. 同时还发现Cyclin D1 mRNA在胃良性疾病起即开始明显升高(P<0.05),早期胃癌组的Cyclin D1 mRNA表达水平与进展期胃癌组差别不明显(P>0.05). 可能与RT-PCR ELISA具有自动化大批量半定量检测的优势有关, 减少了批间差异和主观评估的影响, 使检测的灵敏度和特异性有所提高. Cyclin D1 RT-PCR ELISA细胞学检测结果表明, 细胞中Cyclin D1 mRNA水平与Cyclin D1表达的受抑与否有明确的对应关系(表1). 这些结果提示本文建立的Cyclin D1 RT-PCR ELISA可能具备了RT-PCR和ELISA两种方法的优点, 可作为一种侯选的、较为简便和半定量的Cyclin D1 mRNA检测方法.
第三军医大学数学教研室罗明奎主任在本课题结果统计分析的工作中给予了无私的指导和帮助.
编辑: N/A
| 1. | Plested JS, Coull PA, Gidney MA. ELISA. Methods Mol Med. 2003;71:243-261. [PubMed] |
| 2. | Emrich T, Karl G. Nonradioactive detection of telomerase activity using a PCR-ELISA-based telomeric repeat amplification protocol. Methods Mol Biol. 2002;191:147-158. [PubMed] [DOI] |
| 3. | Chen B, Zhang XY, Zhang YJ, Zhou P, Gu Y, Fan DM. Antisense to cyclin D1 reverses the transformed phenotype of human gastric cancer cells. World J Gastroenterol. 1999;5:18-21. [PubMed] [DOI] |
| 5. | Freeman WM, Walker SJ, Vrana KE. Quantitative RT-PCR: pitfalls and potential. Biotechniques. 1999;26:112-122, 124-125. [PubMed] |
| 6. | Jiang W, Kahn SM, Tomita N, Zhang YJ, Lu SH, Weinstein IB. Amplification and expression of the human cyclin D gene in esophageal cancer. Cancer Res. 1992;52:2980-2983. [PubMed] |
| 7. | 苑 锡同, 李 德荣, 李 晓萸, 黄 如统. 逆转录PCR-生物素探针杂交法鉴定戊型肝炎病毒. 军事医学科学院 院刊. 1995;19:161-166. |
| 8. | Manayani DJ, Cherian T, Murali N, Finny GJ, Green J, Brown D, Ravi V, Abraham M, Sridharan G. Evaluation of a one-tube RT-PCR system for detection of enteroviruses. J Clin Virol. 2002;24:25-30. [PubMed] [DOI] |
| 9. | Oda K, Okabayashi T, Kataoka M, Takeda A, Shibuya Y, Orita K, Tanaka N. Evaluation of cyclin D1 mRNA expression in gastric and colorectal cancers. Res Commun Mol Pathol Pharmacol. 1999;105:237-252. [PubMed] |
| 10. | Vermeulen K, Van Bockstaele DR, Berneman ZN. The cell cycle: a review of regulation, deregulation and therapeutic targets in cancer. Cell Prolif. 2003;36:131-149. [PubMed] [DOI] |