修回日期: 2003-10-10
接受日期: 2003-11-06
在线出版日期: 2004-02-15
目的: 观察大鼠实验性溃疡性结肠炎脾淋巴细胞, 肠组织和血清中, 细胞因子的表达及达纳康对其的影响, 探讨达纳康对溃疡性结肠炎的保护作用及其机制.
方法: 用三硝基苯磺酸(TNBS)建立大鼠溃疡性结肠炎模型. 将动物随机分为空白对照组、三硝基苯磺酸、三硝基苯磺酸+生理盐水组、三硝基苯磺酸+达纳康组四组观察肠道大体形态和组织学改变. 采用ELISA法测定脾细胞、大肠黏膜及血清中的白介素-12(IL-12)、干扰素α(IFN-α)和白介素4 (IL-4).
结果: 与三硝基苯磺酸组比较三硝基苯磺酸+达纳康损伤指数明显下降(2.83±0.94 vs 5.33±1.50, P<0.01, 1.92±0.67 vs 4.33±0.98, P<0.01). IFN-α浓度明显下降. 脾细胞: 60±21.5 vs 125.6±14.6, P<0.01大肠黏膜: 202.8±49.6 vs 431.8±57.6, P<0.01血清: 8.6±1.4 vs 13.5±1.7, P<0.01. 与模型组比较TNBS组+EGb组IL-4浓度明显升高(脾细胞: 11.2±1.3 vs 6.05±1.5, P<0.01大肠黏膜: 10.2±1.9 vs 6.9±1.4, P <0.01血清: 7.9±1.8 vs 4.2±1.1, P<0.01). 血清IL-12浓度明显下降(8.2±2.2 vs 25.8±4.8, P <0.01)血清IL-12/IL-4比值下降(1.13±0.49 vs 6.4±1.8, P<0.01). IFN-α/IL-4比值明显下降 (脾细胞: 5.2±2.0 vs 21.9±4.9, P<0.01, 大肠黏膜: 20.9±7.97 vs 65.9±18, P<0.01; 血清: 1.1±0.3 vs 3.4±0.8, P<0.01).
结论: TNBS诱导的大鼠UC模型是Th1(IL-12)亚型为主的免疫应答反应, EGb通过抑制IL-12, IFN-α生成, 恢复Th1/Th2细胞因子的平衡, 发挥对溃疡性结肠炎的保护作用.
引文著录: 周燕红, 于皆平, 何小飞, 余细球. 达纳康对大鼠溃疡性结肠炎细胞因子的影响. 世界华人消化杂志 2004; 12(2): 371-375
Revised: October 10, 2003
Accepted: November 6, 2003
Published online: February 15, 2004
AIM: To investigate the effects of Ginkgo biloba extract (Egb) on cytokine profile produced by splenocytes, colonic mucosa and serum and to study the main mechanism of EGb in protection of TNBS-induced ulcerative colitis in rats.
METHODS: A rat ulcerative colitis model was induced by 2.4.6-trinitrobenzene sulfonic acid (TNBS). All rats were divided into four groups: normal, TNBS, TNBS+NS, and TNBS+EGb. The macroscopical and histological changes of the colon were evaluated. The IL-12, IFN-α and IL-4 produced by splenocytes, colonic mulosal and serum were analyzed with ELISA.
RESULTS: In TNBS+EGb group, the macroscopical and histological scores were significantly lower than those of TNBS group (2.83±0.94 vs 5.33±1.50, P < 0.01, 1.92±0.67 vs 4.33±0.98, P < 0.01). In the TNBS+EGb group, a lower level of IFN-α production in splenocytes (60±21.5 vs 125.6±14.6, P < 0.01); colonic mucosa (202.8±49.6 vs 431.8±57.6, P < 0.01) and serum (8.6±1.4 vs 13.5±1.7, P < 0.01) was noticed as compared with TNBS group. In comparison with TNBS group, significantly increased IL-4 was noticed (splenocytes: 11.2±1.3 vs 6.05±1.5, P < 0.01; colonic mucosa: 10.2±1.9 vs 6.9±1.4, P < 0.01; serum: 7.9±1.8 vs 4.2±1.1, P < 0.01) in TNBS+EGb group. IL-12 production by serum in TNBS+EGb group was lower than that of TNBS group (8.2±2.2 vs 25.8±4.8, P < 0.01). The ratio of IL-12/IL-4 was lower in TNBS+EGb group compared with TNBS group (serum: 1.13±0.49 vs 6.4±1.8, P < 0.01). The ratio of IL-12/IL-4 was lower than that in TNBS+EGb group compared with TNBS group (splenocytes: 5.2±2.0 vs 21.9±4.9, P < 0.01; colonic mucosa: 20.9±7.97 vs 65.9±18, P < 0.01; serum: 1.1±0.3 vs 3.4±0.8, P < 0.01).
CONCLUSION: TNBS-induced ulceratived colitis is a Th1 type dominant (IL-12 overproduction)murine model; EGb has protective effects on ulcerative colitis of rat by suppresses of increased IL-12 and IFN-α and maintaines the balance of helper T cell 1 with helper T cell 2.
- Citation: Zhou YH, Yu JP, He XF, Yu XQ. Effects of Ginkgo biloba extract on cytokines in rats with TNBS-induced ulcerative colitis. Shijie Huaren Xiaohua Zazhi 2004; 12(2): 371-375
- URL: https://www.wjgnet.com/1009-3079/full/v12/i2/371.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v12.i2.371
炎症性肠病 (IBD)包括溃疡性结肠炎(UC)和克罗恩病(CD). 是病因和发病机制未确定的慢性非特异性胃肠道炎症性疾病[1-3]. 发病机制复杂, 与遗传易感性, 免疫调节紊乱, 环境等多因素有关[4]. 越来越多的研究表明免疫因素是其最基本的发病机制[5]. 近来对细胞因子的研究对探讨UC的病因, 发病机制, 治疗具有重要的现实意义[6-11]. 如促炎性细胞因子与抗炎细胞因子间的平衡失调被视为IBD的一个重要发病机制[12-13].
达纳康是银杏叶标准化萃取物, 具有消除氧自由基, 增强抗氧酶活性, 抑制脂质过氧化, 减轻氧自由基对ATP酶的攻击, 解除红细胞聚集作用和拮抗血小板聚集活化因子, 改善微循环等作用[14]. 有可能对大鼠UC细胞因子有一定影响. 我们用达纳康灌胃来治疗溃疡性结肠炎, 观察其对大鼠UC中细胞因子的影响, 探讨达纳康的免疫药理作用.
SPF级健康♂SD大鼠48只(180±20 g). 购于武汉大学医学院动物中心; 2.4.6-三硝基苯磺酸(TNBS)(Sigma); EGb为贵州信邦制药股份有限公司生产. SOD、MDA试剂盒购于南京建成生物工程公司. 大鼠IL-4和IFN-α检测试剂盒由晶美生物工程有限公司提供, 大鼠IL-12检测试剂盒, 购自法国IMMUNDTECH公司. 其他试剂为进口或国产分析纯.
将48只动物随机分为空白对照组(Normal group), 三硝基苯磺酸组(TNBS group), 三硝基苯磺酸+生理盐水组(TNBS+NS group)三硝基苯磺酸+达纳康组(TNBS+EGb group) 4组, 空白对照组12只不作任何处理. 实验组大鼠术前禁食24 h, 自由饮水, 造模时乙醚麻醉大鼠后用一直径2.0 mm, 长约12 cm的硅胶管由肛门轻缓插入深约8 cm, 三硝基苯磺酸组以含150 mg/kg TNBS的50%乙醇溶液缓慢推入结肠, 诱导UC形成[15]. 为确保注入之TNBS能够在大肠内弥散分布, 注入后将大鼠尾巴提起, 持续倒置30 s. 三硝基苯磺酸+生理盐水组12只, TNBS处理同上, 同时以2 mL/只的0.9%生理盐水溶液灌胃, 1次/d. 三硝基苯磺酸+达纳康组12只, TNBS处理同上, 同时给予EGb, 用生理盐水配成1.0 g/kg灌胃, 1次/d. 三硝基苯磺酸组建立3 wk后处死动物, 三硝基苯磺酸+生理盐水组和三硝基苯磺酸+达纳康组6 wk后处死动物, 取肛门至盲肠段结肠(约8 cm)沿肠结膜纵轴剪开, 冷生理盐水冲洗干净, 肉眼进行大体形态评分. 取肠组织一部分以4.0%多聚甲醛固定, 石蜡包埋, 连续切片, HE染色镜下评价炎症和溃疡, 结肠组织损伤大体形态和组织学形态评分方法[16-17] : 大体形态损伤评分指标包括粘连局部充血, 溃疡形成及炎症, 按有无、轻、重分别计0、1、2分, 溃疡或/和炎症大于2 cm, 病变范围每增加1 cm, 计分加1分. 组织学损伤评分指标包括溃疡炎症肉芽肿, 纤维化按有无及轻重计为0、1、2分, 病变深度(达黏膜下层1分、肌层2分、浆膜层3分), 各项相加得总分.
1.2.1 麻醉大鼠后, 腹腔静脉采血4 ml左右, 置无菌试管中, 室温静置自然凝固收缩后, 于37 ℃水浴中, 孵育20 min, 以4 000 r/min离心10 min, 分离血清, 保存于-20℃冰箱, 进行ELISA检测.
1.2.2 处死大鼠后迅即取出脾脏, 置于40 μm网目的细胞筛上用试管将脾脏磨碎, 冷PBS冲洗, 取100目尼龙网过滤, 至50 ml离心管中, 3 000 r/min离心 5 min后, 用含10% FBS的RPMI1640营养液, 重复洗涤3次, 3 000 r/min离心, 用含10% FBS的RPMI1640营养液6 ml重悬, 用台盼蓝测细胞活性大于95%, 调整细胞计数, 1×106/ml的浓度, 于37 ℃ 5% CO2条件下培养48 h, 取上清液-70 ℃冻存待用.
1.2.3 大鼠处死后即取炎症改变最明显处的结肠组织 (1 g左右)在2-5 ml冰冷的PBS液中除去血液, 滤纸拭干, 称湿重. 再以PBS液清洗3次后以含10% FBS(灭活小牛血清)青链霉素(各100 u/ml)的RPMI1640组织培养液清洗3次接种入48孔培养板中, 每孔加入400 μl培养液浸没组织块在5% CO2 37 ℃条件下无菌培养48 h, 收集上清液分装4个EP管于-70 ℃保存待用. 采用ELISA试剂盒检测培养上清液中的IL-4、IFN-α的含量, 按照说明书进行操作, 用酶标仪(BIO-TCK/USA)进行检测.
结果判断: 根据标准品不同浓度A值绘制标准曲线, 通过标本的A值在标准曲线上查出其浓度, 除以组织湿重, 即为该样品的局部细胞因子水平[18-19].
统计学处理 实验数据以mean±SD表示, 采用单因素方差分析处理, 以P<0.01为有统计学意义.
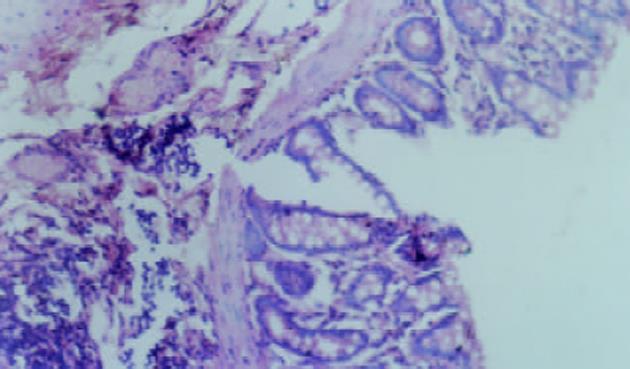
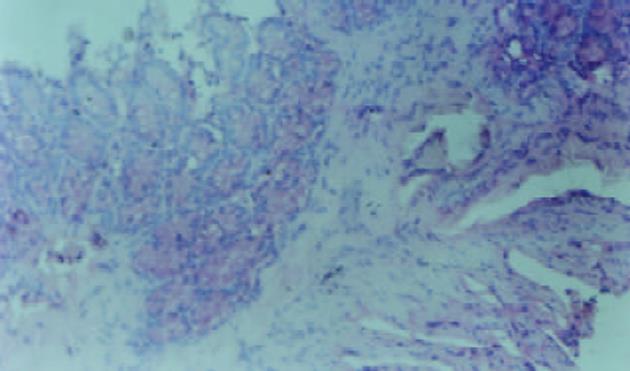
对照组无腹泻, 黏膜光滑无溃疡, 腺体排列整齐. 各用药组大鼠在灌肠后24 h见懒动、厌食, 腹泻, 多为不成形稀便, 可持续3 wk以上. 3 wk后处死动物, 三硝基苯磺酸组和三硝基苯磺酸+生理盐水组, 可见结肠与周围组织粘连伴近端肠腔扩张, 黏膜充血水肿, 溃疡形成, 肠道于病变部位出现狭窄, 光镜下可见溃疡及炎性渗出物, 主要表现为中性粒细胞浸润, 可见数量不等的单个核细胞和嗜酸性粒细胞, 也可见增生的纤维母细胞, 且出现黏膜腺体排列变形. 大体形态评分和组织学评分明显增高(P<0.01)见表1、图1. 三硝基苯磺酸+达纳康组, 可见黏膜充血水肿较轻, 可见正在愈合的溃疡, 结肠结构基本正常, 大体形态评分和组织学损伤评分减低(P<0.01)见表1、图2.
三硝基苯磺酸组和三硝基苯磺酸+生理盐水组较空白对照组, 脾细胞, 血清和大肠黏膜, IFN-α浓度显著升高(P<0.01, 表2). 而三硝基苯磺酸+达纳康组较三硝基苯磺酸组与三硝基苯磺酸+生理盐水组血清、脾细胞、大肠黏膜生成IFN-α量明显下降(P<0.01, 表2). 三硝基苯磺酸组与三硝基苯磺酸+生理盐水组中脾细胞, 大肠黏膜, 血清IFN-α浓度无明显改变.
三硝基苯磺酸组和三硝基苯磺酸+生理盐水组较空白对照组, 脾细胞, 血清和大肠黏膜中较空白对照组脾细胞, 血清和大肠黏膜中IL-4生成呈明显下降(P<0.01, 表3). 而三硝基苯磺酸+达纳康组较三硝基苯磺酸组和三硝基苯磺酸+生理盐水组中脾细胞, 血清和大肠黏膜中IL-4生成呈明显升高(P<0.01, 表3). 三硝基苯磺酸组和三硝基苯磺酸+生理盐水组中脾细胞、大肠黏膜、血清生成IL-4无明显改变.
三硝基苯磺酸组和三硝基苯磺酸+生理盐水组较空白对照组中血清中IL-12浓度及IL-12/IL-4比值增高(P<0.01, 表4)而三硝基苯磺酸+达纳康组较三硝基苯磺酸组与三硝基苯磺酸+生理盐水组血清中IL-12浓度及IL-12/IL-4比值明显下降(P<0.01, 表4). 三硝基苯磺酸组与三硝基苯磺酸+生理盐水组血清中IL-12浓度及IL-12/IL-4比值无明显改变.
达纳康(EGb)具有很强的抗氧自由基, 增强抗氧酶, 活性的作用. 对心、脑、肾、血管缺血性损伤有明显的防护作用. 可增强中枢神经系统功能. 可拮抗血小板活性因子(PAF)(platelet activating factor)达到保肝效果[20-23]. 但有关EGb对炎症性肠病疗效的报道较少.
炎症性肠病的病因和发病机制尚不明确. 随着分子生物学技术以及基础研究的不断进展, 对于T细胞各种细胞因子的作用, 特别是促炎因子与抗炎细胞因子的研究大大推动了IBD的发病机制的研究和机应治疗的进展[24-25]. Th1/Th2的细胞因子水平已为解释一些自身免疫性疾病提供了很好的模型. 辅助性T细胞根据CD4+细胞分泌的两类不同细胞因子, 分为Th1和Th2细胞, Th1细胞主要分泌IL-2、IFN-α、IFN-β等, 而Th2细胞主要分泌IL-4、IL-6、IL-10等, Th1/Th2细胞具有相互拮抗作用, 通过阻止另一类细胞的产生成效应功能的实现来影响Th1/Th2细胞间的平衡, IL-12可通过NK细胞诱导IFN-α的复制, 可刺激原初CD4+T细胞分化为Th1亚群, 相应的IL-12和IFN-α的产生可控制Th1及Th2优势的T细胞的发展. 这样有助于Th1分化优势及对IL-4和IL-10的控制并提高Th2的分化. IFN-α能促进Th2细胞分化为Th1细胞, 影响Th1/Th2比率, 而IL-4能促进Th0细胞分化为Th1细胞, 并抑制Th1细胞, 分沁其系列因子, 促进体液免疫应答. Th1细胞主要介导与细胞和局部炎症有关的免疫应答, 参与细胞免疫而Th2细胞的主要功能为刺激及细胞增生并产生抗体与体液免疫有关. 机体要处于良好的免疫状态, 应保持Th1/Th平衡, 才能使机体不处于免疫抑制状态. 研究表明Th1/Th2细胞因子在IBD的发病中有重要的作用, 如何调理Th细胞的分化, 对临床疾病的治疗有重大意义[26-32].
炎症性肠病(IBD)是一类主要累及结、直肠的自身免疫性疾病, TNBS诱导的大鼠结肠炎组织学改变的许多特点与人类IBD相似, TNBS诱发结肠炎的确切机制尚未阐明, 可能为TNBS与结肠炎上皮细胞的赖氨酸共价结合, 从而改变表面蛋白质, 形成自身抗原, 导致一系列免疫反应所致. TNBS诱导的结肠炎以IL-12驱动的Th1反应为主. 以IFN-α升高为标志[33-34]. 抗IL-12治疗可改善其炎症[35]. 表现为全结肠全层性炎症和溃疡偶见肉芽肿, 炎症持续时间长, 便于观察药物疗效等. TNBS模型广泛用于筛选有治疗IBD潜力的疗法及研究其作用机制. 该模型持续时间较长, 体现急性炎症向慢性转化的动态过程并伴以溃疡形成, 该模型TNBS价格有限, 实验花费不大, 简单易行, 易于复制, 是一种较为理想的结肠炎动物模型. 故本实验采用三硝基苯磺酸灌肠建立大鼠溃疡性结肠炎模型, 探讨达纳康对溃疡性结肠炎的保护作用.
我们应用达纳康治疗部分溃疡性结肠炎, 取得较好的临床疗效. 本实验通过在建立大鼠UC模型的用达纳康灌胃治疗后, 结果TNBS+EGb组大鼠肠黏膜组织大体形态和组织学评分明显低于单纯TNBS组和TNBS+NS组. 本研究结果表明, TNBS诱导的实验性大鼠结肠炎模型的血清病变局部的大肠黏膜, 以及脾细胞产生的IFN-α升高, IL-12升高, 提示Th1细胞功能加强, 而IL-4降低, 提示Th2细胞功能下降, IFN-α/IL-4比值升高, IL-12/IL-4比值升高, 机体Th1/Th2细胞平衡紊乱, 提示TNBS诱导的实验性大鼠肠炎模型, 是以Th1亚型为主的免疫应答反应[36]. Th1/Th2平衡遭受破坏是UC的发病机制之一.
本研究表明达纳康既可抑制IL-12、IFN-α(Th1)生成, 又可提高IL-4生成, 由此可以推测, 达纳康治疗UC的机制可能与其抑制IL-12, IFN-α(Th1)生成, 恢复Th1/Th2的细胞因子的平衡有关. 达纳康作为抗UC的药物具有良好的临床应用前景.
编辑: N/A
| 1. | Cui HF, Jiang XL. Treatment of corticosteroid-resistant ulcerative colitis with oral low molecular weight heparin. World J Gastroenterol. 1999;5:448-450. [PubMed] [DOI] |
| 3. | Jiang XL, Cui HF. An analysis of 10218 ulcerative colitis cases in China. World J Gastroenterol. 2002;8:158-161. [PubMed] [DOI] |
| 4. | Lehmann FS. [Pathophysiology of inflammatory bowel disease]. Ther Umsch. 2003;60:127-132. [PubMed] [DOI] |
| 5. | Sartor RB. Cytokines in intestinal inflammation: pathophysiological and clinical considerations. Gastroenterology. 1994;106:533-539. [PubMed] [DOI] |
| 6. | Stevceva L. Cytokines and their antagonists as therapeutic agents. Curr Med Chem. 2002;9:2201-2207. [PubMed] [DOI] |
| 7. | Bouma G, Strober W. The immunological and genetic basis of inflammatory bowel disease. Nat Rev Immunol. 2003;3:521-533. [PubMed] [DOI] |
| 8. | Rogler G, Andus T. Cytokines in inflammatory bowel disease. World J Surg. 1998;22:382-389. [PubMed] [DOI] |
| 9. | Ogata H, Hibi T. Cytokine and anti-cytokine therapies for inflammatory bowel disease. Curr Pharm Des. 2003;9:1107-1113. [PubMed] [DOI] |
| 10. | Ardizzone S, Bianchi Porro G. Inflammatory bowel disease: new insights into pathogenesis and treatment. J Intern Med. 2002;252:475-496. [PubMed] [DOI] |
| 11. | Wu HG, Zhou LB, Pan YY, Huang C, Chen HP, Shi Z, Hua XG. Study of the mechanisms of acupuncture and moxibustion treatment for ulcerative colitis rats in view of the gene expression of cytokines. World J Gastroenterol. 1999;5:515-517. [PubMed] [DOI] |
| 12. | 陈 刚, 韩 英, 宋 迎新, 村 田有志, 伊 东重豪, 栋 方昭博. 雷公藤多甙对尼古丁预处理的小鼠肠炎模型脾淋巴细胞因子的影响机制. 世界华人消化杂志. 2002;10:418-421. [DOI] |
| 15. | Zheng L, Gao ZQ, Wang SX. A chronic ulcerative colitis model in rats. World J Gastroenterol. 2000;6:150-152. [PubMed] [DOI] |
| 16. | Dieleman LA, Palmen MJ, Akol H, Bloemena E, Peña AS, Meuwissen SG, Van Rees EP. Chronic experimental colitis induced by dextran sulphate sodium (DSS) is characterized by Th1 and Th2 cytokines. Clin Exp Immunol. 1998;114:385-391. [PubMed] [DOI] |
| 17. | Zhu F, Qian J, Pan G. [The establishment of TNBS-induced experimental colitis]. Zhongguo Yixuekexueyuan Xuebao. 1998;20:271-278. [PubMed] |
| 18. | Crabtree JE, Shallcross TM, Heatley RV, Wyatt JI. Mucosal tumour necrosis factor alpha and interleukin-6 in patients with Helicobacter pylori associated gastritis. Gut. 1991;32:1473-1477. [PubMed] [DOI] |
| 20. | Bridi R, Crossetti FP, Steffen VM, Henriques AT. The antioxidant activity of standardized extract of Ginkgo biloba (EGb 761) in rats. Phytother Res. 2001;15:449-451. [PubMed] [DOI] |
| 21. | Shen J, Wang J, Zhao B, Hou J, Gao T, Xin W. Effects of EGb 761 on nitric oxide and oxygen free radicals, myocardial damage and arrhythmia in ischemia-reperfusion injury in vivo. Biochim Biophys Acta. 1998;1406:228-236. [PubMed] [DOI] |
| 22. | Lee EJ, Chen HY, Wu TS, Chen TY, Ayoub IA, Maynard KI. Acute administration of Ginkgo biloba extract (EGb 761) affords neuroprotection against permanent and transient focal cerebral ischemia in Sprague-Dawley rats. J Neurosci Res. 2002;68:636-645. [PubMed] [DOI] |
| 23. | Itil TM, Eralp E, Tsambis E, Itil KZ, Stein U. Central Nervous System Effects of Ginkgo Biloba, a Plant Extract. Am J Ther. 1996;3:63-73. [PubMed] [DOI] |
| 24. | Monteleone G, MacDonald TT. Manipulation of cytokines in the management of patients with inflammatory bowel disease. Ann Med. 2000;32:552-560. [PubMed] [DOI] |
| 25. | Anand AC, Adya CM. Cytokines and inflammatory bowel disease. Trop Gastroenterol. 1999;20:97-106. [PubMed] |
| 26. | Dohi T, Fujihashi K, Kiyono H, Elson CO, McGhee JR. Mice deficient in Th1- and Th2-type cytokines develop distinct forms of hapten-induced colitis. Gastroenterology. 2000;119:724-733. [PubMed] [DOI] |
| 27. | Romagnani S. Th1/Th2 cells. Inflamm Bowel Dis. 1999;5:285-294. [PubMed] [DOI] |
| 28. | Blumberg RS, Saubermann LJ, Strober W. Animal models of mucosal inflammation and their relation to human inflammatory bowel disease. Curr Opin Immunol. 1999;11:648-656. [PubMed] [DOI] |
| 29. | Parronchi P, Romagnani P, Annunziato F, Sampognaro S, Becchio A, Giannarini L, Maggi E, Pupilli C, Tonelli F, Romagnani S. Type 1 T-helper cell predominance and interleukin-12 expression in the gut of patients with Crohn's disease. Am J Pathol. 1997;150:823-832. [PubMed] |
| 30. | Klein W, Tromm A, Griga T, Fricke H, Folwaczny C, Hocke M, Eitner K, Marx M, Duerig N, Epplen JT. Interleukin-4 and interleukin-4 receptor gene polymorphisms in inflammatory bowel diseases. Genes Immun. 2001;2:287-289. [PubMed] [DOI] |
| 31. | Fort M, Lesley R, Davidson N, Menon S, Brombacher F, Leach M, Rennick D. IL-4 exacerbates disease in a Th1 cell transfer model of colitis. J Immunol. 2001;166:2793-2800. [PubMed] [DOI] |
| 32. | Camoglio L, Te Velde AA, Tigges AJ, Das PK, Van Deventer SJ. Altered expression of interferon-gamma and interleukin-4 in inflammatory bowel disease. Inflamm Bowel Dis. 1998;4:285-290. [PubMed] |
| 33. | Boirivant M, Fuss IJ, Chu A, Strober W. Oxazolone colitis: A murine model of T helper cell type 2 colitis treatable with antibodies to interleukin 4. J Exp Med. 1998;188:1929-1939. [PubMed] [DOI] |
| 34. | Tozawa K, Hanai H, Sugimoto K, Baba S, Sugimura H, Aoshi T, Uchijima M, Nagata T, Koide Y. Evidence for the critical role of interleukin-12 but not interferon-gamma in the pathogenesis of experimental colitis in mice. J Gastroenterol Hepatol. 2003;18:578-587. [PubMed] [DOI] |
| 35. | Schmidt C, Marth T, Wittig BM, Hombach A, Abken H, Stallmach A. Interleukin-12 antagonists as new therapeutic agents in inflammatory bowel disease. Pathobiology. 2002;70:177-183. [PubMed] [DOI] |
| 36. | Spencer DM, Veldman GM, Banerjee S, Willis J, Levine AD. Distinct inflammatory mechanisms mediate early versus late colitis in mice. Gastroenterology. 2002;122:94-105. [PubMed] [DOI] |